钚生物动力学模型的研究现状
2023-07-04崔双双董娟聪李幼忱
崔双双 董娟聪 李幼忱
中国辐射防护研究院放射医学与环境医学研究所放射生物室,太原 030006
核能作为一种高效优质的清洁能源,在国际上得到了广泛的应用,同时也是我国能源开发的重要发展方向之一[1]。我国对核能应用产生的乏燃料的处理方式为“闭式”核燃料循环,对可利用的核能资源进行回收再利用,而钚是该过程中被重点关注的核素之一[2]。人体摄入钚的途径有3 种:吸入、食入和经由皮肤伤口吸收。钚摄入后主要滞留在骨骼、肝脏、呼吸道等部位,且难以排出。钚衰变时会释放出α 粒子,其比活度高且半衰期长,是极毒放射性核素之一,长期滞留体内会引发骨肉瘤、肝癌、肺癌、肺纤维化等疾病[2-4]。放射性核素钚是后处理厂工作人员的主要职业危害之一,也是职业辐射防护关注的重点。为了评估职业人员受到危害的程度,对摄入体内的钚进行内照射剂量估算,需要明确钚在体内的转移代谢过程[5]。国际放射防护委员会(International Commission on Radiological Protection,ICRP)提出了用不同的生物动力学模型来描述钚进入人体后的转移代谢过程,包括呼吸道模型、消化道模型、皮肤伤口模型和钚系统模型。随着相关研究的不断深入,生物动力学模型也在不断更新。除此之外,为了减少钚在体内的滞留,需要进行促排治疗,从而加快其从体内排出,降低危害[6]。但药物促排治疗会改变钚在体内的转移代谢过程,进而影响内照射剂量估算结果的准确性。为此,研究人员提出了针对促排治疗后的钚生物动力学模型[7]。不同的生物动力学模型描述了钚在体内不同的转移代谢过程。本文主要对钚在体内的转移代谢过程的研究现状进行综述。
1 钚摄入模型
1.1 呼吸道模型
吸入是人体摄入钚的最常见途径,目前所用的钚呼吸道模型是ICRP 第130 号出版物(2015)提出的通用模型(图1)[8]。该模型将呼吸道分为胸腔区和胸外区。胸腔区包括气管区及支气管区、细支气管区和肺泡间质区,还有这4 个区的淋巴组织。胸外区则包括前鼻通道、后鼻通道、咽和喉区,还有鼻腔沉积和胸外区淋巴结。相较于ICRP 第66 号出版物(1994)中的呼吸道模型[9],该模型的前鼻通道不再包括口腔[8]。

图1 钚呼吸道模型[8]Figure 1 Respiratory tract model of plutonium
生物动力学模型的可靠性会影响内照射剂量估算结果的准确性。为了验证模型的可靠性,Šefl 等[10]通过对美国曼哈顿计划中曾吸入过可溶性钚的工作人员进行尸检,测得呼吸道钚的活度为(282±3)Bq,而使用ICRP 第130 号出版物提出的生物动力学模型结合测量数据,计算得到职业人员呼吸道中钚的活度为393 Bq,这与实际测量值存在偏差。目前还没有研究者对钚在呼吸道模型不同分区中的分布进行详细研究。Tolmachev 等[11]通过对玛雅克核工厂的工作人员进行尸检分离肺部组织后,针对人体上呼吸道的钚滞留情况进行了分析研究,结合ICRP 出版物的呼吸道模型,结果显示上呼吸道的可溶性钚分布均匀。与此同时,为了明确可溶性钚被吸入后在肺部的分布,Puncher 等[12]对急性吸入硝酸钚的玛雅克核工厂工作人员的生物数据进行贝叶斯分析发现,一部分钚会以化学结合的形式沉积在肺组织,另一部分则直接被吸收入血。钚在肺部结合的部分用结合分数(fb)来描述,该值与肺部钚的剂量有关。Birchall 等[13]通过分析动物实验以及玛雅克核工厂工作人员的尸检数据,认为目前没有一个较为准确的结合分数。Poudel 等[14]通过对2 例职业人员的尸检数据进行分析,发现结合分数(fb)会影响剂量估算值。
目前的研究工作除对工作人员的生物数据进行分析之外,还开展了相关体外实验研究,研究钚的转移过程。van der Meerena 等[15-16]利用诱导分化的人肺部巨噬细胞和人肺腺癌细胞探究了钚在这两种细胞中的转移代谢过程,结果显示,柠檬酸钚在细胞中的转移速率高于硝酸钚和胶体钚,胶体钚在巨噬细胞中的滞留量最高;他们利用此模型还探究了促排药物DTPA 对钚在这两种细胞中转移代谢过程的影响,结果显示DTPA 会加快细胞中钚的排出。此外,van der Meerena 等[17]还提出了利用体外化学模型来预测钚在肺部的转移过程,他们利用凝胶来模拟钚在肺部的滞留位点,使用NaCl/KCl 混合盐溶液、Gamble 溶液(代表细胞外肺液)以及人工溶酶体液(代表细胞内溶酶体液)模拟与钚转移过程的相关体液,建立了一种结合静态相(滞留位点)和动态相(转移位点)的体外呼吸道模型来评估钚的转移情况。Griffiths 等[18]也使用了相同的研究方法比较了钚在不同相之间的转移情况,并通过改变静态相中的成分模拟不同滞留位点,优化了该模型。这种模型虽然不能完全代表体内的复杂环境,但可用来预测放射性核素摄取后在体内的转移情况。与体内实验相比,可通过开展体外实验为钚生物动力学研究进一步提供数据支持[19]。在实际工作中,细胞模型避免了个体差异、种属差异以及体内复杂生理环境的影响,并可用于开展关于促排药物对钚转移代谢过程的影响及钚转移机制的进一步研究,相较于简化后的非细胞模型,其更适合开展钚的生物动力学研究。
1.2 消化道模型
食入钚的情况较为少见,部分钚可由呼吸道摄入,经吞咽后进入消化道。目前所用的钚消化道模型是ICRP 第100 号出版物(2006)所提出的通用模型(图2)[20]。该模型将消化道分为:口腔、食管、胃、小肠、右结肠、左结肠、乙状结肠直肠7 部分。钚在消化道中可能会发生化学形式的改变,从而影响钚的吸收,这一过程主要发生在胃及小肠。相较于之前的ICRP 第30 号出版物(1979)[21],ICRP第100 号[22]出版物根据年龄和性别调整了转移系数[14]。Šefl 等[10]通过对曼哈顿计划中工作人员的尸检数据进行分析,结果表明目前的消化道模型可用来描述钚在人体的滞留与排出过程。但由于食入钚的途径较为少见,相关研究也较少,目前的模型虽然可以描述钚在消化道的生物动力学,但仍不够详细,需要进一步完善细化。
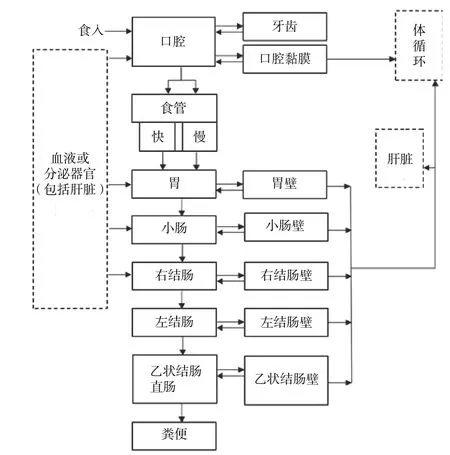
图2 钚消化道模型[20]Figure 2 Alimentary tract model of plutonium
1.3 皮肤伤口模型
经由皮肤伤口进入体内也是钚较常见的被摄入途径之一[22-23]。ICRP 第130 号出版物[8]建议使用直接注入血液的剂量转移系数评估由伤口摄入的内照射剂量,钚可通过伤口直接进入血液并被输送到全身,最终沉积在肝脏和骨骼等多个器官中[14]。
钚的皮肤伤口生物动力学模型是由美国国家辐射防护委员会(National Committee on Radiation Protection,NCRP)在第156 号出版物(2006,图3)[24]中提出。该出版物中提出的模型主要是根据动物实验数据建立的,需要使用人类相关数据做进一步修正[25]。该模型将进入伤口的放射性核素分为4 类:可溶性物质、胶体状物质、颗粒和碎片。同时模型被分成了5 部分:可溶性隔室,胶体和中间态隔室,颗粒、聚合体和束缚态隔室,截留的颗粒和聚合体隔室以及碎片隔室[24,26]。Poudel 等[27]利用4 例职业人员的尿样数据,利用ICRP 第67 号出版物[24]中的钚皮肤系统模型计算其伤口处钚的滞留量,对NCRP 第156 号出版物发布的钚皮肤伤口模型进行了验证,结果表明,4 例中有3 例与NCRP 所发布的皮肤伤口模型计算数值相符,另外1 例的伤口滞留量被低估。造成这一结果的主要原因可能是钚的化学形式复杂以及不同个体间生物动力学的差异。NCRP提出的皮肤伤口模型主要是利用动物实验钚伤口转移速率的研究数据建立的,应根据钚在人体伤口的转移数据进行仔细验证和修改。Schadilov 等[28]利用职业人员伤口处的测量数据及排泄数据对NCRP 第156号出版物[24]中的转移系数进行了修正:胶体和中间态隔室到可溶性隔室由原来的0.024 变为0.164;胶体和中间态隔室到聚合体和束缚态隔室由原来的0.010 变为0.004。修正后研究人员又利用其他经由伤口摄入的职业人员相关数据对修正后的转移系数进行了验证,认为修正后的转移系数可以提高估算结果的准确性。在职业工作中,不同的意外照射导致的伤口处的摄取量可能会有很大不同,故评估其内照射剂量时要依据实际情况进行处理。与此同时,皮肤伤口模型需要更多生理或职业人员的钚生物动力学数据优化修正,使其更加完善并更贴近真实摄取情况。
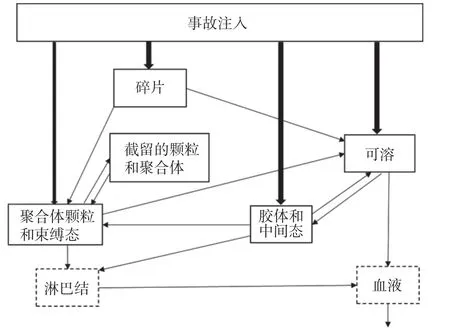
图3 钚皮肤伤口模型[24]Figure 3 Skin (wound) model of plutonium
总之,虽然钚生物动力学模型在不断更新,但是仍存在着不确定性。呼吸道吸入仍是最常见的摄入途径,有关呼吸道的研究最为广泛且全面,而关于消化道模型的研究较少。另外,目前建议使用的皮肤伤口模型是NCRP 第156 号出版物[26]中发布的模型,可以将其与ICRP 建议的注射途径所得到的结果进行对比或有机地结合以实现该模型的优化。
2 钚系统模型
钚系统模型描述了放射性核素进入体循环后随时间在体内的分布、滞留以及从体内排出的情况。目前所用的是Leggett 等[29]在2005 年提出并收录在ICRP 第141 号出版物中的钚系统模型(图4)[30]。钚系统模型不同其他锕系元素的通用系统模型。较之前ICRP 第67 号出版物(1993)提出的钚系统模型[31],ICRP 第141 号出版物[30]的钚系统模型将肝脏和骨骼的分配沉积系数由0.3 和0.5 改为0.6 和0.3。肝脏和骨骼是钚进入体内后的主要滞留器官,也是系统模型关注的重点。Romanov 等[5]对早期玛雅克核工厂的工作人员进行尸检发现,90%的钚沉积在肝脏和骨骼,且这种分布不受摄入钚的化学形式的影响。Langham 等[32]使用大鼠进行钚生物动力学研究,结果表明肝脏和骨骼是钚的主要靶器官,10%~20%的钚在肝脏滞留,60%~80%的钚在骨骼滞留,这与钚在人体肝脏和骨骼中的分布比例差异较大。Leggett[33]通过对职业人员以及志愿者的排泄物及尸检数据进行分析,发现肝脏是钚早期的滞留位点。随着钚在体内滞留时间的延长,部分滞留在肝脏的钚会入血向骨骼转移,并长期滞留在骨骼。Mcinroy 等[34]对6 例核工业工人的尸检数据进行分析,发现(35.4±12.5)%的钚在肝脏滞留,(53.7±12.5)%的钚在骨骼滞留,同时发现使用尿液进行剂量估算的结果比实际测量结果高。Durbin[35]通过对曼哈顿计划中18例职业人员的排泄及尸检数据进行再次分析,发现31%的钚在肝脏滞留,49%的钚在骨骼滞留。这些数据可能是ICRP 第67 号出版物[31]中给出转移系数的依据。Suslova等[36]对120 例玛雅克核工厂工人的尿钚及尸检数据进行分析,发现在肝脏和骨骼的初始沉积比率为50%∶38%,且肝脏疾病会导致钚排泄量增加而滞留量减少,导致滞留体内的钚在骨骼的分布比率上升,在肝脏的分布比率下降。Warner等[37]通过对2 例志愿者体内注射柠檬酸钚(237Pu),观察到50%的钚滞留在肝脏,42%的钚滞留在骨骼。这些数据可能对ICRP 第141 号出版物[30]中肝脏和骨骼沉积系数的转变提供了参考。

图4 钚系统模型[30]Figure 4 Systemic model of plutonium
除了系数上的变化,ICRP 第141 号出版物[30]提出的新模型将肝脏隔室在原有肝1 隔室、肝2 隔室的基础上,新增了肝0 隔室来代表进入肝脏的快速转移部分[30]。血液隔室也在原有血液0 隔室、血液1 隔室的基础上增加了血液2 隔室,其表示钚经过各组织后又再次吸收入血的过程。同时还新增了肝1 隔室向血液2 隔室转移的路径(约80%)。钚进入肝0 隔室后大部分(约98%)转移至肝1 隔室,小部分转移至胆汁并随之进入小肠。进入肝1 隔室的钚除再次入血外,还有部分转移至肝2 隔室[29-30]。另外,ICRP 141号出版物[30]中给出的钚转移系数是对动物实验、职业人员或志愿者的排泄物及尸检数据进行分析后推理得出的[30]。
综上,虽然对钚系统模型进行了更新优化,但仍存在一些不足。不同物种间肝脏功能的差异较大,动物实验数据外推至人的肝脏生物学数据不确定性较高,应给予人类相关试验数据更高的权重,同时可以开展相关的细胞实验,研究钚在体内各种组织、器官中的转移代谢过程。钚系统模型应更贴近生理情况,为动物实验数据的外推提供基础。由于钚系统模型描述的是钚吸收入血后的转移代谢过程,其对靶器官的内照射剂量估算尤为重要。由于钚的生物动力学模型对转移代谢过程的简化,增加了剂量估算时的不确定性,导致结果的准确性降低。可在现有研究的基础上针对钚的主要靶器官开展有关系统模型的细胞实验、体外非细胞实验,模拟钚的转移代谢过程,进而对模型进行优化完善。
3 钚的促排模型
由于钚进入体内后排除速度缓慢,可能长期滞留在体内,诱发严重的辐射生物效应,所以需要使用促排药物加快钚的排除[38-41]。Avtandilashvili 等[42]通过对伤口摄入钚后使用DTPA 进行促排的职业人员的排泄物及尸检数据进行分析,认为DTPA 有效减少了人体对钚的摄取以及钚在人体内的滞留。但使用促排药物会改变钚在体内的生物动力学,从而影响内照射剂量估算的准确性[39]。Durbin[35]通过对20 世纪40 年代注射过钚溶液的志愿者的排泄物及尸检数据进行重新分析,发现经DTPA促排治疗后的志愿者尿液中钚的含量是未经DTPA 促排的志愿者尿液钚含量的10 倍左右。所以,对有促排史的职业人员进行内照射剂量估算时使用非促排钚生物动力学模型是不够准确的,故钚的促排模型被提出。
美国铀及超铀核素登记处(U.S.Transuranium and Uranium Registries,USTUR)利用伤口摄入钚的职业人员的数据提出了改进的钚促排模型系统。该模型包括3 部分,分别描述了促排前、静脉注射Ca-DTPA 和形成Pu-DTPA螯合物后的生物动力学行为。该模型能够同时拟合促排前后的尿液测定数据,同时可以对钚在骨骼和肝脏中的滞留量做出准确预测[43]。Dumit 等[44]将钚促排模型系统与ICRP所提出的呼吸道模型和消化道模型结合,对职业人员摄入钚后的尿液、粪便以及尸检数据进行分析,对钚促排模型系统进行检验,结果证实了该模型有助于分析促排后的生物数据以及预测钚在骨骼和肝脏的滞留情况。除此之外,Konzen 和Brey[45]在ICRP 第67 号出版物中钚系统模型的基础上,增加了Pu-DTPA 的促排隔室,通过对比原有模型与改进后模型的剂量估算结果,发现改进后的促排模型更接近实际情况。
综上,使用促排药物会改变钚的生物动力学,利用非促排动力学模型进行剂量估算不准确。目前临床上仍以DTPA 促排治疗为主,有关钚的促排模型也主要是针对该治疗方式建立的。钚的促排治疗需要研发更为高效低毒的促排药物,也需要针对不同促排药物提出相对应的促排模型。此外,目前未提出涵盖整个促排过程的促排模型,存在局限性。目前的模型主要是依据经伤口摄入钚的职业人员的排泄数据给出,相关数据较少,需要更多人员数据或相关实验数据加以验证和改进。同时,可以针对肝脏和骨骼等靶器官进行细胞学层面的生物动力学研究来改进现有的促排生物动力学模型。
4 小结与展望
综上所述,生物动力学模型的准确性影响着内照射剂量估算的结果。目前钚生物动力学模型仍不够准确,需要开展相关研究来优化模型以提高模型的准确性和可靠性。针对利用模型进行内照射剂量估算时所产生的不确定性,要找到其来源后,降低该不确定性,提高估算的准确性。完善促排后的钚生物动力学模型应涵盖整个促排过程,与此同时也需要研发更高效低毒的促排药物。由于人员数据以及动物实验数据存在着局限性,可通过细胞、非细胞等体外实验为模型中的转移系数等相关数据的修正提供数据支持。相信随着相关实验技术的进一步发展,未来会提出更为贴近人体真实摄入情况下的相关生物动力学模型,进行更为准确的内照射剂量估算。同时,未来也会研制出更高效低毒的促排药物,促排治疗对钚生物动力学的改变也将进一步明晰。
利益冲突所有作者声明无利益冲突
作者贡献声明崔双双负责命题的提出、文献的检索、综述的撰写;董娟聪负责综述最后版本的修订;李幼忱负责命题的提出、综述的审阅
