中期18F-FDG PET/CT 预测结外弥漫大B细胞淋巴瘤疗效和预后的方法学研究
2023-07-04李旭刘甫庚陈聪霞崔燕冯茹颜东岳姚稚明
李旭 刘甫庚 陈聪霞 崔燕 冯茹 颜东岳 姚稚明
1 北京医院核医学科 国家老年医学中心 中国医学科学院老年医学研究院,北京 100730;2 北京医院血液科 国家老年医学中心 中国医学科学院老年医学研究院,北京 100730
弥漫大B 细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)在我国是最常见的一种淋巴瘤类型,其中40%为结外弥漫大B 细胞淋巴瘤(extranodal diffuse large B-cell lymphoma,ENDLBCL)[1]。18F-FDG PET/CT 在DLBCL 化疗中期时的分期和疗效评估方面的应用价值已被广泛认可,并写入2021 年美国国家综合癌症网非霍奇金淋巴瘤治疗指南[2]、中华医学会核医学分会淋巴瘤18F-FDG PET/CT 及PET/MR 显像临床应用指南(2021 版)[3]。但是关于中期PET/CT 预测DLBCL疗效和预后的价值,仍存在不少问题有待进一步探讨,例如最佳中期PET/CT 时间点难以确定,各种中期PET/CT评估方法的优劣有待对比研究,国际预后指数(international prognosis index,IPI)虽广泛应用于淋巴瘤的预后分层,但在预测高危患者方面仍具有一定的局限性[2,4-6]。另外,与非EN-DLBCL患者相比,EN-DLBCL 患者病情通常更加高危,疗效和预后也更差[6-7],目前罕有以中期18F-FDG PET/CT 专门预测EN-DLBCL 疗效和预后的研究。本研究对比分析了基于中期18F-FDG PET/CT的几种评估指标在EN-DLBCL 患者疗效和预后评估中的价值,以期寻找基于中期18F-FDG PET/CT的最佳评估指标。
1 资料与方法
1.1 研究对象
回顾性分析2011 年5 月至2020 年4 月在北京医院经组织病理学检查或随访结果明确诊断为EN-DLBCL 的患者77 例,其中,男性35 例、女性42 例,年龄(62.7±16.2)岁。纳入标准:(1)基线PET/CT 显像前未进行淋巴瘤相关治疗;(2)基线PET/CT 显像有结外器官受累;(3)初始化疗3~4 个周期时进行中期PET/CT 显像;(4)初始治疗为6~8 个周期的利妥昔单抗联合一线方案化疗。排除标准:(1)6~8 个周期的初始化疗期间予以放疗或手术切除干预者;(2)PET 显像无阳性病灶者;(3)DLBCL 中枢神经系统受累者;(4)已知或疑诊活动性感染或患有其他肿瘤者。收集纳入研究的患者资料,包括基线PET/CT 图像、中期PET/CT 图像和临床资料[包括性别、年龄、有无B 症状、临床Ann Arbor 分期、初诊时乳酸脱氢酶(LDH)和β2微球蛋白水平、东部肿瘤协作组体能状态评分(ECOG PS)、IPI 等],并完成随访。
本研究符合《赫尔辛基宣言》的原则。因本研究为回顾性临床研究,豁免签署患者知情同意书。
1.2 18F-FDG PET/CT 显像方法
18F-FDG 购自原子高科股份有限公司,放射化学纯度>95%。检查前患者空腹6 h 以上,控制血糖水平<10 mmol/L,按体重静脉注射18F-FDG(7.40 MBq/kg),注药后休息50~70 min,排尿后行PET/CT 扫描(德国Siemens Biograph mCT 型PET/CT)。扫描范围自颅底至股骨中段,先行CT扫描(电压120 kV,螺距1.2),随后行PET 扫描(三维模式采集,每个床位采集2 min)。以CT 数据行PET 图像衰减校正,图像重建采用迭代法,获得轴位、冠状位、矢状位PET 和CT 图像,图像层厚3 mm。
1.3 图像判读
所有图像由1 位核医学主任医师与2 位有7 年以上工作经验的高年资主治医师共同阅片,意见不一致时,讨论得出最终意见。用北京麦迪克斯(MedEx)工作站勾画三维ROI,得到SUVmax。记录基线PET/CT 和中期PET/CT 所有阳性病灶中代谢活性最高的SUVmax作为基线SUVmax和中期SUVmax。
1.4 图像分析标准
(1)中期SUVmax。利用ROC 曲线选取灵敏度与特异度之和最大时所对应的最优点为最佳临界值,将患者分为中期SUVmax<最佳临界值组和SUVmax≥最佳临界值组。(2)ΔSUVmax%。ΔSUVmax%=[(基线SUVmax−中期SUVmax)/基线SUVmax]×100%。按照中华医学会核医学分会淋巴瘤18F-FDG PET/CT及PET/MR 显像临床应用指南(2021 版)推荐,采用ΔSUVmax70%为最佳临界值[3],将患者分为ΔSUVmax%<70%组和ΔSUVmax%≥70%组。(3)中期Deauville 五分法评分。按照2009 年第1 次中期PET淋巴瘤国际工作会议推荐的Deauville 五分法[8],记录选择病灶SUVmax:1 分代表无残留病灶;2 分代表残留病灶摄取≤纵隔血池摄取;3 分代表纵隔血池摄取<残留病灶摄取≤肝脏摄取;4 分代表残留病灶摄取轻度>肝脏摄取;5 分代表残留病灶摄取明显>肝脏摄取(2~3 倍以上)或出现新发病灶。根据中期Deauville 五分法评分,将患者分为Deauville五分法评分1~3 分组和4~5 分组。(4)Lugano 疗效评估。根据Lugano 疗效评估标准[9],中期疗效评估结果包括:完全缓解、部分缓解、疾病稳定、疾病进展,并据此将患者分为缓解组(完全缓解+部分缓解)和未缓解组(疾病稳定或未缓解+疾病进展,含死亡患者)。
1.5 随访及观察
以北京医院管理信息系统、影像归档和通信系统或电话方式对患者进行随访,以基线PET/CT 显像日期作为随访起点,进展、复发或死亡时间作为随访终点。观察指标为无进展生存期(progression free survival,PFS)及总生存期(overall survival,OS)。PFS 是指患者从确诊至疾病复发、进展或末次随访的时间;OS 是指患者从确诊至死亡或末次随访的时间。疾病复发或进展根据随访过程中的组织病理学检查及影像检查结果判定。
1.6 统计学分析
以SPSS20.0 软件进行统计学分析。计数资料以频数和百分比表示,组间比较采用χ2检验或Fisher 精确检验。采用ROC 曲线,寻找中期SUVmax的最佳临界值。采用Kaplan-Meier 法绘制生存曲线,Log-rank 检验分析组间差异。预后单因素、多因素分析采用COX 回归分析,将单因素分析中P<0.10的指标纳入多因素分析。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料
77 例EN-DLBCL 患者中,明确组织病理学亚型者76 例(另外1 例组织病理学检查未进行亚型分类),包括生发中心来源30 例(39.5%),非生发中心来源46 例(60.5%)。IPI 评分为低危、中低危、中高危、高危的患者分别为17 例(22.1%)、12 例(15.6%)、18 例(23.4%)、30 例(39.0%)。结外病变最常累及的4 种脏器分别为脾脏(26 例,33.8%)、骨髓(24 例,31.2%)、胃(14 例,18.2%)、肠(14 例,18.2%)。初始化疗结束时,51 例(66.2%)患者达到完全缓解、4 例(5.2%)死亡,其余患者继续治疗。
患者中位随访时间为24 个月,范围为4~105个月。至随访结束时,入组患者中有19 例(24.7%)出现疾病进展、复发或死亡,包括11 例(14.3%)死亡(其中1 例为化疗后因心肌梗死死亡)。患者的一般资料见表1。

表1 77 例结外弥漫大B 细胞淋巴瘤患者的一般资料Table 1 Clinical characteristics of 77 extranodal diffuse large B-cell lymphoma patients
2.2 中期PET/CT 各指标预测EN-DLBCL 初始化疗结束时的疗效分析
ROC 曲线结果显示,中期SUVmax的最佳临界值为4.9,因此将患者分为中期SUVmax<4.9 组和中期SUVmax≥4.9 组。
中期SUVmax<4.9 组、Deauville 五分法评分1~3 分组患者初始化疗结束时的完全缓解率显著高于中期SUVmax≥4.9 组(82.6%对41.9%,χ2=13.699,P<0.001)、Deauville 五分法评分4~5 分组(85.0%对45.9%,χ2=13.108,P<0.001);而以ΔSUVmax70%、Lugano 疗效评估结果分组的各组间完全缓解率的差异均无统计学意义,详见表2。Deauville五分法评分1~3 分组的完全缓解率显著高于ΔSUVmax%≥70%组和Lugano 疗效评估缓解组,且差异均有统计学意义(χ2=4.130、4.069,P=0.042、0.044);中期SUVmax<4.9 组的完全缓解率高于ΔSUVmax%≥70%组和Lugano 疗效评估缓解组,但差异均无统计学意义(χ2=3.345、3.282,P=0.067、0.070)。
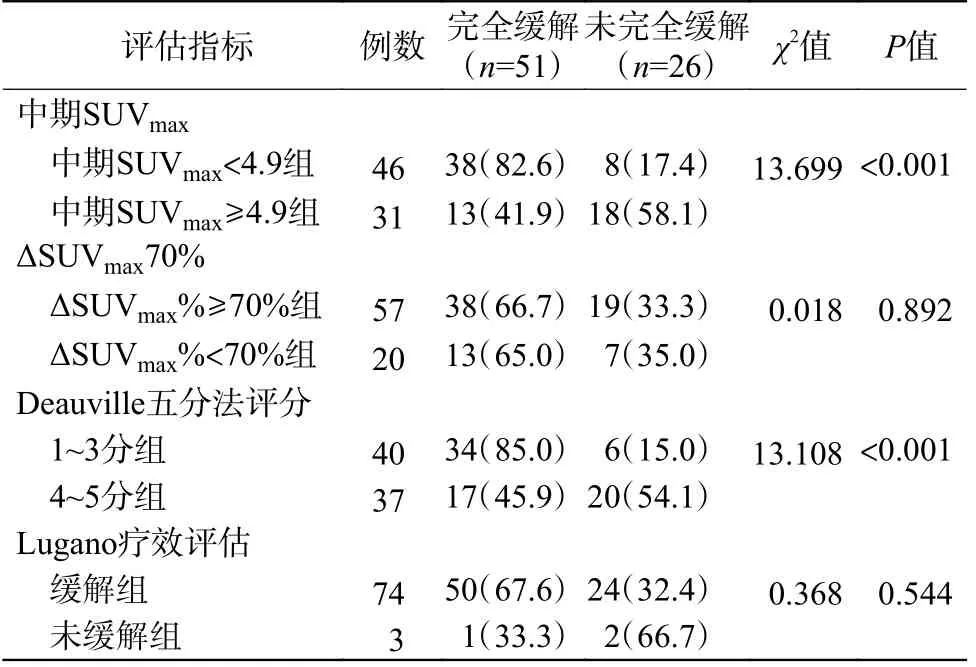
表2 中期18F-FDG PET/CT 各评估指标预测EN-DLBCL 患者初始化疗结束时疗效的结果分析[例(%)]Table 2 Results of various evaluation indicators of interm 18F-FDG PET/CT for predicting the efficacy of extranodal diffuse large B-cell lymphoma at the end of primary chemotherapy (case (%))
中期SUVmax<4.9、Deauville 五分法评分1~3分预测EN-DLBCL 初始化疗结束时疾病完全缓解的灵敏度分别为69.2%和76.9%,特异度分别为74.5%和66.7%,准确率分别为72.7%和70.1%,两指标间的差异均无统计学意义(χ2=0.759、0.391、0.127,均P>0.05)。
2.3 中期PET/CT 各评估指标预测EN-DLBCL 预后价值的结果分析
中期SUVmax<4.9 组和中期SUVmax≥4.9 组的2 年PFS 率分别为89.0%和60.6%,差异有统计学意义(χ2=6.148,P=0.013);2 年OS 率分别为92.5%和80.3%,差异无统计学意义(χ2=3.416,P=0.065)。ΔSUVmax%≥70%组和ΔSUVmax%<70%组的2 年PFS 率分别为79.5%和75.0%,差异无统计学意义(χ2=0.051,P=0.822);2 年OS 率分别为92.2%和74.4%,差异无统计学意义(χ2=3.331,P=0.068)。Deauville 五分法评分1~3 分组和4~5 分组的2 年PFS 率分别为89.9%和64.7%,差异有统计学意义(χ2=4.586,P=0.032);2 年OS 率分别为93.8%和80.8%,差异无统计学意义(χ2=3.447,P=0.063)。Lugano 疗效评估缓解组和未缓解组的2 年PFS 率分别为79.9%和33.3%,差异有统计学意义(χ2=4.765,P=0.029);2 年OS 率分别为89.7%和33.3%,差异有统计学意义(χ2=7.248,P=0.007)。中期18F-FDG PET/CT 各评估指标预测EN-DLBCL 的PFS 的Kaplan-Meier 生存曲线见图1。

图1 中期18F-FDG PET/CT 各评估指标预测77 例EN-DLBCL 患者PFS 的Kaplan-Meier 生存曲线 FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术;EN-DLBCL 为结外弥漫大B 细胞淋巴瘤;PFS 为无进展生存期;SUVmax 为最大标准化摄取值;ΔSUVmax 为基线PET 与中期PET 的SUVmax 差值;ΔSUVmax=[(基线SUVmax−中期SUVmax)/基线SUVmax]×100%Figure 1 Kaplan-Meier plots of progression free survival in 77 patients with extranodal diffuse large B-cell lymphoma using assessment indicators of interim 18F-FDG PET/CT
EN-DLBCL 患者PFS 和OS 的单因素COX 回归分析结果见表3。将表3 中P<0.10 的评估指标纳入多因素COX 回归分析,结果显示Lugano 疗效评估、IPI 评分是影响EN-DLBCL 患者PFS 和OS 的独立预测指标,详见表4。

表3 影响EN-DLBCL 患者PFS 和OS 的单因素COX 回归分析结果Table 3 Univariate COX analysis results of progression free survival and overall survival of patients with extranodal diffuse large B-cell lymphoma
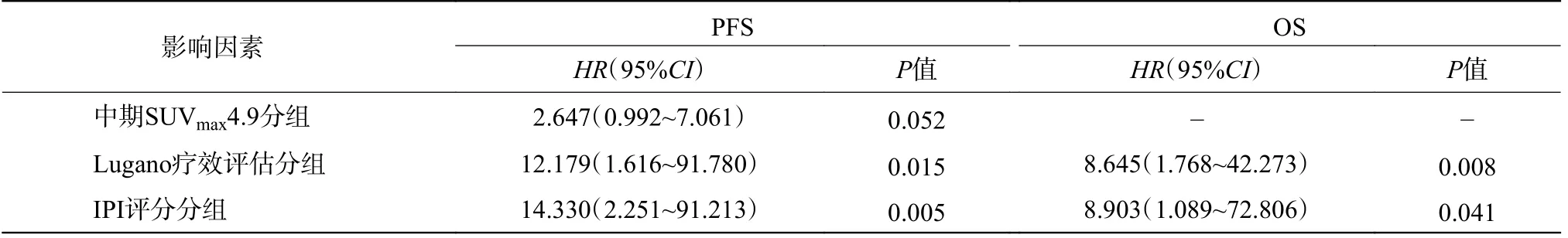
表4 影响EN-DLBCL 患者PFS 和OS 的多因素COX 回归分析结果Table 4 Multivariate COX analysis results of progression free survival and overall survival of patients with extranodal diffuse large B-cell lymphoma
3 讨论
基于中期PET/CT 的评价指标目前有很多种,但哪种指标在DLBCL 预后评估中的价值更高仍存在争议。EN-DLBCL 较非EN-DLBCL 的疗效和预后均更差[6-7,10],且目前很少有以中期PET/CT 来专门评估EN-DLBCL 疗效和预后的研究。本研究探讨了在DLBCL 疗效和预后预测中较为广泛应用的4 种中期PET/CT 评估指标,包括SUVmax、ΔSUVmax70%、Deauville 五分法评分及Lugano 疗效评估,结果显示,经3~4 个周期利妥昔单抗联合一线方案化疗后,中期SUVmax<4.9、Deauville五分法评分1~3 分的EN-DLBCL 患者的完全缓解率更高,且4 种指标中Lugano 疗效评估结果是EN-DLBCL 患者远期预后的独立预测指标。
以中期SUVmax、Deauville 五分法评分来评估EN-DLBCL 的疗效和预后简单易行,适合临床常规使用。这2 种指标都是评估化疗中期EN-DLBCL病灶的代谢活性。一般而言,18F-FDG 摄取增高与DLBCL 的疗效和预后呈负相关,但既往有关SUVmax预测DLBCL 疗效和预后的研究均是针对所有DLBCL 患者[10-11],不是专门针对EN-DLBCL患者。本研究基于中期PET/CT 的几种评估指标预测EN-DLBCL 初始化疗疗效和预后,结果显示中期SUVmax<4.9 的患者初始化疗结束时的完全缓解率更高,与前述基于基线PET/CT 对DLBCL的研究[10-11]结果类似。基线PET/CT 的SUVmax对DLBCL 患者PFS 和OS 的预测价值尚存在争议[11-15]。本研究中多因素COX 回归分析结果提示,中期SUVmax对EN-DLBCL 患者的PFS 有一定的预测价值(P=0.052),但仍有待大样本、前瞻性研究进一步验证。
Deauville 五分法评分最早用于淋巴瘤化疗中期疗效评估,其价值已得到普遍认可,但是对于其最佳临界值的选择尚有一定的争议,既往的研究分别将Deauville 五分法评分以3、4、5 分作为最佳临界值进行过探讨[16-21]。本研究结果显示,中期Deauville 五分法评分以4 为最佳临界值,是预测EN-DLBCL 初始化疗结束时完全缓解的可靠指标,而且中期PET/CT Deauville 五分法评分评估为4~5 分的患者,其2 年PFS 率比Deauville 五分法评分1~3 分的患者更低,这与以往针对所有DLBCL患者的研究结果一致[16,19,22]。虽然本研究结果显示,中期SUVmax和Deauville 五分法评分与EN-DLBCL患者的2 年PFS 率显著相关,但最终的多因素分析结果显示,只有Lugano 疗效评估结果是影响EN-DLBCL 患者2 年PFS 率和2 年OS 率的独立预测指标。这说明预测EN-DLBCL 患者的远期预后需要动态PET/CT 进行评估。这与既往对结外淋巴瘤、DLBCL的研究结果类似[14,20,23]。分析原因可能是因为治疗后EN-DLBCL 的生长或凋亡是一个动态变化的过程,与中期SUVmax和Deauville 五分法评分相比,Lugano 疗效评估结果能够更为动态、立体地反映淋巴瘤细胞的侵袭性和代谢活性的变化,而这种动态变化与患者的预后关系更为密切。
ΔSUVmax%综合了化疗前、后淋巴瘤病灶的代谢信息,既往很多研究结果显示其对DLBCL 患者的PFS 和OS 有预测价值[16-19]。有研究者推荐ΔSUVmax%的最佳临界值应随着化疗周期的推进而提高,2 个周期化疗后其最佳临界值应为66%,4 个周期化疗后应为70%~73%[3,22,24]。但是,本研究结果没有显示ΔSUVmax70%与初始化疗结束时的疗效或远期预后显著相关,可能是因为既往研究的对象为所有DLBCL 患者,而本研究是专门针对EN-DLBCL 患者开展的。目前仅有的一项针对中期PET/CT 预测EN-DLBCL 患者中期PET 预后的研究结果[25]与本研究结果不一致,该研究结果提示ΔSUVmax65.7%是EN-DLBCL 患者预后的独立预测指标。分析原因可能与该研究只纳入了ΔSUVmax%和中期Deauville 五分法评分作为研究指标,没有将Lugano 疗效评估结果纳入预测预后的指标体系,且该研究中患者病情较本研究中患者更轻,如年龄更小(中位年龄61 岁对中位年龄67 岁)、单个结外病变比例更高(62.6%对44.2%)、Lugano 分期的Ⅰ/Ⅱ期比例比Ⅲ/Ⅳ期更高(46.0%对27.3%)等因素有关。
本研究入组患者因为高龄、病情重等原因,没有全部采用标准的利妥昔单抗、环磷酰胺、阿霉素、长春新碱、泼尼松(R-CHOP)方案进行治疗,这是本研究最大的局限性。因此,对于预后更差的EN-DLBCL 患者,中期PET/CT 的预后价值仍有必要进行大样本、多指标的前瞻性研究来进一步验证。
总之,基于中期PET/CT 的4 种评估指标中,中期SUVmax<4.9 和Deauville 五分法评分1~3 分能较好地预测EN-DLBCL 患者初始化疗结束时的疗效,而Lugano 疗效评估结果则是远期PFS 和OS 的独立预测指标。
利益冲突所有作者声明无利益冲突
作者贡献声明李旭负责研究命题的提出与设计、方法的建立、研究过程的实施、试验数据的获取与分析、论文的撰写;刘甫庚、姚稚明负责研究命题的设计、论文的审阅与修改;陈聪霞、崔燕、冯茹、颜东岳负责患者的随访、试验数据的获取与分析
