黄瓜新品种京研冬美9号的SSR纯度鉴定
2023-07-04孟淑春刘立功宋晓玉宋顺华张峰
孟淑春 刘立功 宋晓玉 宋顺华 张峰

摘 要:种子纯度鉴定是保证种子质量的关键环节。田间小区种植鉴定法,周期长、费用高,无法满足种子贸易中快速鉴定的要求,且受环境影响大,结果不够准确。DNA电泳鉴定技术为种子的纯度鉴定提供了一种更为快速、高效的方法。笔者采用72对SSR引物对黄瓜品种京研冬美9号及其亲本进行多态性筛选。结果表明,12对引物在亲本间具有多态性,并都表现出共显性,在杂交后代中表现为清晰、稳定的父母本互补的带型,特异性强,可以用来区别其中混杂的母本、父本及其他品种的种子。这12对SSR引物作为京研冬美9号及其亲本的核心引物,构成的京研冬美9号的SSR指纹图谱,为京研冬美9号杂交种的亲本提纯、纯度检测及真实性鉴定等工作提供了有效的技术支持。其中,2对引物SSR17922和SSR02118特异性强且谱带清晰,利用这2对引物对京研冬美9号黄瓜种子进行检测,鉴定结果与田间鉴定结果一致,被选为鉴定黄瓜京研冬美9号纯度的特异引物。
关键词:黄瓜;京研冬美9号;SSR;纯度鉴定
中图分类号:S642.2 文献标志码:A 文章编号:1673-2871(2023)06-023-05
SSR purity identification of cucumber variety Jingyan Dongmei No. 9
MENG Shuchun1, LIU Ligong1, SONG Xiaoyu1,2, SONG Shunhua1, ZHANG Feng1
(1. State Key Laboratory of Vegetable Biobreeding/National Engineering Research Center for Vegetables/Supervision, Inspection and Test Center of Vegetable Seed Quality of Ministry of Agriculture and Rural Affairs/Beijing Vegetable Research Center, Beijing Academy of Agriculture and Forestry Science, Beijing 100097, China; 2. Horticulture College, Anhui Agricultural University, Hefei 230036, Anhui, China)
Abstract: For increasing the efficiency of application of the variety identification and seed genetic purity on cucumber hybrid seed, ensuring the seed genetic quality, alternative 72 pairs of SSR primers have been applied in the screening the molecular markers on the cucumber Jingyan Dongmei No.9 and their parents. The results showed that 12 pairs of primers complementary to appear polymorphic bands between the parents, clear and stabilized, performing codominance, highly specificity, among hybrids, which can be used to distinct its parents and other varieties. The core SSR primers of Jingyan Dongmei No. 9 were composed mainly of these 12 pairs of primers, formed the SSR fingerprint of Jingyan Dongmei No. 9, which provided technological information for seeds purity, authenticity of hybrid and parents purifying. Among them, the bands amplified by 8 pairs of primers were highly distinguishable, the particularity was strong, as well as the characteristics of clear bands and the result agreed with field test.
Key words: Cucumber; Jingyan Dongmei No. 9; SSR; Purity identification
黃瓜(Cucumis sativus L.)别名胡瓜,是葫芦科黄瓜属黄瓜亚属中的一个种,一年生攀缘性草本植物,染色体数2n=2x=14,多为雌雄同株,少量其他性型。雄花常数朵在叶腋簇生;雌花单生或稀簇生。黄瓜果实棒状、长圆形或圆柱形,嫩果呈绿色、黄色、白色等,富含蛋白质、维生素C、尼克酸、胡萝卜素、铁、磷、钙等营养成分。黄瓜通常以嫩果供食用,蒸炒炖煮、凉拌生食或加工腌制皆可。黄瓜的热量仅67 kJ·100 g-1,是低热量的蔬菜。黄瓜含有丙醇二酸,又名羟丙二酸,在不妨碍糖类物质向人体提供热量和能量的情况下,能够抑制糖类在人体内转化为脂肪,因此,有减肥健美的功效[1]。黄瓜茎蔓可入药,能镇痉、祛痰、消炎,对降血压、降胆固醇有疗效。大约3000年前,印度开始栽培黄瓜,后经丝绸之路传入中国,到公元1500年前后,西班牙、加拿大先后有了黄瓜的种植记录,到公元1600年左右,黄瓜已经在世界各地广泛种植。在长期栽培选择和自然演化过程中,形成了丰富多样的栽培类型和黄瓜品种,现广泛种植于温带和热带及亚热带地区,成为世界主要蔬菜之一。因为黄瓜不同品种和类型的生态适应性不同,特性、特征也存在很大差异,所以各地都有适合当地气候和生态条件以及消费习惯的品种。随着人民生活水平的提高,以及在保护地生产中的高效益使黄瓜的保护地栽培迅速发展,黄瓜生长期延长,经济效益明显提高,成为中国各地周年供应的主要蔬菜之一。
随着现代农业和生物技术的快速发展,育种手段不断更新,育种水平不断提高,我国蔬菜优新品种数量急剧增加,但是品种侵权、品种套牌的现象仍然普遍存在、屡禁不止,给种子生产销售和农民增收带来巨大损失的同时,也严重损害了正规种子企业的切身利益[2-3]。品种纯度是优良品种的遗传特性得以充分体现、种子遗传质量得到保证的前提,是种子质量评价和评定种子等级的重要指标[3],对农业生产的产量和品质都有较大的影响,在种子生产、加工、贮藏及销售过程中具有重要意义和应用价值。由于在种子的制种过程中很容易出现生物学混杂、机械混杂等情况,再加上不法商贩的人为掺假,导致种子的品种纯度和真实性受到严重影响。因此,在销售使用前有必要对种子的真伪和品种纯度进行抽样检测。目前,在生产上应用最为广泛的田间小区种植鉴定方法,简单、直观、便于观察,但是由于植株的很多形态学性状表现常常受环境条件的影响,尤其是一些数量性状在不同的栽培条件下会产生很大差异,对鉴定人员的技术水平要求非常高,生产用种的纯度鉴定往往只能异地加代检测,所需周期长、时效性差、成本高[4]。近年来,生物技术实现了日新月异的快速发展,DNA分子标记在种子真伪和纯度鉴定领域取得较大的进展,其优点主要表现为:鉴定品种准确可靠、可鉴定表型难于鉴别的品种;试验周期短、成本较低、便于实现自动化;鉴定过程不受环境因素影响。目前已经在一些主要蔬菜和主要农作物上取得良好效果,其中,SSR标记技术操作步骤简便、试验结果可靠[5],广泛地应用于玉米[6]、小麦[7]、水稻[8]、棉花[9]、甘蓝[10]、大白菜[11]等多种作物上。近年来,在黄瓜品种纯度鉴定[12-15]、种质资源遗传多样性分析[16-20]、重要基因定位[21-23]等方面得到广泛应用。
京研冬美9号是北京市农林科学院蔬菜研究所黄瓜开发课题组最新育成的杂交一代黄瓜品种。其雌花节率较高、早熟,植株生长势较强,不易早衰,全生育期120 d左右。主蔓结瓜型,瓜条顺直,膨瓜速度快,瓜长35 cm左右,把短,外皮深绿,有光泽,刺瘤适中,瓤色浅绿,风味浓,肉质脆,适宜冬、春保护地种植。使用优质的黄瓜砧木嫁接育苗,可提高植株抗逆性,增加果实亮度及延长收获期。为确保商品种质量,现以京研冬美9号父本、母本以及F1为材料,利用SSR分子标记技术,筛选多态性丰富的SSR引物,进行京研冬美9号商品种子的纯度鉴定。
1 材料与方法
1.1 材料
京研冬美9号黄瓜F1杂交种及其父本、母本,均为北京市农林科学院蔬菜研究所培育品种。
1.2 DNA提取
试验于2021年10月在北京市农林科学院蔬菜研究所品种纯度分子鉴定实验室进行。从净种子中随机数取400粒种子,每100粒为1个重复,重复4次,置于纸床发芽,种苗长到2.5 cm左右,采用经过改良的CTAB法提取种苗基因组DNA[18]。
1.3 特异性条带筛选
以京研冬美9号父本、母本及其F1杂交种的种苗基因组DNA为模板,采用72对SSR引物,引物来自李海梅[24]和Huang等[25],由北京赛百盛基因技术有限公司合成。用ddH2O分别配制上游引物、下游引物浓度均为100 μmol·L-1的储存液,再进一步用超纯水稀释成10 μmol·L-1的工作液。利用PCR技术对重复序列进行扩增,PCR反应体系为:总反应体积20.0 μL,其中包括10 mmol·L-1 dNTP 0.4 μL、10×PCR buffer 2.0 μL、5 U·μL-1 Taq DNA聚合酶0.2 μL,模板DNA 2.0 μL,10 pmol·L-1正反引物各1.0 μL,ddH2O补齐至20 μL。PCR反应程序:94 ℃ 5 min;94 ℃ 15 s、55 ℃ 15 s、72 ℃ 30 s,35循环;72 ℃ 4 min,于4 ℃保存。
扩增结束后,采用2.5%高分辨率琼脂糖进行电泳,在电泳过程中,PCR产物在电场作用下得到分离。电泳后将琼脂糖凝胶置于GBOX-CHEMIXRQ智能成像分析系统中采集图像,根据PCR产物的带型差异,选择杂交种既具有父本带型又具有母本带型,即父母本互补型的引物,进一步进行个体检测。
1.4 田間小区种植
从净种子中随机数取800粒种子,直播于制种基地8家农户大棚,每户种植100粒,四周设保护行,平均行距75 cm、株距30 cm,田间管理按常规进行。
1.5 数据统计
一般情况下,品种纯度以百分率表示。将所鉴定的本品种、异品种、异作物和杂草等均以所鉴定植株的百分率表示。品种纯度结果可采用以下公式计算:
品种纯度/%=[本作物的总株数-变异株数(非典型株数)]/本作物的总株数×100。
2 结果与分析
2.1 特异性条带的筛选
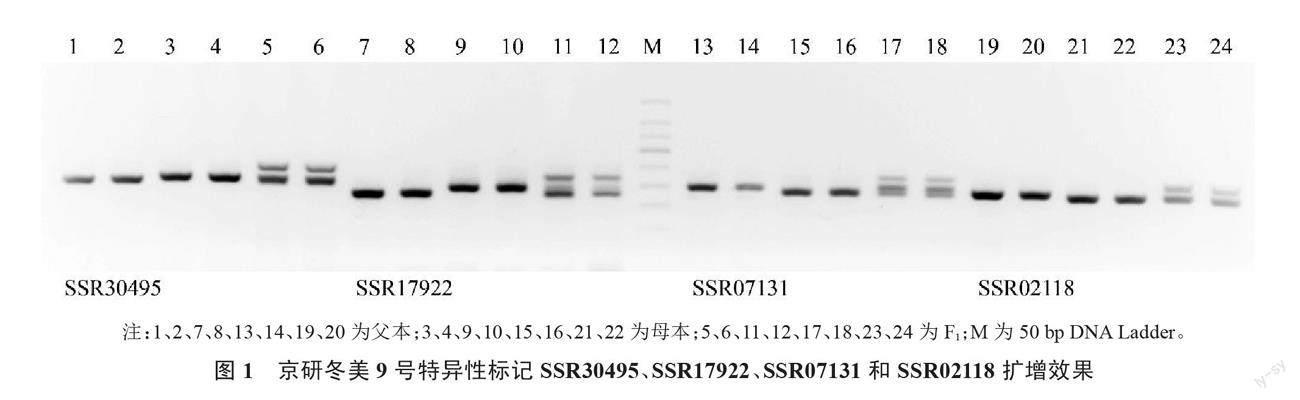
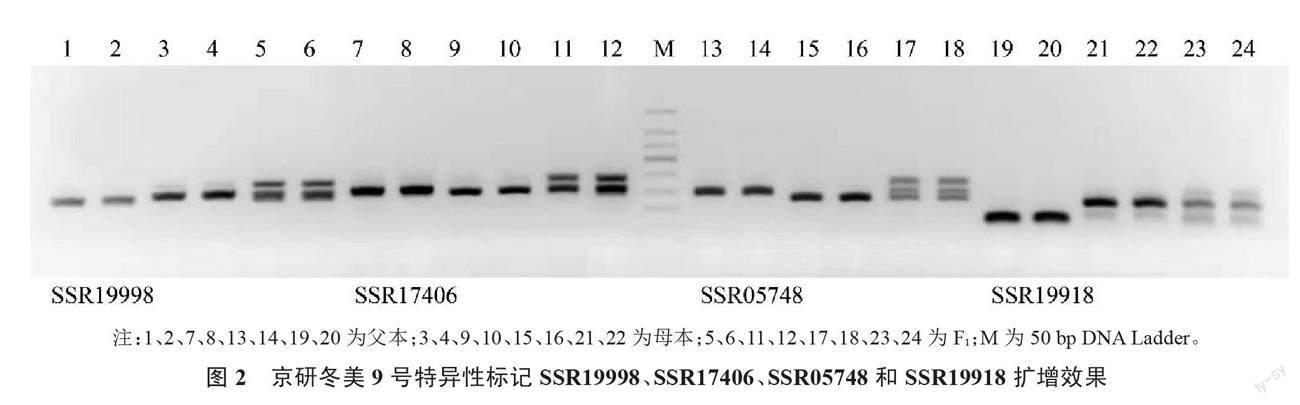
应用72对SSR引物对黄瓜新品种京研冬美9号父本、母本和F1的基因组DNA进行PCR扩增,通过对其SSR带型筛选分析,每对引物扩增的位点为1~3个,片段大小介于150~330 bp之间,大部分位点集中在180~250 bp之间。扩增产物琼脂糖凝胶电泳图像显示亲本和F1之间在12个位点上具有多态性,杂种后代兼具父本和母本的带型特征,表现出共显性分离,具有互补性,可以用来鉴定杂交种的纯度。其中,8对引物扩增的多态性片段带型清晰、片段分子质量差大于10 bp,亮度接近,便于区分,分别是SSR30495、SSR17922、SSR07131、SSR02118、SSR19998、SSR17406、SSR05748、SSR19918(表1、图1和图2)。另外4对引物SSR05723、SSR20079、SSR10348、SSR20286,虽然可以扩增出稳定的多态性片段,但是带型模糊、亮度较低,或者多态性片段的分子质量之间小于10 bp,电泳距离较短的时候难以辨识。
2.2 SSR纯度鉴定
在存在共显性分离的12对产生特异性分子标记的SSR引物当中,发现2对引物SSR17922和SSR02118特异性强且谱带清晰,被选为鉴定黄瓜京研冬美9号纯度的特异引物。利用引物SSR17922和SSR02118对来自制种基地8家农户生产的黄瓜京研冬美9号杂交种各随机选取100个单株进行SSR纯度鉴定。电泳结果显示,6家农户生产的京研冬美9号杂交种纯度为100%(图3~4),1家农户生产的杂交种纯度为99%,1家农户生产的杂交种纯度为98%,该批次种子纯度为99.6%。田间性状鉴定结果显示,3株假杂种主要农艺性状与母本性状一致,为母本自交种,田间鉴定结果与SSR分子标记检测结果一致。
3 讨论与结论
品种纯度鉴定不仅是种子销售前不可或缺的重要环节,而且在种子生产、品种登记管理、品种权保护、种质资源遗传多样性分析和亲缘关系研究中具有重要应用价值。目前,我国在黄瓜种子市场中还存在窃取亲本异地繁种、套牌上市等问题。此外,在良种生产繁育、采后加工处理、种子贮藏运输等环节由管理疏漏所导致的品种混杂、品种纯度偏低等种子质量问题也比较严重,给农户造成极大的经济损失,育种家、繁种者和种子经销商也都承受承担了巨大的经济赔偿和心理压力。每年采收的新种子在出库销售之前,都需要抽取一定量的样品进行品种纯度分子鉴定,以确保商品种子的遗传质量[26]。利用DNA分子标记技术对种子、幼苗或者植株的品种纯度和品种真实性进行分子鉴定是最为有效的方法之一。由于DNA分子标记鉴定具有多位点性、高变异性、简单而稳定的遗传性,目前已经被国际植物新品种保护联盟(UPOV,International Union for the Protection of New Varieties of Plants)纳入农作物品种DUS测试内容。DNA指纹图谱鉴定在试验方法和技术水平上一直不断的改进、完善和更新换代,也会在不远的将来发展成为中国农作物品种质量监控的重要措施之一。
笔者研究中发现的12对SSR标记在京研冬美9号父本、母本、F1的PCR扩增图谱中呈共显性,构成了京研冬美9号亲本和F1的指纹图谱。核心引物SSR30495、SSR17922、SSR07131、SSR02118、SSR19998、SSR17406、SSR05748、SSR19918扩增出的条带稳定性好、清晰度高,多态性片段分子质量差距大于10 bp,易于区分识别,SSR分子标记纯度鉴定结果与田间种植鉴定结果吻合,为京研冬美9号品种纯度、品种真实性鉴定提供了便捷、准确、高效的鉴定方法,完全可以替代田间种植鉴定以避免资源浪费、节约土地和人力物力。京研冬美9号SSR指纹图谱不仅可以为该品种的审定、保护和亲本提纯提供技术支持,还可以用于该品种种子批次的快速纯度鉴定和品种真实性检测,并为其相关形态学性状和表型特征的基因定位、遗传图谱绘制分析提供基础信息,为同类型华北耐寒型黄瓜品种纯度鉴定和真实性检测提供备选标记。自黄瓜新品种京研冬美9号育成销售开始就采用SSR分子标记技术进行室内品种纯度分子鉴定工作,同时进行田间种植纯度鉴定辅助比对验证,2020年9月至今2年间累计使用SSR技术检测京研冬美9号商品种1200 kg以上,从采种到销售的时间大大缩短,节约了资源、提高了效率。
通过比对京研冬美9號种子的室内SSR分子标记鉴定和田间种植检测分析,发现在对种子进行纯度鉴定时,田间种植与分子标记的结果吻合度高,在统计上未显示明显的差异。采用SSR分子标记技术替代田间种植纯度鉴定,不仅不受气候、温度、土壤等环境条件的限制,还能够提高品种鉴定的高效性和准确度[14],同时避免了田间鉴定环节繁琐、用时长、对环境条件要求高等缺点[3-4,6],大大提高了时效性,从而确保优良品种能够及时投放市场。SSR分布于黄瓜整个基因组的不同位置上,在每个位点上不同品种重复单位的数目及序列可能不同,因而形成片段长度多态性[27]。采用SSR分子标记技术鉴定黄瓜杂交种纯度时,揭示的是黄瓜基因组DNA序列的多态性,因此SSR引物选用的越多,鉴定结果的可靠性越高,但相应的成本也越高[4,28]。在实际制种生产中,黄瓜杂交种的混杂主要来源于制种过程中的母本自交及非父本花粉的杂交,所以黄瓜杂交种的纯度鉴定主要在于鉴别是否同时含有双亲血缘(条带),因此选用1对共显性SSR引物就可以达到鉴别杂种或者亲本的目的,从而达到节省人力物力、省时高效的目的。
参考文献
[1] 朱德巍,王德槟,李锡香.中国作物及其野生近缘植物·蔬菜作物卷·下[M].北京:中国农业出版社,2008.
[2] 张力科,金石桥.我国农作物种子质量现状与质量提升策略分析[J].中国种业,2019(3):3-6.
[3] 孟淑春,徐秀苹,宋顺华.品种纯度检测助力蔬菜种业发展[J].种子,2020,39(4):161-164.
[4] 王全,张桂华,苗伟利.应用SSR 技术进行黄瓜杂交种种子纯度鉴定[J].长江蔬菜,2009(7):43-44.
[5] YASHITOLA J,THIRUMURUGAN T,SUNDARAM R M,et al.Assessment of purity of rice hybrids using microsatellite and STS markers [J].Crop Science,2002,42(4):1369-1373.
[6] 尹祥佳,郝楠,南铭,等.SSR分子标记鉴定玉米杂交种纯度的研究及应用综述[J].甘肃农业科技,2018(11):97-102.
[7] 刘丽华,苑少华,冯树英,等.小麦F型雄性不育系和恢复系SSR指纹图谱构建及遗传差异分析[J].作物杂志,2017(6):30-36.
[8] 马琳,余显权,赵福胜.贵州地方水稻品种“禾”的 SSR 指纹图谱构建[J].西南农业学报,2010,23(1):5-10.
[9] 匡猛,杨伟华,许红霞,等.中国棉花主栽品种DNA指纹图谱 构建及SSR标记遗传多样性分析[J].中国农业科学,2011,44 (1):20-27.
[10] 王庆彪,张扬勇,庄木,等.中国50个甘蓝代表品种 ESTSSR指纹图谱的构建[J].中国农业科学,2014,47(1):111-121.
[11] 隋光磊,于拴仓,杨金雪,等.大白菜品种鉴定的SSR核心引物筛选及其应用[J].园艺学报,2014,41(10):2021-2034.
[12] 张桂华,李家旺,张文珠,等.利用SSR技术对黄瓜新品种津优35号进行种子纯度鉴定[J].北方园艺,2010(10):184-185.
[13] 崔兴华,韩毅科,杜胜利,等.黄瓜新品种‘津优401种子纯度的SSR鉴定[J].中国瓜菜,2015,28(3):38-39.
[14] 杨宏,刘小俊,梁根云,等.黄瓜品种‘川绿2号SSR指纹图谱的构建和纯度鉴定[J].西南农业学报,2016,29(2):374-378.
[15] 孟淑春,徐秀苹,刘立功,等.京研绿翡翠黄瓜品种纯度的SSR鉴定[J].湖北农业科学,2022,61(1):98-101.
[16] HU J,WANG L,LI J.Comparison of genomic SSR and EST-SSR markers for estimating genetic diversity in cucumber [J].Biologia Plantarum,2011,55(3):577-580.
[17] PANDEY S,ANSARI W A,MISHRA V K,et al.Genetic diversity in Indian cucumber based on microsatellite and morphological markers[J].Biochemical Systematics and Ecology,2013,51:19-27.
[18] 王惠哲,邓强,张有为,等.SSR标记和苗期人工接种鉴定黄瓜抗黑星病种质资源[J].中国瓜菜,2019,32(3):13-17.
[19] 王蕾,王福全,尹惠萍,等.基于SSR标记的黄瓜栽培品种遗传多样性分析及指纹图谱构建[J].分子植物育种,2021,19(8):2668-2677.
[20] 苗晗,张圣平,顾兴芳,等.中国黄瓜主栽品种SSR遗传多样性分析及指纹图谱构建[J].植物遗传资源学报,2014,15(2):333-341.
[21] ZHANG W W,PAN J S,HE H L,et al.Construction of a high density integrated genetic map for cucumber(Cucumis sativus L.)[J].Theoretical and Applied Genetics,2012,124(2):249-259.
[22] LI Y H,YANG L M,DAWEI M,et al.Fine genetic mapping of cp:A recessive gene for compact(dwarf)plant architecture in cucumber,Cucumis sativus L.[J].Theoretical and Applied Genetics,2011,123(6):973-983.
[23] ZHANG S P,MIAO H,YANG Y H,et al.A major quantitative trait locus conferring resistance to fusarium wilt was detected in cucumber by using recombinant inbred lines[J].Molecular Breeding,2014,34(4):1805-1815.
[24] 李海梅.黄瓜线粒体SSR分子标记的开发及应用[D].南京:南京农业大学,2015.
[25] HUANG S W,LI R Q,ZHANG Z H,et al.The genome of the cucumber,Cucumis sativus L.[J].Nature Genetic,2009,41(12):1275-1281.
[26] 魏明麗.浅谈种子纯度的检验方法[J].种子世界,2011(9):22.
[27] 陈越.晋中市蔬菜作物种子质量分析研究[D].太原:山西农业大学,2017.
[28] 王娇.“陕油803”油菜种子纯度鉴定及一个芥菜型油菜黄化基因的分子标记[D].陕西杨凌:西北农林科技大学,2014.
