高粱窄叶突变体nal1表型鉴定及转录组分析
2023-07-03张世睿陆晓春高梽鑫李金红
刚 爽,张世睿,,陆晓春,高梽鑫,,李金红
(1.沈阳大学生命科学与工程学院,沈阳 110044;2.辽宁省农业科学院高粱研究所 沈阳 110161)
叶片是高粱[Sorghum bicolor(L.)Moench]进行光合作用的主要器官,叶片略窄、厚、直并且微卷是植物理想株型育种的基本要求[1]。由此可见,窄叶作为叶形的一个重要特征,可用于高粱株型的形态改良。适宜的叶面积指数是构成高产的基础,国际水稻所在乳熟期对IR8研究发现,80%籽粒同化物的供应源是水稻的倒三叶[2]。张林青等[3]研究发现,拔节后,茎生叶的生长速度和叶片大小直接影响叶面积指数。群体内单个植株大小的比例也会影响群体叶面积的大小和生产力,而水稻的倒三叶的性状、大小和叶夹角均会对单个植株叶面积指数产生影响,进而影响群体的叶面积指数和光合产物。陈宗祥等[4]研究发现,植株上部叶片过宽、过长会造成叶片披垂,遮蔽下部叶片,造成结实率下降、进而影响产量。因此高粱叶片适度变窄、可以增加群体的通透性、提高光合效率、进而提高群体产量或品质[5]。
目前水稻、玉米等农作物通过辐射、EMS 诱变和T-DNA 插入突变等多种方式,已经获得大量窄叶突变体。到目前为止,在水稻中,研究人员通过图位克隆的方法已经定位和克隆到41个窄叶突变基因,在这些已知的突变基因中除Dnal1为显性基因外,其他均为隐性基因,其中nal1、nal2、nal7、nal9基因已经被成功克隆[6-8]。nal1突变体叶片明显变窄、进一步分析表明该突变基因编码未知功能蛋白,该基因突变后使生长素极性运输能力下降,从而影响叶片的横向生长[9-12]。nal2、nal3双突变体出现横向生长减弱、叶脉数量变少等特性,进而出现窄叶表型;过表达nal3植株出现叶片变宽变短且矮化的表型。nal12精细定位在第10号染色体上,通过对剑叶和倒四叶的显微和石蜡切片观察发现,突变体叶片的大脉数和小脉数明显低于野生型[13]。
此外还有一些与窄叶相关的基因,如srl2、avb、nrl1、nrl2、naal1和chr729被定位和克隆,srl2是一个窄卷叶相关性状基因,其在远轴面叶片发育的调控通路上发挥重要作用,研究人员发现在srl2突变体中与叶片发育相关的yabby基因转录活性被显著改变;avb突变体叶片单个维管束的面积增加,但维管束数量减少,出现窄叶的表型AVB 受生长素的诱导,参与维持细胞的分裂,是陆生植物特有的保守蛋白[14-19]。在玉米窄叶的相关研究中,HUNTER 等[20-24]发现玉米窄叶csld1突变体中,CslD1基因(Cellulose Synthase-Like D1)的突变导致突变体叶片细胞个数减少,细胞宽度增加,但叶片宽度与野生型叶片相比依旧降低。
本研究利用甲基磺酸乙酯(EMS)诱变高粱品种BTX623获得一个高粱窄叶突变体nal1(narrow leaf1),通过对高粱BTX623和突变体nal1植株开花期的剑叶进行功能注释、富集分析和关键基因挖掘,以期为高粱叶片变窄的分子机制的研究和理想株型的培育提供理论依据。
1 材料与方法
1.1 材料
高粱窄叶突变体nal1是由高粱自交系品种BTX623经0.1%EMS化学诱变而来[25],M1代单株留种,M2株系中发现一株叶片变窄的突变体nal1,突变体nal1经3年连续自交后,其窄叶性状得到了稳定遗传。开花期选取剑叶进行转录组分析。
1.2 方法
1.2.1 高粱窄叶突变体nal1形态学调查 高粱窄叶突变体nal1和野生型BTX623 于2021 年5 月播种于辽宁省农业科学院试验田。随机区组,3 次重复,分别在2 叶1 心、6 叶1 心、开花期和成熟期对突变体nal1 和野生型BTX623选取生长一致、健康无病虫害的植株对其叶片长、叶片宽和株高等性状进行调查,10次重复。
1.2.2 RNA提取和cDNA文库的构建、测序 开花期分别选取高粱窄叶突变体nal1和野生型BTX623 剑叶进行混合取样,并迅速置于液氮罐中,作为转录组测序的样品。Trozol(invitron)法提取总RNA,紫外可见光分光光度计(Thermo NDC2000)检测RNA 纯度和浓度。检测合格RNA 通过Oligo(dT)磁珠富集带有PolyA 尾的mRNA,加入Fragmentation buffer 将mRNA 达成短片段,以短片段的RNA 为模板,随机引物合成第一链c DNA,dNTPs(dUTP、dATP、dGTP 和dCTP)和DNA polymerase I 合成二链cDNA,纯化双链cDNA 后进行末端修复,加A、连接测序接头、PCR富集获得cDNA文库[26]。
每个样品设3 次生物学重复,野生型BTX623 的3 个样品文库命名BTX623-1、BTX623-2 和BTX623-3,窄叶突变体nal1的3个文库命名为nal1-1、nal1-2和nal1-3。在完成文库构建后,进行文库质量检测,cDNA 经质量检测合格后,不同文库按照目标下机数量进行池化,通过Illumina HiSeq平台进行测序。
1.2.3 测序数据与参考基因组序列比对 将Illumina HiSeq 测序平台测序得到的原始数据通过质量控制、过滤筛选后得到Clean Reads,利用HISAT2 短序列比对工具将Clean Reads 与Phytozome 的参考基因组序列进行比对,获取测序片段在参考基因组上的位置信息,以及单个测序样品序列的特征信息。
1.2.4 基因表达定量及差异基因筛选 根据比对结果和基因在参考基因组上的位置信息,统计每个基因的reads 数量,通过对样品中的Mapped Reads 的数目和转录本长度进行归一化,采用FPKM(Fragments Per Kilobase of transcript per Million fragments mapped)[27]作为衡量转录本或基因表达水平的指标;皮尔逊相关系数r(Pearson′s Correlation Coefficient)[28]可以评估生物学重复相关性;使用DESeq2对两个样本进行显著性分析;得到错误发现率(false discovery rate,FDR),差异表达基因的FDR 值必须满足|log2Fold Change| >=1,且FDR <0.05[29]。
2 结果与分析
2.1 表型鉴定
高粱窄叶突变体nal1是由高粱保持系BTX623 种子经0.1% EMS 诱变获得的,经沈阳和海南连续多代自交,获得的纯合突变体。与野生型BTX623 植株相比,2 叶1 心时,突变体植株从第2 片叶开始变窄,但突变体nal1植株株高和株型与野生型BTX623 植株相比未发生明显变化(图1A、图1B);当6 叶1 心时,与野生型BTX623 相比,窄叶突变体nal1株高未发生明显变化,但叶片长度变小、叶片宽度均变窄,且叶片夹角变小(图1C)。开花期与野生型BTX623 植株旗叶相比:突变体nal1 植株旗叶变短、变窄(图1D)。成熟期突变体nal1 的穗部明显小于野生型植株的穗部;且突变体nal1穗部较野生型植株的穗部更松散(图1E)。成熟期株高差异不显著(图1F、图1G),但成熟期突变体和野生型植株的叶长与叶宽总体上均呈现先增加后降低的趋势且各节位叶片长和叶片宽差异均显著(图1H、图1I)。

图1 野生型BTX623植株(BTX623)和窄叶突变体nal1植株(nal1)的形态表现,及相关农艺学性状统计图Figure 1 Morphological performance of wild-type BTX623 plants (BTX623) and narrow-leaved mutant plants (nal1)
2.2 转录组数据的对比和分析
本研究对高粱窄叶突变体nal1和野生型BTX623 两份样品共建立6 个cDNA 文库。经过质量控制和过滤筛选后的原始数据共获得3.18G 的clean reads,每个样品clean reads 均达到其原始数据reads 数96%以上,所获得高质量的reads 的碱基总数达48.07Gb,Q30 碱基百分比均在94%以上;分别将各样品的clean reads 与参考基因组序列进行比对,各样品的clean reads 与参考基因组的比对效率均在96.4%以上,其中唯一比对上参考基因组reads数占clean reads 94.2%以上。
皮尔逊相关系数可以评估生物学重复相关性,要求生物学重复样品间R2至少大于0.8。本研究6个样品两两之间比较R2值均达到0.8 以上;其中样品nal1-2 与nal1-3 的相关性最高,R2值达到0.98;样品nal1-1 与BTX623-1及nal1-2与BTX623-3之间R2值在15个比较组中最低为0.87。综上所述,此次研究转录组测序质量及样品相关性较好(图2)。
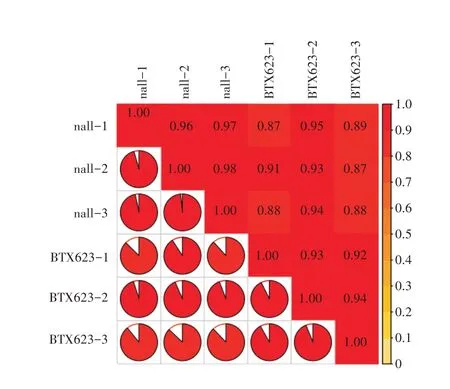
图2 皮尔逊相关系数统计图Figure 2 Pearson correlation coefficient statistical chart
2.3 差异表达基因统计筛选、功能注释和富集分析
2.3.1 差异表达基因统计筛选 对野生型BTX623及窄叶突变体nal1开花期叶片之间进行差异基因筛选。共筛选到1520个差异表达基因,上调、下调表达基因数分别为767个和753个(图3)。

图3 差异表达基因统计图Figure 3 Statistical map of differentially expressed genes
2.3.2 差异表达基因KEGG注释及富集分析 对nal1和BTX623比较组的1520个差异表达基因的KEGG pathway 进行注释及富集分析,结果表明,1520 个差异表达基因中545 个基因得到注释,注释基因富集到124 个KEGG通路中。其中,差异表达基因富集较为集中的途径共有11个,主要包括代谢途径(metabolic pathways)、次级代谢物的生物合成(biosynthesis of secondary metabolites)、类黄酮生物合成(flavonoid biosynthesis)、植物激素信号转导(plant hormone signal transduction)等。注释到代谢途径上的基因数共有263个,占有注释的差异基因表达总数的48.26%,注释到次级代谢物的生物合成通路上的基因共有174 个占有注释的差异基因表达总数的31.93%,注释到植物激素信号转导通路上的基因数共有55个,占有注释的差异基因表达总数的10.09%(图4)。将得到注释的545个差异表达基因进行KEGG pathway富集分析,差异基因显著富集到光合作用天线蛋白(photosynthesis-antenna proteins)、次级代谢物生物合成(biosynthesis of secondary metabolites)2 条通路中(p<0.05),其中次生代谢物的生物合成富集程度较低,但其富集到的差异基因个数较多,可能是由于富集到通路上的差异表达基因基数较大(图5)。

图4 KEGG通路注释结果Figure 4 KEGG pathway annotation results

图5 KEGG富集气泡图Figure 5 KEGG enrichment bubble diagram
2.3.3 差异表达基因GO分类及富集分析 为了解窄叶突变体nal1和野生型BTX623 开花期剑叶差异基因的分布特征,将1520个差异表达基因进行GO功能注释和富集分析,确定其重要的生物学功能,结果表明:获得注释的基因主要在53个GO 项中;细胞组成(cellular components)、分子功能(molecular function)和生物学过程(biological processes)三类注释分别占比为51%、30%和19%(图6)。通过GO-Term 显著性富集分析,找出在差异表达基因中显著性富集的GO项。其中在细胞组分中,差异表达基因主要富集在叶绿体类囊体(chloroplast thylakoid)、质体类囊体(plastid thylakoid)、类囊体(thylakoid)以及光合作用(photosynthesis)相关膜结构上;分子功能中差异基因显著性富集在铁离子结合(iron ion binding)、单加氧酶活性(monooxygenase activity)和信号传导受体活性(signaling receptor activity);生物学过程中差异表达基因显著性富集在光合作用(photosynthesis)、碳水化合物生物合成过程(carbohydrate biosynthetic process)、前体代谢物和能量的产生(generation of precursor metabolites and energy)3个GO条目(图7)。

图6 GO差异基因GO二级条目分类图Figure 6 Classification chart for GO differential genes GO secondary entries

图7 差异基因GO富集柱形图Figure 7 Bar chart of differential gene GO enrichment
2.3.4 差异表达基因KOG分类及富集分析 由图8可知,差异表达基因主要集中在翻译后修饰,蛋白质周转,伴侣(Posttranslational modification,protein turnover,chaperones)、信号转导机制(Signal transduction mechanisms)、次级代谢物生物合成、运输和分解代谢(Secondary metabolites biosynthesis,transport and catabolism)、碳水化合物运输和代谢(Carbohydrate transport and metabolism)、转录(Transcription)、氨基酸运输和代谢(Amino acid transport and metabolism)。

图8 KOG分类注释结果Figure 8 KOG classification annotation results
2.4 关键功能基因的挖掘分析
在对突变体进行表型鉴定时发现与野生型BTX623植株相比,同时期、同节位窄叶突变体nal1植株的叶片变窄变短,激素在植物发育过程中通过影响细胞分裂生长和细胞伸长生长来调控叶片发育。结合转录组分析,野生型植株BTX623和窄叶突变体nal1的1520个差异表达基因中,共筛选到与生长素信号传导相关的差异表达基因13个、与玉米素信号转导相关的差异表达基因4个,与玉米素合成相关的差异表达基因7个(表1)。

表1 与生长素、玉米素相关差异表达基因功能注释Table 1 Functional Notes of differentially expressed genes related to auxin,zeatin
2.4.1 与生长素、玉米素信号转导相关基因挖掘 对于生长素信号转导的研究,目前已经发现3条生长素信号转导通路分别是:AUX/IAA-TIR1 核信号通路,细胞表面起始信号通路和SKP2A 介导的信号通路[30]。本研究SAUR、GH3 和Aux/IAA 家族参与AUX/IAA-TIR1 信号通路的生长素的转录调控机制,引起的相关基因转录水平的变化(图9A、表1)。

图9 KEGG通路图Figure 9 KEGG pathway diagram
Aux/IAA为生长素诱导基因与生长素响应因子(auxin response factor,ARF)形成二聚体,抑制ARF的转录调节功能。编码Aux/IAA 家族蛋白的基因4 个均为上调,分别为Sobic.010G052700、Sobic.003G137200、Sobic.004G336500 和Sobic.008G156900 基因,这些基因的上调表达直接影响到泛素介导性蛋白酶解过程;编码ARF 的基因表达量发生改变,其中在生长素信号转导通路中基因Sobic.008G169400 呈现上调表达,而基因Sobic004G051900为下调表达。
SAUR(Small auxin-up RNA)是生长素早期响应基因,主要参与调节生长素的合成与运输,从而影响细胞的膨大[31]。过量表达拟南芥中的AtSAUR19,导致转基因植株的叶面积增大和下胚轴伸长[32]。本研究中,编码SAUR 家族蛋 白的7个基因中除基因Sobic.010G224600 外,Sobic.010G224600、Sobic.010G252500、Sobic.002G284600、Sobic.004G302200、Sobic.006G161100、Sobic.006G253300、Sobic.006G253700中均为下调表达。
玉米素作为一种细胞分裂素影响细胞分裂和芽分生组织的生长,同时具有延缓叶片衰老等作用。在本研究中,有4个差异表达基因参与玉米素信号转导分别为Sobic.003G292600、Sobic.003G046800、Sobic.003G443601、Sobic.004G330900,其 中Sobic.003G292600、Sobic.003G046800 为上调表达,基因Sobic.003G443601、Sobic.004G330900则均为下调表达。Sobic.003G292600编码组氨酸含磷酸转移蛋白5(AHP5),在拟南芥原生质体系中AHP5 的过表达不影响细胞分裂素主要应答基因的表达,因此推测Sobic.003G292600 基因在高粱窄叶突变体nal1叶片中上调表达可能不会影响玉米素信号传导整个过程。在细胞分裂素信号转导二元组分体系中,应答调节子(response regulator,RR)分为两类:type-A ARR、type-B ARR,两类应答调节子均参与信号传递,在本研究中,参与编码type-B ARRs的3个基因Sobic.003G046800、Sobic.003G443601、Sobic.004G330900分别编码转录因子NIGTH1、转录因子PCL1 和双组分响应调节器ARR10,此3 个基因的差异表达,可能会影响玉米素信号转导过程。
2.4.2 与玉米素生物合成相关基因挖掘 植物激素信号转导途径影响植物叶片发育,同样植物激素的生物合成也会影响植物叶片发育过程:在进行KEGG通路注释和富集分析中,差异表达基因在玉米素的生物合成上富集较为显著。本研究在玉米素生物合成通路中筛选得到7 个差异表达基因(图9B、表1),其中Sobic.010G277700 参与编码tRNA 二甲基烯丙基转移酶,Sobic.010G238400、Sobic.006G174300 参与编码顺式玉米素O-葡萄糖基转移酶,上述3个基因作为重要转移酶参与顺式玉米素-O-葡糖苷和UDP的合成途径,且在高粱窄叶突变体nal1 叶片中下调表达,因此推测对顺式玉米素的合成有着直接的影响。而Sobic.003G088450、Sobic.003G047800、Sobic.004G087100 这3 个基因则参与编码UDP-葡萄糖基转移酶,其中Sobic.003G088450 为上调表达,Sobic.003G047800、Sobic.004G087100 为下调表达,该过程最终产物为UDP 和二氢玉米素-O-葡糖苷。在玉米素生物合成过程中Sobic.007G151400 基因参与编码细胞分裂素脱氢酶,细胞分裂素脱氢酶(CKX)参与细胞分裂素的氧化裂解,能够起到调控细胞分裂素稳态的作用,Sobic.007G151400基因在窄叶突变体中的上调表达,影响细胞分裂素脱氢酶的生物合成,直接能影响到细胞分裂素的稳定性。
3 讨论与结论
转录组是针对细胞内特性发育时期或者生理条件的一整套转录本,转录组测序是通过高通量测序技术全面快速的获得某一特性样本中总cDNA 的序列信息。通过转录组测序得到的信息,不仅可以挖掘到功能基因组的要素,还可以揭示细胞或组织内分子成分和生物学过程,进而阐明植物的发育机理。因此转录组测序已经成为研究基因表达的重要手段之一[33]。杜萌颖等[34]通过对小豆高秆野生型材料GM437 和矮秆窄叶突变体nld的根、茎、叶进行转录组分析表明:差异表达基因主要集中于植物激素信号转导和苯丙烷生物合成这两个通路,外源喷施赤霉素可部分恢复矮秆窄叶突变体的生长。
HAN 等[35]利用转录组技术对玉米矮化窄叶突变体dnl2与野生型节间组织进行分析表明,差异表达的基因主要富集在植物激素生物合成、信号转导和细胞壁生物合成等途径中,其中超过100 个差异表达基因与IAA、GA、ABA、ETH、BR 等植物激素的合成和信号转导相关,因此推测差异表达基因通过与不同激素相互作用影响细胞的分裂生长和伸长生长,进而表现窄叶表型。郭书磊等[36]通过RNA-seq 挖掘与玉米叶片形态有关的调控基因,明确了植物激素间的动态平衡对叶片发育具有重要作用,特别是生长素和油菜素内酯、细胞分裂素和赤霉素之间的交互作用对调控叶片形态发挥重要作用。越来越多的研究表明,生长素和细胞分裂素的稳态调控、极性运输和信号转导与叶片发育和叶片形态建成具有紧密联系[37]。
本研究对nal1突变体和BTX623野生型的剑叶进行转录组分析,发现1520个差异表达基因,进一步研究发现这些差异表达基因直接参与生长素信号转导的生长素早期应答因子Aux/IAA、ARF和SAUR 共13个,参与玉米素信号转导的基因4 个、参与玉米素的生物合成的基因7 个;其中除生长素早期应答因子Aux/IAA 表达上调表达外,其余出现时而上调表达,时而下调表达;因此,推测生长素和玉米素的动态平衡调节以及信号转导途径是影响细胞分裂和细胞伸长的关键因子。高粱窄叶突变体nal1可能通过调节生长素、玉米素的信号转导和玉米素的生物合成抑制了细胞增殖和生长,出现叶片变窄的性状,但是它们在植株体内是如何参与激素信号转导?如何影响玉米素生物合成?它们之间是相互协同还是相互拮抗?这些问题仍需要进一步的研究。
