米谷蛋白及淀粉结构变化对重组米物化性质的影响
2023-07-03王丽爽于小帅王可心肖志刚
王丽爽,于小帅,王可心,肖志刚,2
(1.沈阳农业大学食品学院,沈阳 110161;2.沈阳师范大学粮食学院,沈阳 110034)
我国是大米最大的生产国和消费国。稻米在加工过程中,经过清理、砻谷、碾米及抛光等过程形成精米,但由于高精度的加工,造成蛋白质、维生素、脂肪等营养成分的流失,并产生大量碎米,导致资源浪费[1]。为解决上述问题,自20 世纪90 年代起就有学者开展了将碎米经均质、挤压、干燥等工序制成与天然大米相似的颗粒状米制品的研究[2-3]。近年来,更是有很多以不同种类淀粉进行重组米的开发,如SUMARDIONO 等[4]利用改性木薯淀粉,洋刀豆及甘薯复合粉制备新型重组米并对其进行研究;张潜等[5]将大米淀粉与高抗性玉米淀粉结合而制备出具有独特理化性质及食用品质的重组米。然而,目前多是研究对重组米制备的参数优化及配料调整或是从单一的淀粉层面进行探讨分析。研究表明,米谷蛋白是天然大米除淀粉之外的另一主要成分,占干物质的3.6%~8%,是决定大米食用品质的重要成分[6]。此外,许多文献也报道了蛋白质对挤压制品质地的影响,如BECK 等[7]发现,由于蛋白质的加入,挤出物呈现出更致密的结构和更低的脆度;DALBHAGAT 等[8]表明,蛋白质的含量和结构与挤压产品的硬度、脆度和脆性直接相关,尤其是嫩度和内聚性。但是蛋白质对重组米理化性质的影响及作用却鲜有报道。此外,挤压机作为生化反应器,其所产生的高能环境可以瞬时促进淀粉糊化、降解和碎片化以及蛋白质二硫键变化,化学键交联或解聚[9]。在加工过程中,米谷蛋白与淀粉的层级结构和空间构象均会发生变化[10],并相互影响和作用[11-12],这表明米谷蛋白与大米淀粉均是导致大米宏观特性改变并影响其食用品质的关键因素。
因此,以消除成分差异性为出发点,还原粳米中淀粉与蛋白质比例,根据实验室前期优化挤压加工参数,利用双螺杆挤压技术对米谷蛋白重组米进行制备,并通过傅里叶红外光谱、差示扫描量热法、质构分析仪,色差分析仪流变仪、快速黏度分析仪以及低场核磁技术等对米谷蛋白重组米及天然大米的结构变化及物化特性进行对比分析,最后利用扫描电子显微镜对其微观结构进行观察,以期为蛋白质-淀粉重组米的研究提供分子水分理论基础,并为改善重组米的物化特性提供方向。
1 材料与方法
1.1 材料与试剂
天然大米(粳米),黑龙江北纯农产品开发有限公司;大米淀粉(纯度98.2%,脂肪含量0.21%,蛋白质含量0.46%,灰分0.33%)和米谷蛋白(纯度83.1%,脂肪含量4.7%,水分6.5%,灰分4.9%),江西金农生物有限公司;直链淀粉(标准品)和支链淀粉(标准品),美国Sigma 公司;浓硫酸和氢氧化钠,国药集团化学试剂有限公司。除说明外其他试剂等级均为分析纯。
1.2 仪器与设备
DS56-Ⅲ,济南赛信机械有限公司;DHG-9146A 电热鼓风干燥箱,上海惊鸿仪器设备有限公司;FW100 粉碎机,中国天津实验设备有限公司;2300全自动凯氏定氮仪,丹麦福斯公司;Nicoletteis50傅里叶变换红外光谱仪,美国Nicolet 公司;Q20 差示扫描量热(DSC)仪,美国TA 公司;Bruker D8 X 射线衍射分析(XRD)仪,德国Bruker 公司;TPA 质构仪,英国Stable Micro System 公司;CHROMA METER CR-400 色差仪,日本KONICA MINOLTA 公司;DHR-3流变仪,美国TA 公司;Super3快速黏度分析(RVA)仪,美国Newport科技公司;JNM-MU25型低场核磁共振分析仪,日本电子Datum株式会社生产;S4800扫描电镜,日本Hitachi公司。
1.3 试验方法
1.3.1 米谷蛋白重组米的制备 米谷蛋白:大米淀粉(7∶93)→混合均匀→喂料→挤压→切割成型→干燥(30 ℃干燥箱)→重组米(部分粉碎测试备用)。
1.3.2 傅里叶红外光谱分析 分别将大米淀粉、米谷蛋白、未挤压混合粉、天然大米及重组米粉末覆盖在ATR-FTIR 金属探测器表面,以16 cm-1的分辨率进行64次扫描,并记录400~4 000 cm-1范围内的谱图[13],并利用Peakfit v 4.12软件对蛋白质的二级结构进行拟合计算。
1.3.3 热力学特性测定方法 分别准确称取5 mg的天然大米粉末以及重组米粉末,并于DSC专用坩埚中配置成相对湿度75%的混合物,利用压片机对坩埚密封。样品测定步骤:升温速率为10 ℃·min-1,升温程序为20~120 ℃[14]。
1.3.4 质构特性的测定方法 分别按照1∶1 的比例将重组米和天然大米与饮用水置于蒸饭皿中,浸泡20 min后,对其进行蒸煮15 min。蒸煮后在样品中间层的不同部位随机选取3 粒米,对称放置在质构仪的载物台上,选择TA4/1000 探头,设定触发点负载5.00 g,测试速度2.00 mm·s-1,压缩比例50%进行测定,每个样品测定5次,并计算5组数据平均值[15]。
1.3.5 色差的测定 利用CHROMA METER CR-400色差仪对重组米以及天然大米的亮度L*、红绿值a*、黄蓝值b*进行测定,每个样品重复测定3次。
1.3.6 流变特性的测定 参考张亭亭[16]的方法对重组米以及天然大米的动态流变以及静态流变进行测定。样品测定前需进行糊化处理,将粉碎后的重组米粉以及大米粉分别与水以1:20 的比例在玻璃管中混合均匀,获得米糊状样品,再将玻璃管放置沸水浴中糊化处理15 min,注意加热过程中要不断搅拌保证样品受热均匀,随后将糊化样品冷却至室温后开始测量。测量时选用直径为40 mm 的平板,设置间距为0.2 mm,测试时夹具周围涂一层薄薄的硅油以防止样品水分蒸发。其中静态流变特性测定条件:静态扫描范围从0~300 s-1,再从300~0 s-1,设定温度为65 ℃。动态流变特性测定条件:动态扫描设置施加在线性区域的恒定应变为0.5%,频率范围在1~100 rad·s-1的频率范围内进行动态频率扫描。
1.3.7 水分状态和分布的测定 参考刘振彬[17]的方法采用低场核磁共振分析仪(LF-NMR)对天然大米以及重组米样品的水分状态和分布进行测定。
1.3.8 糊化特性的测定 参考王玉琦等[18]的方法稍作修改。准确称取3 g 样品粉末与25 mL 蒸馏水于干燥洁净的样品筒中,利用搅拌器上下快速搅动使试样完全分散后利用RVA 快速黏度分析仪进行测定,每个样品重复测定3次。
1.3.9 扫描电子显微镜观察 参考XIAO等[13]的方法,分别对天然大米以及重组米粉末以及横截面喷金后利用扫描电镜在3 kV条件下分别放大至1 000及50倍后对其的微观形态进行观察。
1.4 数据统计分析
所有试验至少进行3 次,结果用平均值±标准差的形式表示;采用Origin 2019 软件,Office 2019,MDI Jade 6软件处理数据和作图,并利用ANOVA统计学对数据进行方差分析(p<0.05)。
2 结果与分析
2.1 傅里叶变换红外光谱分析结果
利用傅里叶红外光谱技术分别对大米淀粉、米谷蛋白、对照混合粉、米谷蛋白重组米以及天然大米的化学键变化、蛋白质的二级结构以及淀粉的短程有序结构进行分析表征。由图1a 可知,米谷蛋白与大米淀粉以及对照混合粉在1 530 cm-1处均没有吸收峰,而挤压制备的重组米1 530 cm-1处产生新的吸收峰,这表明二者之间产生了相互作用。此外,研究表明1 047 cm-1和1 022 cm-1吸收峰处的谱带强度比值可以反映淀粉的结晶区域和非晶区域情况[19],是评估淀粉中的短程有序结构的重要方式。由图1b 可知,天然大米,混合粉与重组米在1 047 cm-1和1 022 cm-1处的比值分别为1.152 5,1.160 0 和1.119 0。这说明重组米中淀粉的有序程度减弱,从而导致糊化特性及结晶特性发生了明显的改变。最后,利用1 600~1 700 cm-1处的曲线对蛋白质的二级结构进行拟合(图1c~图1e),蛋白质的二级结构主要分为α-螺旋结构,β-折叠结构,β-转角结构,无规则卷曲结构,其中α-螺旋结构,β-折叠结构含有较多的氢键,呈现较为规则有序状态[20]。与未挤压米谷蛋白相比,重组米中米谷蛋白二级结构组成发生了明显的改变,呈现曲折叠化现象。而与天然大米中蛋白质相比,具有相似的螺旋结构与折叠结构,天然大米的α-螺旋结构与β-折叠结构分别为15.57%和40.82%,而重组米中米谷蛋白的α-螺旋结构与β-折叠结构分别为15.76%和42.77%。这说明在挤压条件下,米谷蛋白结构发生明显转变,并利于重组米形成与天然大米类似的骨架结构。

图1 傅里叶红外及热力学分析结果Figure 1 The results of FTIR and thermodynamic analysis
2.2 热力学特性分析结果
大米淀粉、未挤压混合物(大米淀粉/米谷蛋白),重组米及天然大米的DSC曲线如图1f。大米淀粉,混合粉以及天然大米在70 ℃出现明显的吸热峰,这是由于淀粉吸水糊化导致的。而重组米曲线呈现为平滑直线,吸收峰消失,这表明重组米中无定型淀粉结构的产生,蛋白质有序结构解离,热稳定性明显降低。
2.3 基本成分及性质的分析结果
由表1可知,挤压米谷蛋白重组米与天然大米的成分、质构特性以及色差均有明显的不同。挤压制备对蛋白质及淀粉的总含量几乎没有影响,但是对于支/直链淀粉比例产生了明显的影响。混合粉中的直链淀粉含量为16.37%,支链淀粉含量为65.87%,天然大米中的直链淀粉含量为13.41%,支链淀粉含量为69.92%,而重组米中直链淀粉含量为25.71%,支链淀粉含量为56.64%,这表明挤压促进了重组米中淀粉的分支化减弱,直链淀粉含量增加。而结合质构特性分析发现重组米的硬度、黏性、弹性以及咀嚼性均远低于天然大米,这表明支/直链淀粉含量对于重组米质构特性具有明显的影响。对比色差数据表明,重组米的L值及a值均低于天然大米,这代表天然大米比重组米的颜色更加明亮。
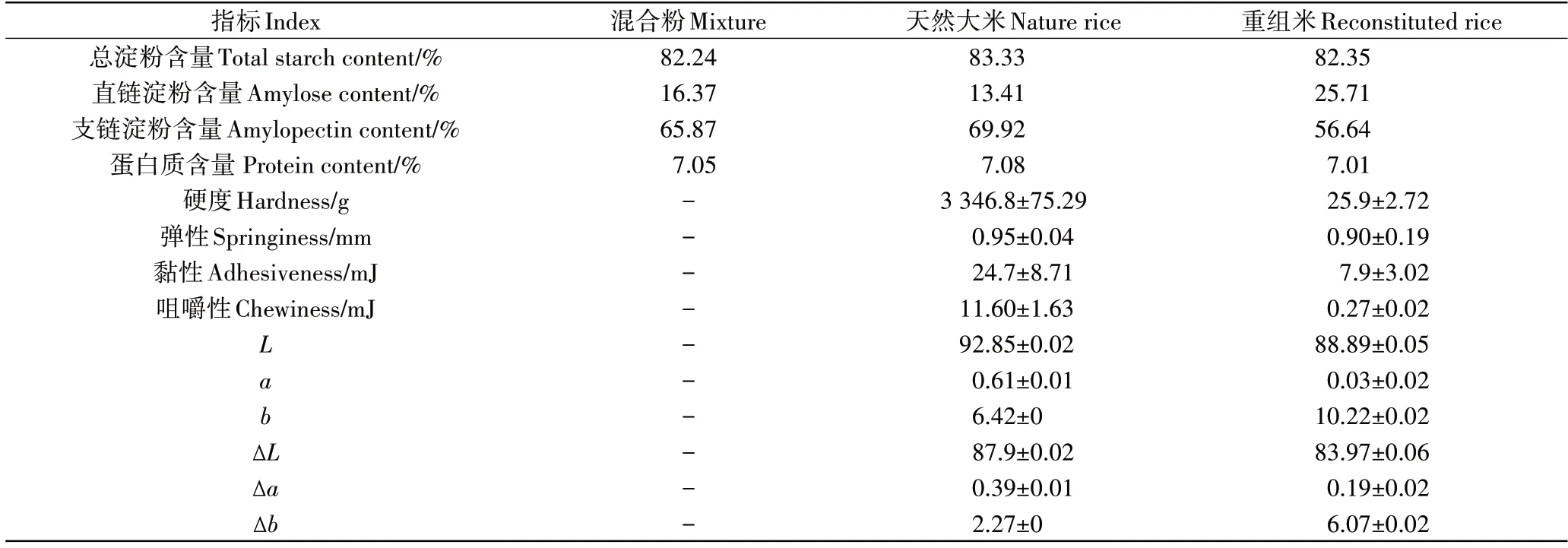
表1 天然大米以及重组米的基本成分、质构特性以及色差分析Table 1 Proximate composition,texture properties and color of natural rice and reconstituted rice
2.4 流变特性分析结果
对比天然大米与重组米的流变特性进行分析,结果可见图2a 和图2b。在剪切范围内,天然大米与重组米的剪切应力随着剪切速率的不断增大而增加,均表现出剪切稀化行为[16]。但是重组米的剪切应力明显低于天然大米。此外,天然大米的弹性模量(G′)值始终高于损失模量(G")值,并随着频率的升高而升高,这说明天然大米具有典型的弱凝胶特性,弹性特征更为明显。而重组米样品中的G′值始终低于G"并随着频率的升高而降低,这表明重组米是以黏性特征为主,与天然大米具有相反的特征。

图2 流变特性,糊化特性以及水分状态分析结果Figure 2 The results of rheological properties,the gelatinization properties and water distribution
2.5 糊化特性分析结果
重组米以及天然大米的糊化特性曲线及分析结果如图2c。重组米的各项糊化参数值均显著低于天然大米,主要原因是挤压导致了淀粉分子内无定型区域和结晶区的分子链之间的束缚力降低,糊化焓降低,从而大大降低了重组米的糊化温度[18]。峰值黏度的降低同样说明了挤压破坏了淀粉颗粒内部的氢键,导致淀粉的溶胀度和吸水能力的下降。而崩解值的降低意味着挤压降低了重组米的热稳定性和抗剪切能力,说明重组米中米谷蛋白与淀粉间的相互作用力低于天然大米中的紧密结合,这与DSC及质构特性结果相一致。
2.6 水分状态和分布分析结果
天然大米以及重组米的水分存在状态以及分布如图2d。且具体分布面积所占比例见表2。天然大米的对应峰弛豫时间分别为0.644 ms(T21,对应峰面积A21)、15.703 ms(T22,对应峰面积A22)和204.907 ms(T23,对应峰面积A23)。而重组米对应峰的弛豫时间分别为0.912 ms(T21,对应峰面积A21)、18.042 ms(T22,对应峰面积A22)和191.164 ms(T23,对应峰面积A23)。分析表明,天然大米中对应的T21 与T22 的弛豫时间低于重组米对应的弛豫时间,这代表天然大米对流动性能较差的水(结合水)的束缚能力高于重组米的能力。而重组米中A23的弛豫时间低于天然大米,这代表重组米对于捕捉流动性较强的水(自由水)的能力较强。

表2 混合粉以及重组米的NMR分析Table 2 NMR analysis of glutelin/rice starch mixture and reconstituted rice
2.7 微观形态的分析
对天然大米及重组米的横截面微观结构以及粉末颗粒形态进行观察。由图3 可知,天然大米的颗粒呈现不规则、大小不一,且分布较松散的形态,而重组米的颗粒结构呈现较为延伸状态,尺寸也相对较大,表现为不规则的棱形形状。这可能是由于挤压产生的高能高剪切作用导致淀粉与蛋白的结构被破坏,并发生相互作用[21]。而观察二者的横截面可以看出,天然大米的质地更加紧密均一,而重组米横截面表现为鱼鳞状,并产生较多孔洞,成型状态不够完整。这一方面可能是因为挤出物在离开挤压机时,由于瞬间的压力变化,导致内部水蒸气的蒸发而产生孔洞,这也利于吸水性能的提升。此外,天然大米中还存在微量的营养成分,如脂质、膳食纤维等,作为填充剂使得天然大米横截面均匀完整,而重组米仍需得到改善。

图3 天然大米以及重组米扫描电子显微镜观察结果Figure 3 Scanning electron micrographs of nature rice and reconstituted rice
3 讨论与结论
本研究模拟粳米中米谷蛋白与大米淀粉比例,利用双螺杆挤压机对米谷蛋白重组米进行制备,聚焦蛋白质与淀粉双组分体系,深入分析二者的结构变化及相互影响,并探讨其对重组米物化特性的影响。综合以上结果表明,在挤压条件下,米谷蛋白与大米淀粉结构确实会发生变化,并且相互影响及作用,从而导致重组米具有与天然大米不同的物化特性。傅里叶红外光谱研究发现,挤压重组米在1 530 cm-1处产生新的吸收峰,这表明挤压条件下,米谷蛋白与大米淀粉在C=O、C-N和N-H处发生了化学相互作用[22],也就是美拉德反应,这和现有的研究成果相一致。这也是导致重组米色差变暗的一个主要原因。而研究重组米中淀粉有序结构表明,重组米中淀粉的有序程度低于天然大米,这是由于挤压破坏了淀粉内部的双螺旋有序结构,导致支链淀粉链长降低,结晶区域减少,无定型区域增加。这不仅导致重组米理化性质的变化,还会因淀粉结构的变化提供更多结合位点,促进其与米谷蛋白间的相互作用。而研究蛋白质二级结构发现,挤压破坏了米谷蛋白原有的结构,在淀粉分子的作用下,米谷蛋白的二级结构向天然大米中蛋白质结构转变,从而产生协同效应。但是相较天然大米而言,重组米中的米谷蛋白β-折叠结构含量(42.77%)相对较多,蛋白质中β-折叠结构代表着相对延展的有序结构[23],这表明挤压过程中,蛋白质的疏水区域被破坏,蛋白质肽链延展,而淀粉促进了蛋白的疏水作用并产生聚集反应,这种聚集反应也是阻止疏水区域暴露的自然反应,这与MA 等的研究结果相一致[24]。因此,试验证明,米谷蛋白在挤压过程中结构变化明显,且与淀粉发生相互作用,是分析重组米理化性质,研究形成机制不可忽略的成分。
使用多种表征技术对重组米以及天然大米的物化特性,包括质构特性、热特性、糊化特性、流变特性、水分分布以及色差等性质进行对比分析,可以明确发现,蛋白质以及淀粉结构变化及相互作用是导致重组米与天然大米之间性质差异的深层次原因。热力学特性中重组米的吸热峰完全消失,且稳定性下降,这是由于挤压过程中淀粉晶体结构被破坏,双螺旋解构,从有序结构完全转变为无序结构,并且在挤压过程中已经发生吸水糊化反应,从而导致重组米的吸热峰消失。而这也导致了重组米蒸煮品质及质构特性产生了明显的影响。组成成分及重组米质构特性试验表明,高剪切力使得支链淀粉平均分子质量减小,α-1,6 糖苷键发生断裂,支链淀粉的分支化减弱,更多地转化成直链淀粉以及裂解成麦芽糊精等小分子物质,因此挤压后的支链淀粉含量显著减少[25],直链淀粉含量增多。而直链淀粉含量增加,表明重组米的韧性口感较差、弹性较弱、咀嚼性能差,这与实际的质构数据表现相一致。此外,相对于天然大米,重组米经过挤压处理后,淀粉分子氢键发生断裂,米谷蛋白的二硫键被破坏,肽链解聚,与淀粉分子缠绕重新排列组合,促进吸水性强物质形成,这使得在与天然大米同样蒸煮条件下的重组米,由于过度吸水及温度的作用下,硬度、黏性、弹性和咀嚼性均低于天然大米。这也是当前市面上速食米饭蒸煮时间短,加热温度低的主要原因。且重组米的颜色更加深暗,这是由于重组米中蛋白质及淀粉降解产生的小分子糖发生的美拉德反应[26],且天然大米经过抛光、碾米加工后,颜色也会变得更加明亮。流变特性是可以反映食品体系稳定性和内部结构等的重要技术手段。通过对重组米及天然大米的流变特性表征发现,重组米的剪切应力低于天然大米,表现为更明显的黏性特征,而不是弹性特征。这是由于挤压糊化处理后,挤压破坏了淀粉分子内部的微晶结构,淀粉颗粒崩解导致的。同时,米谷蛋白在挤压过程中对淀粉起到了协助分散的作用,破坏了淀粉颗粒之间与水的水合作用,从而降低重组米的流动性,并且蛋白质结构被拉伸延展,分子内部作用力减弱,淀粉与蛋白分子间的相互作用力增强,导致形成的淀粉-蛋白质聚合物黏度增加,弹性降低。以上结果分析表明,淀粉与蛋白结构均发生明显变化,这同样导致重组米的糊化特性,包括峰值黏度、崩解值等均低于天然大米。此外,添加的米谷蛋白质阻碍了直链淀粉分子链的重排,彼此间形成了新的复合物,且更多的低分子量淀粉发生扩散,不易于定向排列,这种变化促进重组米回生特性的下降,有利于重组米饭的保存及储藏。而水分存在状态以及分布试验证实了重组米在挤压过程中产生较多孔隙,增加对自由水的吸收力,这与微观结构分析结果相一致。米谷蛋白与大米淀粉间相互作用,形成新的网络结构,这使得新形成的淀粉-蛋白质聚合物吸水性增强。而扫描电镜反映淀粉与蛋白质的结合虽形成了重组米的骨架结构,但是仍然不够连续均匀,内部结构不够致密,这可能是由于一些其他营养成分及加工方式引起的,仍需加对重组米的构建进一步完善。
本研究表明,在挤压过程中,高能环境促进了大米淀粉的分支化断裂,直链淀粉含量增多,淀粉完整颗粒被破坏,从有序结构向无序结构转变,同时,米谷蛋白的疏水区域打开,肽链延展,二级结构发生转变,这些结构的变化促进了淀粉与米谷蛋白之间的紧密结合,导致紧密均匀的微观结构生成。而米谷蛋白与大米淀粉结构的改变直接导致了重组米与天然大米物化特性的不同,这说明米谷蛋白与淀粉的结构变化及互作效应对重组米的制备具有重要意义。重组米米饭的蒸煮条件及储藏亟须进一步深入研究。
