LncRNA DSCAM-AS1 调控miR-433-3p 对胃癌细胞增殖、迁移和侵袭的影响*
2023-07-03赵轶峰李明霞张超胡小敏王雄赵铁军
赵轶峰,李明霞,张超,胡小敏,王雄,赵铁军
075000 河北 张家口,河北北方学院附属第一医院 胃肠肿瘤外科(赵轶峰、胡小敏、王雄),内分泌科(李明霞),介入科(张超);075000 河北 张家口,河北北方学院 生命科学研究中心(赵铁军)
胃癌是全球最常见的恶性肿瘤之一,发病率和死亡率较高,严重威胁着人类健康和生命[1]。随着医疗技术的发展,人类在胃癌的诊断和治疗方面取得了一定的进展,然而有关胃癌发病机制目前尚不清楚。肿瘤细胞的增殖、侵袭和迁移等恶性生物学行为是癌症发生发展的主要原因之一,分析与胃癌细胞恶性生物学行为的有关机制,可能为胃癌的生长、发展机制的研究提供理论基础。长链非编码RNA(long non-coding RNA,lncRNA)含有微小RNA(microRNA,miRNA)反应原件,通过调控miRNA 的表达参与肿瘤细胞的增殖、侵袭和凋亡等多种生物学过程[2-3]。研究表明lncRNA 唐氏综合征细胞黏附分子反义1(Down syndrome cell adhesion molecule antisense 1,DSCAM-AS1)可促进前列腺癌的发展[4]。生物信息学分析预测显示,lncRNA DSCAM-AS1 与微小RNA-433-3p(microRNA-433-3p,miR-433-3p)具有靶向关系,miR-433-3p 可能是lncRNA DSCAM-AS1的靶miRNA。miRNA 是一类进化上保守的非编码小分子RNA,参与细胞的增殖、凋亡、迁移和分化等多种生理病理过程[5]。针对miR-433-3p的研究发现,miR-433-3p 与胃癌、结肠癌等消化道肿瘤的发生、发展有关[6-7]。然而,lncRNA DSCAM-AS1 是否能通过调控miR-433-3p 参与胃癌的发生和发展尚不清楚。因此,本研究旨在探讨lncRNA DSCAM-AS1 能否通过调控miR-433-3p 影响胃癌细胞增殖、迁移和侵袭,为进一步明确胃癌的发病机制提供依据。
1 材料与方法
1.1 实验材料
1.1.1 样本采集 收集河北北方学院附属第一医院胃肠肿瘤外科2019 年至2021 年手术切除后的56 例胃癌患者[22 名女性和34 名男性,年龄(53.4±7.2)岁]的胃癌组织和成对的邻近正常组织。患者在手术前未接受任何放疗、化疗或其他治疗。组织在液氮中速冻并储存在-80℃下用于进一步实验。本研究经河北北方学院附属第一医院伦理委员会批准(批准文号:20190112004)。所有患者均签署书面知情同意书。
1.1.2 细胞株 人胃癌细胞系BGC-823(批号:bio-105908)、MGC-803、AGS、SGC-7901 和人正常胃上皮细胞系GES-1 购自上海弘顺生物科技有限公司。
1.1.3 主要试剂 LncRNA DSCAM-AS1 小干扰RNA(small interfering RNA,siRNA)、lncRNA DSCAM-AS1 siRNA阴性对照、miR-433-3p、miR-433-3p 阴性对照、miR-433-3p siRNA 均由北京密码子生物科技有限公司设计合成;RPMI-1640 培养基(批号:31825)、胎牛血清(批号:39127)、胰蛋白酶(批号:60138)、实时荧光定量PCR(real-time quantitative reverse transcription PCR,qRT-PCR)试剂盒(批号:216213)均购自美国Gibco 公司;RNA 提取试剂盒(批号:9108Q)购自广州吉赛生物科技有限公司;反转录试剂盒(批号:SR205311)、CCK-8 试剂盒(批号:C13079)、结晶紫染液(批号:CP16174)、山羊抗兔二抗(批号:CN-10634)均购自德国QIAGEN 公司;双荧光素酶报告基因检测试剂盒(批号:DL1107K)、蛋白提取试剂盒(批号:DL1923K)均购自北京索莱宝科技有限公司;羊抗兔增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)(批号:S13110)、基质金属蛋白酶(matrix metalloproteinase,MMP)-2(批号:S40994)、MMP-9(批号:S13667)多克隆抗体均购自美国CST 公司。
1.2 实验方法
1.2.1 细胞培养与处理 常规复苏胃癌细胞系BGC-823、MGC-803、AGS、SGC-7901 和人正常胃上皮细胞系GES-1,加至含10%胎牛血清的RPMI-1640 培养液中,置于37℃、5% CO2培养箱中培养。隔天换液,细胞融合度达到80%左右,胰蛋白酶消化传代。
1.2.2 细胞转染及分组 构建重组质粒lncRNA DSCAMAS1 siRNA(沉默lncRNA DSCAM-AS1)、lncRNA DSCAMAS1 siRNA 阴性对照、miR-433-3p(miR-433-3p 过表达)、miR-433-3p 阴性对照、miR-433-3p siRNA(沉默miR-433-3p)。验证成功后,将lncRNA DSCAMAS1 siRNA、lncRNA DSCAM-AS1 siRNA 阴 性 对照、miR-433-3p、miR-433-3p 阴性对照和miR-433-3p siRNA 片段酶切,转入慢病毒载体pCDH-CMVMCS-EF1-copGFP,并用293T 细胞进行包装,然后收集、浓缩病毒,进一步定量。慢病毒转染前24 h,收集1.2.1 中BGC-823 细胞,调整细胞数目为1×105个/孔接种至6 孔板中,次日加入嘌呤霉素,2 h 后,分别加入制备好的病毒。实验一:探究沉默lncRNA DSCAM-AS1 对BGC-823 细胞增殖、侵袭和迁移的影响:将BGC-823 细胞分为对照组(仅添加新鲜培养基)、lncRNA DSCAM-AS1 siRNA 阴性对照组(转染lncRNA DSCAM-AS1 siRNA 阴性对照)、lncRNA DSCAM-AS1 siRNA 组(转染lncRNA DSCAM-AS1 siRNA)。实验二:探究过表达miR-433-3p 对BGC-823 细胞增殖、侵袭和迁移的影响:将BGC-823 细胞分为对照组(仅添加新鲜培养基)、miR-433-3p 阴性对照组(转染miR-433-3p阴性对照)、miR-433-3p 组(转染miR-433-3p)。实验三:验证沉默lncRNA DSCAM-AS1 对BGC-823 细胞增殖、侵袭和迁移的影响机制:将BGC-823 细胞分为lncRNA DSCAM-AS1 siRNA 组(转染lncRNA DSCAMAS1 siRNA)、lncRNA DSCAM-AS1 siRNA + miR-433-3p 阴性对照组(转染lncRNA DSCAM-AS1 siRNA和miR-433-3p 阴性对照)、lncRNA DSCAM-AS1 siRNA + miR-433-3p siRNA 组(转染lncRNA DSCAMAS1 siRNA 和miR-433-3p siRNA)。每组均设8 个平行样。培养48 h 后,更换培养基,再继续培养24 h,荧光显微镜观察,细胞呈现绿色荧光为转染成功。
1.2.3 qRT-PCR 法检测组织/BGC-823 细胞中lncRNA DSCAM-AS1、miR-433-3p 表达 RNA 提取试剂盒提取胃癌组织和邻近正常组织以及BGC-823 细胞中RNA,反转录试剂盒将RNA 反转录为cDNA,之后进行qRT-PCR 反应,反应条件为:95 ℃预变性,1 min;然后45 个循环(95 ℃变性,10 s;60 ℃退火,20 s;70℃延伸,10 s)。lncRNA DSCAM-AS1 以GAPDH 为内参基因,miR-433-3p 以U6 为内参基因,引物由北京密码子生物科技有限公司设计合成,采用2-ΔΔCt法计算BGC-823 细胞中lncRNA DSCAM-AS1、miR-433-3p的相对表达量。引物设计见表1。
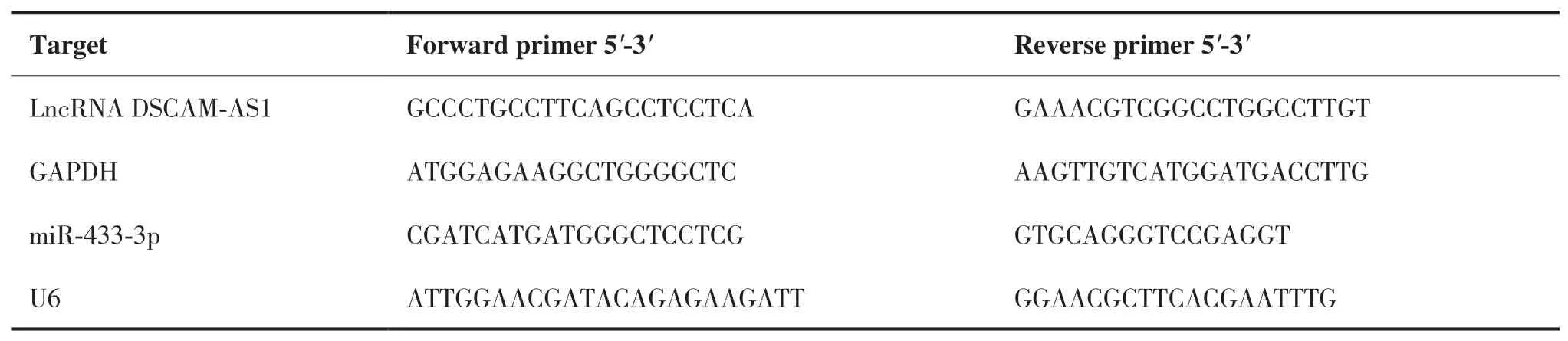
表1 引物序列Table 1.Primer Sequences
1.2.4 CCK-8 法检测BGC-823 细胞活性 收集1.2.2中各组BGC-823 细胞,调整细胞数目为1×104个/孔接种至96 孔板中,37℃、5% CO2培养箱中培养48 h,每孔加入10 μL CCK-8 试剂,37℃避光培养2 h,弃上清,酶标仪450 nm 波长处检测每孔吸光度(optical density,OD)值,计算细胞活力(%) = (实验组OD 值/对照组OD 值)×100%。
1.2.5 Transwell 法检测BGC-823 细胞侵袭和迁移 侵袭实验:收集1.2.2 中各组BGC-823 细胞,无血清培养液稀释细胞浓度至1×106个/mL,吸取100 μL加至铺有Matrigel 基质胶的Transwell 小室上室,下室加入600 μL 含胎牛血清的RPMI-1640 培养基,37 ℃,5% CO2孵育箱中培养24 h,倒掉上室培养液,棉签擦去未迁移细胞和多余的Matrigel 基质胶,无水甲醇固定,结晶紫染色,光镜下计数滤膜底面每视野的平均细胞数。迁移实验:Transwell 小室上室不铺Matrigel 基质胶,其余步骤同细胞侵袭实验。
1.2.6 双荧光素酶报告实验检测lncRNA DSCAMAS1与miR-433-3p的靶向关系 Starbase数据库(http://starbase.sysu.edu.cn/index.php)显示lncRNA DSCAMAS1 的3′UTR 含有与miR-433-3p 的结合位点(chr21:41756690-41756711),对含结合位点lncRNA DSCAMAS1 区域进行扩增,并连至pGL4 质粒,构建lncRNA DSCAM-AS1 野生型(lncRNA DSCAM-AS1-Wt)质粒;以此质粒对模板进行定点缺失突变,测序确定突变成功,构建lncRNA DSCAM-AS1 突变型(lncRNA DSCAM-AS1-Mut)质粒。
测序验证成功的重组质粒lncRNA DSCAM-AS1-Wt和lncRNA DSCAM-AS1-Mut 重组质粒,分别与miR-433-3p 阴性对照、miR-433-3p 共转染至胃癌BGC-823细胞中,分为:lncRNA DSCAM-AS1-Wt + miR-433-3p阴性对照组、lncRNA DSCAM-AS1-Wt + miR-433-3p组、lncRNA DSCAM-AS1-Mut + miR-433-3p 阴性对照组、lncRNA DSCAM-AS1-Mut + miR-433-3p 组。各组设置8 个重复。利用双荧光素酶报告基因检测试剂盒检测各组荧光素酶相对活性,严格按照试剂盒说明书进行实验操作。
1.2.7 RNA 结合蛋白免疫沉淀(RNA-binding protein immunoprecipitation, RIP)测定 使用含有RNase抑制剂的RIPA 缓冲液裂解BGC-823 细胞,将裂解物以12 000 g 离心30 min 收集上清液。将上清液与Ago2或IgG抗体包被的磁珠一起孵育过夜。然后,加入蛋白酶K 以消化蛋白质,并使用TRIzol 试剂分离免疫沉淀的RNA,通过qRT-PCR 检测免疫沉淀中lncRNA DSCAM-AS1 和miR-433-3p 水平。
1.2.8 蛋白免疫印迹法检测BGC-823 细胞中增殖、侵袭和迁移蛋白(PCNA、MMP-2、MMP-9)的表达收集1.2.2 中各组BGC-823 细胞,调整细胞浓度为5×104个/mL,每孔100 μL 加至24 孔板中,弃上清,PBS 洗涤,蛋白提取试剂盒提取细胞总蛋白并检测蛋白浓度,之后进行电泳,电泳结束后将蛋白转移封闭;分别加入一抗稀释液PCNA、MMP2、MMP9、β-actin,均为1 : 1 000 稀释,4 ℃孵育过夜,TBST 洗膜,加入山羊抗兔二抗稀释液(1 : 2 000 稀释),室温孵育1 h,TBST 洗膜。蛋白凝胶成像仪成像,Image J软件分析蛋白表达水平。
1.3 统计学方法
采用SPSS 25.0 进行数据统计分析,计量资料采用均数±标准差()描述,两组间比较采用t检验,通过Pearson 相关性分析胃癌组织中lncRNA DSCAM-AS1 和miR-433-3p 之间的相关性,多组间比较采用单因素方差分析,组间两两比较采用SNK-q 检验。以P< 0.05 为差异有统计学意义。
2 结 果
2.1 LncRNA DSCAM-AS1 和miR-433-3p 在 胃癌组织中的表达及相关性
与邻近正常组织相比,胃癌组织中lncRNA DSCAM-AS1 表达水平显著升高,而miR-433-3p 表达水平显著降低(P< 0.01;表2)。Pearson 相关性分析结果显示,胃癌患者癌组织中lncRNA DSCAMAS1 的表达水平与miR-433-3p 的水平呈负相关(r= -0.766,P< 0.01;图1)。此外,与人正常胃上皮细胞系GES-1 相比,胃癌细胞系(BGC-823、MGC-803、AGS、SGC-7901)中lncRNA DSCAM-AS1 表达水平显著升高,miR-433-3p 表达水平显著降低(P<0.05),其中BGC-823 细胞中lncRNA DSCAM-AS1表达水平显著高于其他胃癌细胞,miR-433-3p 水平显著低于其他胃癌细胞,故选择BGC-823 细胞进行后续实验(表3)。
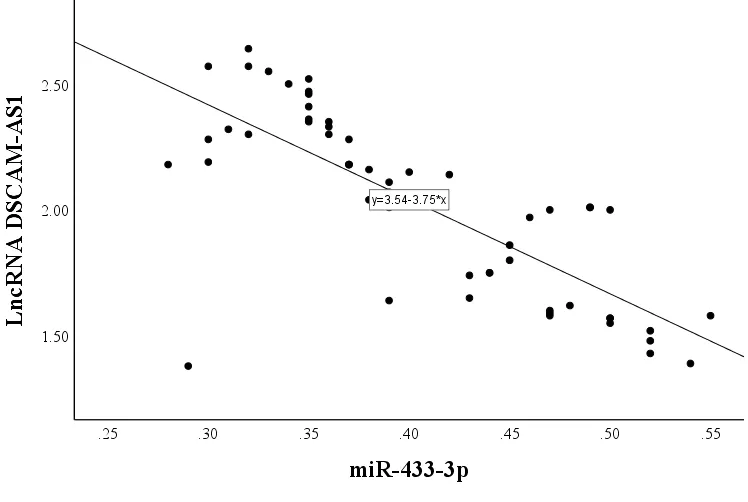
图1 胃癌组织中lncRNA DSCAM-AS1 和miR-433-3p 表达水平的相关性Figure 1.Correlation between the Expression Levels of LncRNA DSCAM-AS1 and miR-433-3p in Gastric Cancer Tissue
表2 LncRNA DSCAM-AS1 和miR-433-3p 在胃癌组织中的表达(N = 56,±s)Table 2.Expressions of LncRNA DSCAM-AS1 and miR-433-3p in Gastric Cancer Tissue(N = 56,±s)

表2 LncRNA DSCAM-AS1 和miR-433-3p 在胃癌组织中的表达(N = 56,±s)Table 2.Expressions of LncRNA DSCAM-AS1 and miR-433-3p in Gastric Cancer Tissue(N = 56,±s)
aP < 0.05,compared to adjacent normal tissue.
?
表3 LncRNA DSCAM-AS1 和miR-433-3p 在胃癌细胞中的表达(N = 8,±s)Table 3.Expressions of LncRNA DSCAM-AS1 and miR-433-3p in Gastric Cancer Cells(N = 8,±s)

表3 LncRNA DSCAM-AS1 和miR-433-3p 在胃癌细胞中的表达(N = 8,±s)Table 3.Expressions of LncRNA DSCAM-AS1 and miR-433-3p in Gastric Cancer Cells(N = 8,±s)
aP < 0.05,compared to GES-1 cells; bP < 0.05,compared to BGC-823 cells.
?
2.2 沉默lncRNA DSCAM-AS1 对BGC-823 细胞增殖、侵袭和迁移以及PCNA、MMP-2、MMP-9 蛋白表达的影响
对照组和lncRNA DSCAM-AS1 siRNA 阴性对照组相比,lncRNA DSCAM-AS1、miR-433-3p、细胞活力、细胞侵袭和迁移数目、PCNA、MMP-2、MMP-9 表达水平的差异无统计学意义(P> 0.05);与对照组和lncRNA DSCAM-AS1 siRNA 阴性对照组比较,lncRNA DSCAM-AS1 siRNA 组lncRNA DSCAM-AS1、细胞活力、细胞侵袭和迁移数目、PCNA、MMP-2、MMP-9 蛋白表达水平显著降低(P< 0.05),miR-433-3p 表达水平显著升高(P< 0.05;表4、图2、3)。
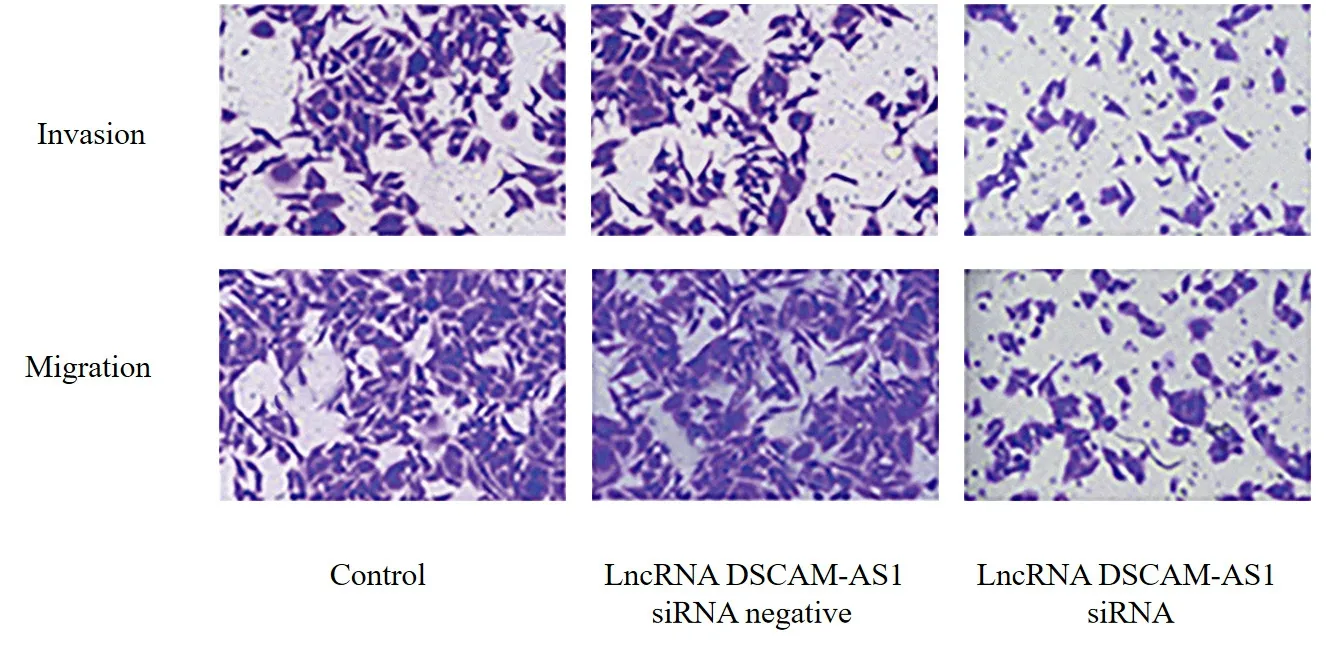
图2 对照组、lncRNA DSCAM-AS1 siRNA 阴性对照组、lncRNA DSCAM-AS1 siRNA 组BGC-823 细胞侵袭和迁移图(结晶紫染色,×200)Figure 2.Invasion and Migration of BGC-823 Cells in the Control Group, lncRNA DSCAM-AS1 siRNA Negative Control Group, and LncRNA DSCAM-AS1 siRNA Group (Crystal Violet Staining, ×200)
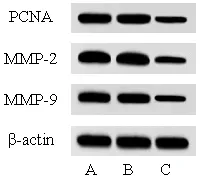
图3 对照组、lncRNA DSCAM-AS1 siRNA 阴性对照组、lncRNA DSCAM-AS1 siRNA 组BGC-823 细胞PCNA、MMP-2、MMP-9 蛋白印迹图Figure 3. Protein Blotting of PCNA, MMP-2 and MMP-9 in BGC-823 Cells in the Control Group, LncRNA DSCAM-AS1 siRNA Negative Control Group, and LncRNA DSCAM-AS1 siRNA Group
表4 沉默lncRNA DSCAM-AS1 对BGC-823 细胞增殖、侵袭和迁移以及PCNA、MMP-2、MMP-9 表达的影响(N = 8,±s)Table 4.Effects of Silencing LncRNA DSCAM-AS1 on the Proliferation, Invasion, and Migration of BGC-823 Cells, and on the Expressions of PCNA, MMP-2 and MMP-9(N = 8,±s)

表4 沉默lncRNA DSCAM-AS1 对BGC-823 细胞增殖、侵袭和迁移以及PCNA、MMP-2、MMP-9 表达的影响(N = 8,±s)Table 4.Effects of Silencing LncRNA DSCAM-AS1 on the Proliferation, Invasion, and Migration of BGC-823 Cells, and on the Expressions of PCNA, MMP-2 and MMP-9(N = 8,±s)
aP < 0.05,compared to the control group; bP < 0.05,compared to the lncRNA DSCAM-AS1 siRNA negative control group.PCNA: Proliferating cell nuclear antigen ; MMp-2:Matrix metalloproteinase-2;MMP-9 : Matrix metalloproteinase-9.
?
2.3 过表达miR-433-3p 对BGC-823 细胞增殖、侵袭和迁移以及PCNA、MMP-2、MMP-9 蛋白表达的影响
对照组和miR-433-3p 阴性对照组相比,lncRNA DSCAM-AS1、miR-433-3p、细胞活力、细胞侵袭和迁移数目、PCNA、MMP-2、MMP-9 蛋白表达水平差异无统计学意义(P> 0.05);与对照组和miR-433-3p阴性对照组比较,miR-433-3p 组lncRNA DSCAMAS1 表达水平差异无统计学意义(P> 0.05),miR-433-3p 表达水平显著升高(P< 0.05),细胞活力、细胞侵袭和迁移数目、PCNA、MMP-2、MMP-9 表达水平显著降低(P< 0.05;表5、图4、5)。

图4 对照组、miR-433-3p 阴性对照组、miR-433-3p 组BGC-823 细胞侵袭和迁移图(结晶紫染色,×200)Figure 4.Invasion and Migration of BGC-823 Cells in the Control group, miR-433-3p Negative Control Group, and miR-433-3p Group (Crystal Violet Staining, ×200)

图5 对照组、miR-433-3p 阴性对照组、miR-433-3p 组BGC-823 细胞PCNA、MMP-2、MMP-9 蛋白印迹图Figure 5.Protein Blotting of PCNA, MMP-2 and MMP-9 in BGC-823 Cells in the Control Group, miR-433-3p Negative Control Group, and miR-433-3p Group
表5 过表达miR-433-3p 对BGC-823 细胞增殖、侵袭和迁移以及PCNA、MMP-2、MMP-9 表达的影响(N = 8,±s)Table 5.Effects of Overexpression of miR-433-3p on the Proliferation, Invasion and Migration of BGC-823 Cells, and on the Expressions of PCNA, MMP-2 and MMP-9(N = 8,±s)
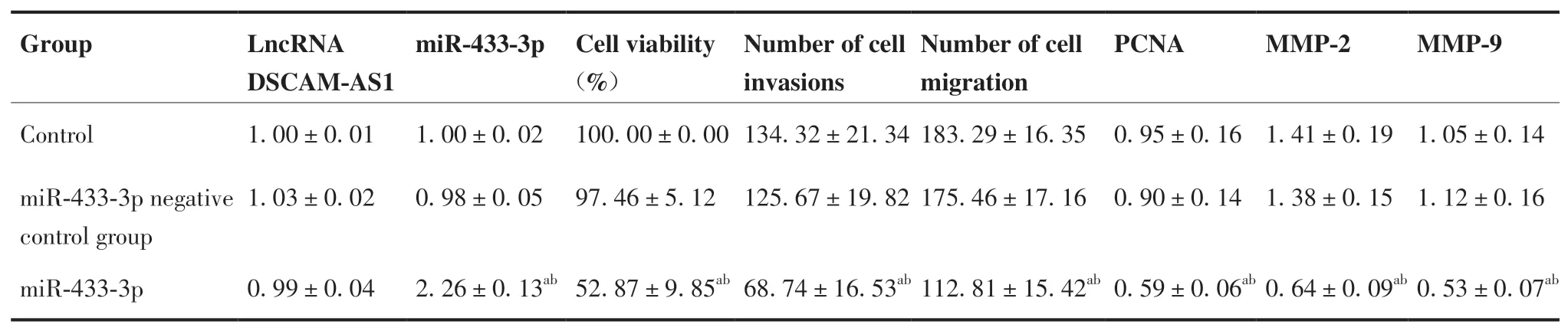
表5 过表达miR-433-3p 对BGC-823 细胞增殖、侵袭和迁移以及PCNA、MMP-2、MMP-9 表达的影响(N = 8,±s)Table 5.Effects of Overexpression of miR-433-3p on the Proliferation, Invasion and Migration of BGC-823 Cells, and on the Expressions of PCNA, MMP-2 and MMP-9(N = 8,±s)
aP < 0.05,compared to the control group; bP < 0.05, compared to the miR-433-3p negative control group.Abbreviations as indicated in Table 4.
?
2.4 LncRNA DSCAM-AS1 靶向调控miR-433-3p基因的关系验证
Starbase 数据库(http://starbase.sysu.edu.cn/index.php)预测结果表明,lncRNA DSCAM-AS1 基因3'UTR 区有miR-433-3p 的结合位点,位于lncRNA DSCAM-AS1(chr21:41756690-41756711)区域(图6)。荧光素酶报告实验结果表明,与lncRNA DSCAMAS1-Wt + miR-433-3p 阴性对照组比较,lncRNA DSCAM-AS1-Wt + miR-433-3p 组荧光素酶相对活性显著降低(P< 0.05);lncRNA DSCAM-AS1-Wt + miR-433-3p 阴性对照组、lncRNA DSCAM-AS1-Mut + miR-433-3p 阴性对照组、lncRNA DSCAM-AS1-Mut + miR-433-3p 组荧光素酶相对活性差异无统计学意义(P> 0.05;表6)。RIP 检测结果显示,相对于lgG,lncRNA DSCAM-AS1 和miR-433-3p 在Ago2 免疫沉淀中显著富集(P< 0.05;图7)。

图6 LncRNA DSCAM-AS1 靶向调控miR-433-3pFigure 6.Targeted Regulation of miR-433-3p by LncRNA DSCAM-AS1
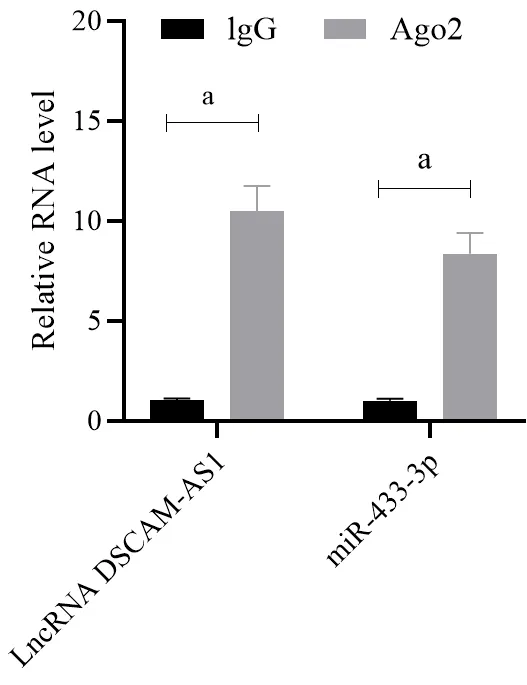
图7 circPTK2 和miR-761 可被Ago2 抗体沉淀(RIP 实验)Figure 7. circPTK2 and miR-761 Can be Precipitated by Ago2 Antibody (RIP)
表6 各组荧光素酶相对活性比较(N = 8,±s)Table 6.Relative Activity of Luciferase in Each Group(N = 8,±s)

表6 各组荧光素酶相对活性比较(N = 8,±s)Table 6.Relative Activity of Luciferase in Each Group(N = 8,±s)
aP < 0.05,compared to the lncRNA DSCAM-AS1-Wt + miR-433-3p negative control group.
?
2.5 抑制miR-433-3p 表达可逆转沉默lncRNA DSCAM-AS1 对BGC-823 细胞增殖、侵袭和迁移以及PCNA、MMP-2、MMP-9 表达的抑制作用
LncRNA DSCAM-AS1 siRNA 组和lncRNA DSCAMAS1 siRNA + miR-433-3p 阴性对照组lncRNA DSCAMAS1、miR-433-3p、细胞活力、细胞侵袭和迁移数目、PCNA、MMP-2、MMP-9 表达水平差异无统计学意义(P> 0.05);与lncRNA DSCAM-AS1 siRNA 组和lncRNA DSCAM-AS1 siRNA+miR-433-3p 阴性对照组比 较,lncRNA DSCAM-AS1 siRNA+miR-433-3p siRNA 组lncRNA DSCAM-AS1 表达水平差异无统计学意义(P> 0.05),miR-433-3p 表达水平显著降低(P< 0.05),细胞活力、细胞侵袭和迁移数目、PCNA、MMP-2、MMP-9 表达水平显著升高(P< 0.05;表7、图8、9)。
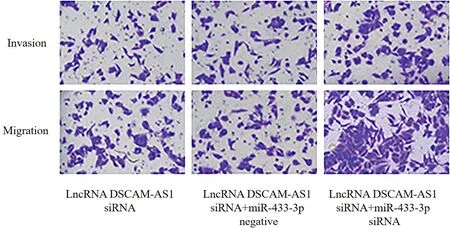
图8 各组组BGC-823 细胞侵袭和迁移图Figure 8.Invasion and Migration of BGC-823 Cells in Each Group

图9 各组PCNA、MMP-2、MMP-9 蛋白印迹图Figure 9.Protein Blotting of of PCNA, MMP-2 and MMP-9 in Each Group
表7 抑制miR-433-3p 表达可逆转沉默lncRNA DSCAM-AS1 对BGC-823 细胞增殖、侵袭和迁移以及PCNA、MMP-2、MMP-9 表达的抑制作用(N = 8,±s)Table 7.Inhibition of miR-433-3p Expression Can Reverse the Inhibitory Effect of Silencing LncRNA DSCAM-AS1 on the Proliferation, Invasion and Migration of BGC-823 Cells, and on the Expressions of PCNA, MMP-2 and MMP-9(N = 8,±s)

表7 抑制miR-433-3p 表达可逆转沉默lncRNA DSCAM-AS1 对BGC-823 细胞增殖、侵袭和迁移以及PCNA、MMP-2、MMP-9 表达的抑制作用(N = 8,±s)Table 7.Inhibition of miR-433-3p Expression Can Reverse the Inhibitory Effect of Silencing LncRNA DSCAM-AS1 on the Proliferation, Invasion and Migration of BGC-823 Cells, and on the Expressions of PCNA, MMP-2 and MMP-9(N = 8,±s)
aP < 0.05,compared to the lncRNA DSCAM-AS1 siRNA group; bP < 0.05,compared to the lncRNA DSCAM-AS1 siRNA + miR-433-3p negative control group.Abbreviations as indicated in Table 4.
?
3 讨 论
LncRNA DSCAM-AS1 位于21q22.2,属于细胞黏附分子的免疫球蛋白超家族,以往研究表明lncRNA DSCAM-AS1 在多种人类癌症中起重要作用[8-9]。Lu等[10]研究表明,结肠癌组织和细胞系HCT8、HT-29、SW480 及Lovo 中lncRNA DSCAM-AS1 的表达分别显著高于癌旁组织和正常人结肠上皮细胞系NCM460,且lncRNA DSCAM-AS1 表达与结肠癌患者临床肿瘤分期、淋巴结转移有关,lncRNA DSCAM-AS1 高表达患者总体生存率相对较差。本研究发现,lncRNA DSCAMAS1 在胃癌组织和细胞中呈高表达,沉默lncRNA DSCAM-AS1 的表达能够抑制胃癌BGC-823 细胞的增殖、侵袭和迁移,提示lncRNA DSCAM-AS1 可能与胃癌的发生、发展有关。
miRNA 是一类非编码小分子RNA,具有转录后调控基因表达的功能,是参与细胞生长、分化、发育和凋亡各种细胞活动的调节因子[11-12]。以往研究表明,肿瘤细胞内miRNA 的异常表达,使下游靶蛋白调控障碍,从而促进肿瘤的发生,并与肿瘤复发、肿瘤的恶性程度和临床分期、分级,组织浸润等病理特征有关[13-15]。miR-433-3p 是一种具有显著抗肿瘤作用的miRNA,Jin 等[16]研究表明miR-433-3p 在非小细胞肺癌细胞中呈低表达,过表达miR-433-3p 会抑制非小细胞肺癌的肿瘤生长。马文飚等[17]研究显示,甲状腺癌组织中miR-433-3p 呈低表达,过表达miR-433-3p 可使甲状腺癌SW579 细胞恶性生物学行为受到抑制。Sun 等[18]研究表明神经胶质瘤组织和细胞U251、U87 中miR-433-3p 表达显著降低,且miR-433-3p 能够抑制U251、U87 细胞的增殖、侵袭和迁移。本研究结果发现,miR-433-3p 在胃癌组织中呈低表达,过表达miR-433-3p 显著抑制胃癌BGC-823 细胞的增殖、侵袭和迁移,提示miR-433-3p可能与胃癌的发生有关。
肿瘤细胞的增殖和侵袭是导致癌症发生、发展的重要原因,PCNA 与细胞DNA 合成密切相关,在细胞增殖的启动上有重要作用,可作为评价细胞增殖状态的指标[19]。MMP 属于锌依赖性肽链内切酶家族,参与细胞外基质中蛋白质的降解和血管生成,促进细胞的增殖、迁移和侵袭,与肿瘤的发生有关[20]。本研究发现,miR-433-3p 过表达后,BGC-823细胞中PCNA、MMP-2、MMP-9 表达水平显著降低,进一步提示miR-433-3p 可能通过抑制BGC-823 细胞的增殖、侵袭和迁移,进而影响胃癌的发生发展,具体机制有待进一步研究。
lncRNA 能够通过调节miRNA 的表达从而参与人类癌症的进展,Yu 等[9]研究表明lncRNA DSCAM-AS1 通过靶向调控miR-101 的表达促进骨肉瘤细胞SAOS2、U2OS的增殖和迁移。本研究发现,miR-433-3p 的表达与胃癌组织中lncRNA DSCAMAS1 的表达呈负相关,抑制lncRNA DSCAM-AS1 的表达能够促进miR-433-3p 的表达,进一步双荧光素酶实验和RIP 结果表明lncRNA DSCAM-AS1 与miR-433-3p 具有靶向关系,提示lncRNA DSCAMAS1 能够靶向负调控miR-433-3p 的表达。对BGC-823 细胞进行lncRNA DSCAM-AS1 siRNA 和miR-433-3p siRNA 共转染,结果发现共转染的BGC-823细胞活力、侵袭和迁移细胞数目以及PCNA、MMP-2、MMP-9 表达水平均高于lncRNA DSCAM-AS1 siRNA组,提示抑制miR-433-3p 的表达可能逆转沉默lncRNA DSCAM-AS1 对BGC-823 细胞增殖、侵袭和迁移的抑制作用,进一步说明lncRNA DSCAM-AS1可能通过靶向调控miR-433-3p 的表达,影响BGC-823 细胞的增殖、侵袭和迁移,从而参与胃癌的发生发展。
综上所述,沉默lncRNA DSCAM-AS1 可通过靶向促进miR-433-3p 的表达抑制胃癌BGC-823 细胞的增殖、侵袭和迁移,可能是胃癌生长、发展机制研究的新方向。然而,本研究仅从体外细胞水平上分析了lncRNA DSCAM-AS1 和miR-433-3p 对胃癌BGC-823 细胞的生物学过程的影响,下一步需结合体内实验进一步验证。此外,未对miR-433-3p 的下游靶基因进行分析也是本研究存在的不足,在未来的研究中将对lncRNA DSCAM-AS1/miR-433-3p 调控网络进行深入探索。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
