血清总胆红素、NLR、动脉血乳酸水平变化与ECMO辅助治疗患者预后生存的关系
2023-07-01邢学勇郭浩张保全袁帅飞崔星斌张科技
邢学勇 郭浩 张保全 袁帅飞 崔星斌 张科技
近些年来,全球体外膜肺氧合(Extracorporeal Membrane Oxygenation,ECMO)支持患者呈逐年上涨趋势。ECMO 支持技术的提高,尤其是插管技术的普及、生物材料的改进,为机体提供了有效呼吸循环支持,恢复机体微循环,缓解心功能障碍程度,既往的禁忌症逐渐转变成为适应症[1]。对此,临床广泛认为ECMO 治疗对改善患者预后有一定积极影响[2]。而经长期临床实践发现,ECMO 支持技术虽能有效延续患者生命,但其费用高昂,且会给患者带来一定损伤[3]。面对日益增长的患病群体,如何有效提高患者生存率成了当下治疗的重点。侯剑峰等[4]调查显示ECMO 支持后仍会出现死亡现象。黄金梦等[5]猜测ECMO 治疗患者死亡可能与高胆红素血症等并发症有关。而综合过往文献发现中性粒细胞、淋巴细胞、动脉血乳酸水等指标对患者预后均有一定的风险预测价值[6]。对此,本文推测中性粒细胞、淋巴细胞、动脉血乳酸、血清总胆红素水平变化对ECMO 辅助治疗患者生存率有一定影响,故本文以此为基点展开如下研究。
1 资料与方法
1.1 一般资料
选取2018 年1 月至2022 年9 月期间新乡医学院第三附属医院收治的74 例需进行ECMO 辅助治疗患者,根据ECMO 撤离1 个月内患者预后情况进行分组,分为生存组(n=53)、死亡组(n=21)。其中生存组男32 例,女21 例;年龄:41~72 岁,平均年龄(55.43±7.62)岁;死亡组男14 例,女7 例;年龄:43~70 岁,平均年龄(62.96±7.88)岁。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经院医学伦理委员会批准通过,受试者家属已签署知情同意书。
纳入标准:①均在进行ECMO 辅助治疗;②临床资料完整;排除标准:①非首次进行ECMO 辅助治疗患者;②合并恶性肿瘤患者。
1.2 方法
所有患者均进行经皮穿刺,扩张皮下血管后将ECMO 系统管路进行连接,并开启ECMO 系统,根据患者情况逐渐调节转速。分别在ECMO 治疗前、治疗1 d、2 d 后采集患者静脉血5 mL 及动脉血3 mL,将其中2 mL 静脉血进行离心(2 500 r/min,离心半径10 cm,12 min)后取其血清,采用全自动生化分析仪(型号:AU⁃5800,贝儿曼库特株式会社,国械注进2016092939)联合重氮酸盐法检测血清总胆红素水平;剩余3 mL 静脉血经血液细胞分析仪(型号:BC7500,深圳迈瑞生物医疗电子股份有限公司,粤械注准20212220570)检测出血细胞计数并计算出中性粒细胞与淋巴细胞比值(Neu⁃trophil to Lymphocyte Ratio,NLR);对3 mL 动脉血进行离心(2 500 r/min,离心半径10 cm,12 min)后取其血清,采用血气分析仪(型号:ABL90FLEX 北京盛景志翔医疗设备有限公司,国械注进20192221680)检测动脉血乳酸水平。乳酸正常参考范围:<2 mmol/L,血清总胆红素正常参考范围:<23 μmol/L,NLR 正常参考范围:>18%[7]。
1.3 观察指标
①比较两组临床数据情况:经各项检查后对比两组年龄、性别、左心射血分数、ECMO 建立时间、急性生理与慢性健康评分(Acute Physiology and Chronic Health Evaluation Ⅱ,APACHE⁃Ⅱ)评分等临床数据。
②比较两组ECMO 辅助治疗前1 h 及治疗1 d、2 d 后动脉血乳酸情况:包括各时间段患者机体内动脉血乳酸水平及ECMO 治疗48 h 内乳酸清除率,清除率=[(ECMO 治疗前1 h 乳酸水平⁃ECMO治疗2 d 后乳酸水平)/ECMO 治疗前1 h 乳酸水平]×100%。
③比较两组ECMO 辅助治疗前1 h 及治疗1 d、2 d 后血清总胆红素水平。
④比较两组ECMO 辅助治疗前1 h 及治疗1 d、2 d 后NLR 情况。
⑤分析影响ECMO 辅助治疗患者死亡的危险因素。
1.4 统计学方法
采用SPSS 27.0 统计学软件分析数据,计量资料采用()的形式表示,组间比较采用t检验;计数资料采用n(%)表示,组间比较采用卡方χ2检验;采用多元Logistic回归分析影响ECMO 辅助治疗患者死亡的危险因素;以P<0.05 为差异具有统计学意义。
2 结果
2.1 两组临床数据情况比较
死亡组年龄大于生存组,其平均动脉压、氧合指数均低于生存组,APACHE⁃Ⅱ评分均高于生存组,差异有统计学意义(P<0.05);两组在其他临床数据方面比较差异无统计学意义(P>0.05)。见表1。
表1 两组临床数据情况比较()Table 1 Comparison of clinical data between the two groups()
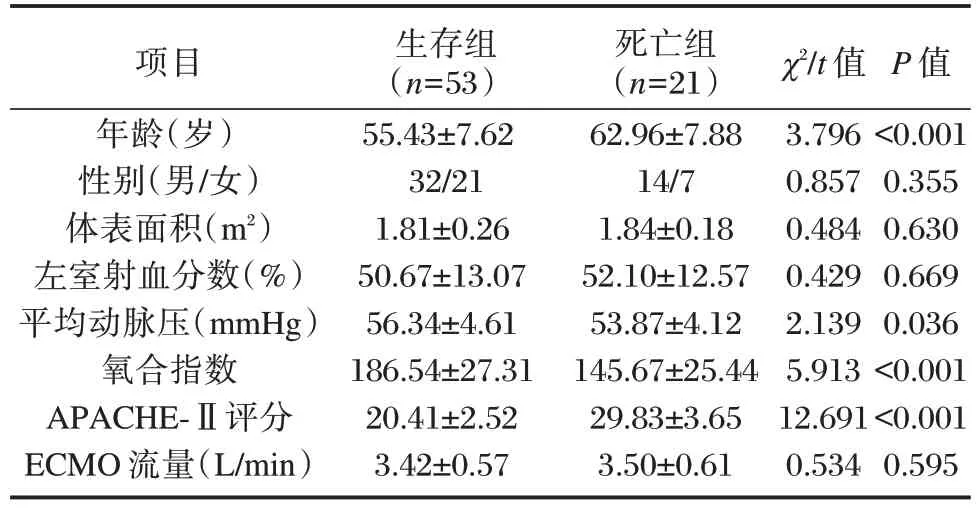
表1 两组临床数据情况比较()Table 1 Comparison of clinical data between the two groups()
2.2 两组ECMO 辅助治疗前1 h 及治疗1 d、2 d后动脉血乳酸情况比较
死亡组在治疗前动脉血乳酸水平高于生存组,经ECMO 辅助治疗后两组动脉血乳酸明显下降;死亡组治疗各阶段动脉血乳酸水平高于生存组,而死亡组乳酸清除率低于生存组,差异均有统计学意义(P<0.05)。见表2。
表2 两组ECMO 辅助治疗前1 h 及治疗1 d、2 d 后动脉血乳酸情况比较()Table 2 Comparison of arterial blood lactic acid 1h before ECMO adjuvant therapy and 1d and 2d after ECMO adjuvant therapy between the two groups()
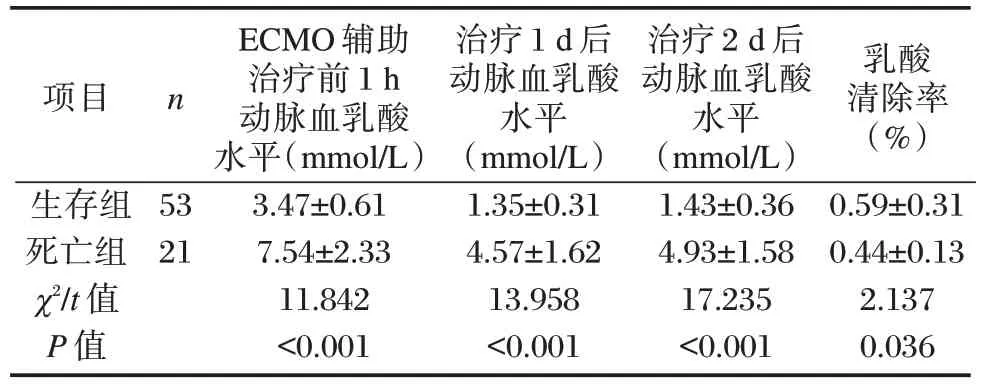
表2 两组ECMO 辅助治疗前1 h 及治疗1 d、2 d 后动脉血乳酸情况比较()Table 2 Comparison of arterial blood lactic acid 1h before ECMO adjuvant therapy and 1d and 2d after ECMO adjuvant therapy between the two groups()
2.3 两组ECMO 辅助治疗前1 h 及治疗1 d、2 d后血清总胆红素水平情况比较
经ECMO 辅助治疗后两组血清总胆红素明显降低,死亡组各阶段血清总胆红素水平明显高于生存组,差异均有统计学意义(P<0.05)。见表3。
表3 两组ECMO 辅助治疗前1 h 及治疗1 d、2 d 后血清总胆红素水平情况比较()Table 3 Comparison of serum total bilirubin levels 1 hour before ECMO adjuvant treatment and 1 day and 2 day after treatment between the two groups()

表3 两组ECMO 辅助治疗前1 h 及治疗1 d、2 d 后血清总胆红素水平情况比较()Table 3 Comparison of serum total bilirubin levels 1 hour before ECMO adjuvant treatment and 1 day and 2 day after treatment between the two groups()
2.4 两组ECMO 辅助治疗前1 h 及治疗1 d、2 d后NLR 情况比较
经ECMO 辅助治疗后两组NLR 明显升高,死亡组各阶段NLR 低于生存组,差异均有统计学意义(P<0.05)。见表4。
表4 两组ECMO 辅助治疗前1 h 及治疗1 d、2 d 后NLR情况比较()Table 4 Comparison of NLR 1 h before ECMO adjuvant therapy and 1 d and 2 d after treatment between the two groups()
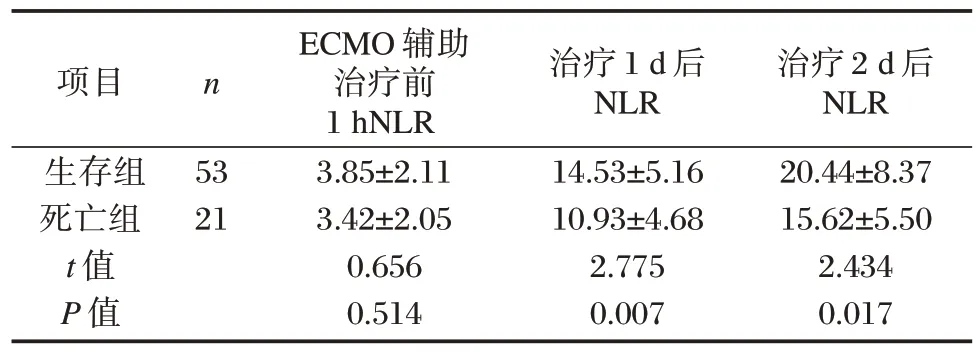
表4 两组ECMO 辅助治疗前1 h 及治疗1 d、2 d 后NLR情况比较()Table 4 Comparison of NLR 1 h before ECMO adjuvant therapy and 1 d and 2 d after treatment between the two groups()
2.5 影响ECMO 辅助治疗患者死亡的危险因素分析
综合上述表以治疗2 d 后动脉血乳酸水平、血清总胆红素、NLR 及乳酸清除率为自变量,以生存=0,死亡=1 为因变量进行分析,结果显示,治疗2 d 后动脉血乳酸水平、血清总胆红素、NLR 为ECMO 辅助治疗患者死亡的独立危险因素(P<0.05)。见表5。
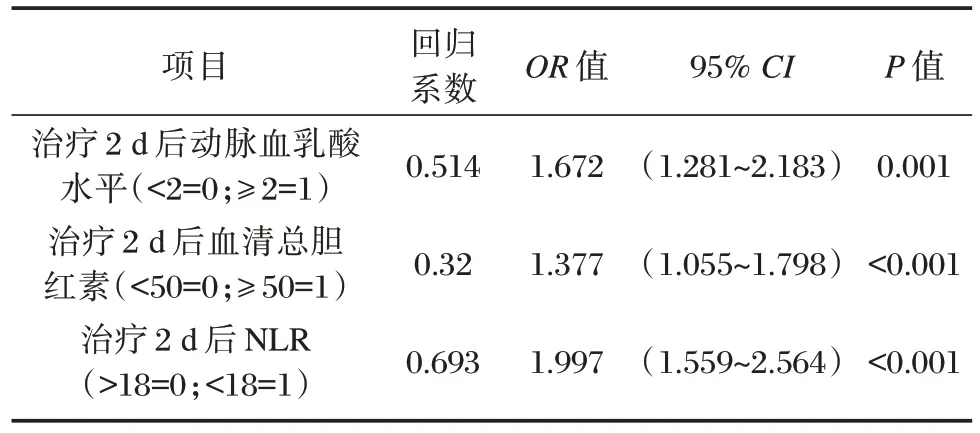
表5 影响ECMO 辅助治疗患者死亡的危险因素分析Table 5 Analysis of risk factors affecting the death of patients receiving ECMO adjuvant therapy
3 讨论
近些年来,我国ECMO 支持手术逐渐成熟,救治数量和成功率逐年上升[8]。ECMO 治疗虽能一定程度上为机体提供循环辅助,但预后不良患者仍时有出现。
本文研究显示,死亡组年龄大于生存组,其平均动脉压、氧合指数均低于生存组,APACHE⁃Ⅱ评分均高于生存组,与周浩等[9]的结论一致。分析可知,大龄患者自身基础疾病较多,其免疫屏障及机体功能下降,心功能代偿能力低下,影响患者预后效果;平均动脉压、氧合指数下降,会造成机体各组织器官缺氧、缺氧,加重机体负担,造成预后不良。乳酸在正常生理状态下由机体新陈代谢产生,但血液中乳酸异常增加会导致机体血液酸化,加重原发病情,进而危及生命。赵嘉美等[10]提出乳酸可反映机体循环状态及组织灌注情况。本研究显示,经ECMO 辅助治疗后两组动脉血乳酸明显下降,死亡组治疗各阶段动脉血乳酸水平高于生存组,而死亡组乳酸清除率低于生存组,与李伟等[11]结论吻合。分析可得,患者出现微循环障碍,促进无氧酵解环境下葡萄糖的分解,致使机体乳酸水平上高,经ECMO 治疗后为心脏输出提供支持,恢复部分微循环,使得乳酸大幅度下降,乳酸清除率升高,而结果可见乳酸在ECMO 治疗后有短暂的回升,是因为在循环障碍时乳酸堆积难以进入循环,当循环逐渐恢复后,部分堆积乳酸进入血液造成短期“洗出效应”。此外,有学者提出血清总胆红素可作为心血管不良事件的预测指标[12]。而本文研究表明,经ECMO 辅助治疗后两组血清总胆红素明显降低,死亡组各阶段血清总胆红素水平明显高于生存组,与曹晓光等[13]研究相符。推测其原因为,总胆红素能抑制机体氧化作用,有效反映肝功能情况,但高水平总胆红素会对机体产生一定毒副作用进而损伤神经系统,经ECMO 治疗后肝脏组织供血恢复,总胆红素水平下降,但ECMO 治疗可能导致血液动力学不稳定,而死亡组患者氧合指数较低,对肝脏组织灌注的恢复产生负面影响。另一方面,因NLR 与炎性反应存在密切关联,研究学者对重症疾病患者体内NLR 情况进行分析发现,NLR 变化与预后情况有一定联系[13]。本研究得出,经ECMO 辅助治疗后两组NLR 升高,死亡组各阶段NLR 低于生存组,同曹志龙等[14]研究结果一致。分析原因为,因组织灌注异常,导致机体出现过度应激反应,诱导免疫细胞凋亡,使NLR 降低,经ECMO 建立管路连接后刺激免疫细胞活性,有效提高了NLR 比值。而死亡组患者因素自身免疫力低下,且氧合作用弱导致机体获能减少,同时在ECMO 治疗过程中会对机体带来一定损伤,导致炎症的发生,致使免疫炎症处于失衡状态,一定程度上阻碍了NLR 比值的恢复,使其致NLR 持续低于生存组。进一步分析发现,治疗后动脉血乳酸水平、血清总胆红素、NLR 为ECMO 辅助治疗患者死亡的独立危险因素。与王海斌等[15]的研究结果一致。推测其原因可能为,NLR 降低导致机体免疫功能下降,而血乳酸、胆红素水平异常升高对机体产生了负面影响,进一步损害患者机体,严重干扰预后效果。
综上所述,治疗2 d 后血清总胆红素及动脉血乳酸高水平,NLR 低会导致ECMO 辅助治疗患者预后不佳,应早期进行检测,保障预后生存率。
