BCR⁃ABL 融合基因检测试剂盒(荧光PCR法)的评价
2023-07-01张文新曲守方李丽莉孙楠黄传峰黄杰
张文新 曲守方 李丽莉 孙楠 黄传峰 黄杰
慢性髓性白血病(chronic myelogenous leuke⁃mia,CML)具有标志性的细胞遗传学异常t(9;22)(q34;q11)形成的费城染色体(Philadelphia,Ph),在分子水平形成BCR⁃ABL融合基因[1]。BCR基因有多种断裂方式,其中主断裂区称为M⁃bcr,结合ABL基因后能够形成BCR⁃ABLP210 型融合基因,主要包含b3a2(e13a2)和b3a2(e14a2)两种拼接方式[2]。BCR⁃ABL 酪氨酸激酶抑制剂(tyro⁃sine kinase inhibitors,TKI)如伊马替尼、尼洛替尼和普纳替尼等已经成为慢性髓性白血病患者的一线治疗药物,提高了CML 患者的生存期[3]。
BCR⁃ABL融合基因的检测技术包括荧光原位杂交法(fluorescent in situ hybridization,FISH)、荧光逆转录聚合酶链反应(reverse transcription⁃poly⁃merase chain reaction,RT⁃PCR)和数字聚合酶链反应(digital polymerase chain reaction,dPCR)法[4⁃6]等。虽然国内已经有多家公司开发了BCR⁃ABL融合基因定量检测试剂盒(荧光PCR 法),但是国家药品监督管理局尚未批准该类试剂盒上市。本研究使用本院提供的BCR⁃ABL 定量标准品,评价BCR⁃ABL融合基因定量检测试剂盒准确度、检出限、重复性和线性等项目的性能。
1 材料与方法
1.1 研究对象
BCR⁃ABL 定量标准品:WS1、WS2、WS3、WS4,融合比例分别为:12.359%、1.692%、0.177%和0.015%,由中国食品药品检定研究院提供。
1.2 主要试剂
BCR⁃ABL1融合基因核酸定量检测试剂盒(PCR⁃荧光探针法)(简称试剂盒A)和核酸提取或纯化试剂,广州达安基因股份有限公司;BCR⁃ABL1 P210型融合基因测定试剂盒(荧光RT⁃PCR 法)(简称试剂盒B)和TRIzol Reagent,北京旌准医疗科技有限公司;人BCR⁃ABL融合基因检测试剂盒(荧光PCR 法)(简称试剂盒C)和RNeasy mini kit,迈杰转化医学研究(苏州)有限公司;BCR⁃ABL P210融合基因定量检测试剂盒(荧 光RT⁃PCR 法)(简称试剂盒D)和TRIzol Reagent,苏州云泰生物医药科技有限公司。
1.3 主要仪器
荧光定量PCR 仪,型号:ABI 7500,美国赛默飞世尔科技公司;荧光PCR 检测仪,型号:Bio⁃Rad CFX96,美国伯乐公司。
1.4 方法
各BCR⁃ABL融合基因检测试剂盒按照说明书要求对BCR⁃ABL 定量标准品进行RNA 提取,并测定浓度和纯度。将样本RNA 和试剂盒的定量标准品分别加入BCR⁃ABL 反应液和ABL 反应液,使用荧光定量PCR 仪进行检测。然后根据试剂盒定量标准品的标准曲线,对BCR⁃ABL 定量标准品(WS1~WS4)进行BCR⁃ABL 和ABL 拷贝数的定量及BCR⁃ABL 与ABL 拷贝数融合比例的计算分析,获得标准品的BCR⁃ABL融合基因检测结果。对准确度标准品重复检测2 次,标准品的标示融合比例和检测融合比例的值分别取对数值,然后计算绝对偏差,标准要求绝对偏差不超过±0.5 个对数数量级(log)。对于0.01%融合比例的BCR⁃ABL(P210)融合基因检测限标准品重复检测10 次,标准要求应能检测出阳性。对重复性标准品检测,标准要求BCR⁃ABL 反应通道Ct值的变异系数(CV,%)应≤5.0%。按照试剂盒说明书进行操作,将每一浓度标准品进行2 次检测,计算每一标准品的检测浓度对数值的均值,以理论浓度对数值为xi,检测的浓度对数值的均值为yi,进行线性拟合,计算其线性相关系数r,标准要求线性相关系数︱r︱≥0.980 0。
2 结果
2.1 准确度
准确度标准品WS2 和WS3 的标示融合比例分别为1.692%和0.177%,各试剂盒对WS2 和WS3 的融合比例结果的绝对偏差在-0.16~0.14 log内,满足-0.5~0.5 log 的标准要求。见图1、2。

图1 WS2 和WS3 融合比例的结果Figure 1 Results of fusion ratio of WS2 and WS3

图2 WS2 和WS3 融合比例对数的绝对偏差Figure 2 Absolute deviation for logarithm of fusion ratio of WS2 and WS3
2.2 检出限
按照各个试剂盒说明书的阳性判断值进行判读,结果显示各试剂盒对检测限标准品WS4,均能检出BCR⁃ABL融合突变阳性,试剂盒A 中WS4 融合比例检测结果平均值为0.027%(BCR⁃ABL 通道Ct 值≤38 为阳性),试剂盒B 中WS4 融合比例检测结果平均值为0.017%(BCR⁃ABL 通道Ct 值≤40 为阳性),试剂盒C 中WS4 融合比例检测结果平均值为0.013%(融合比例≥0.003 2%为阳性),试剂盒D 中WS4 融合比例检测结果平均值为0.022%(BCR⁃ABL 通道Ct 值≤36 为阳性)。WS4 的10 次重复的融合比例结果见图3。

图3 WS4 融合比例的结果Figure 3Results of fusion ratio of WS4
2.3 重复性
结果显示对于重复性标准品WS1 和WS4,各试剂盒BCR⁃ABL 通道检测Ct值的变异系数(CV,%)在0.2%~2.5%范围内,符合CV 不高于5.0%的要求。见图4。

图4 重复性结果Figure 4Results of repeatability
2.4 线性
结果显示各试剂盒的线性相关系数|r|在0.9899~1.000 范围内,符合线性的要求。线性拟合曲线见图5。
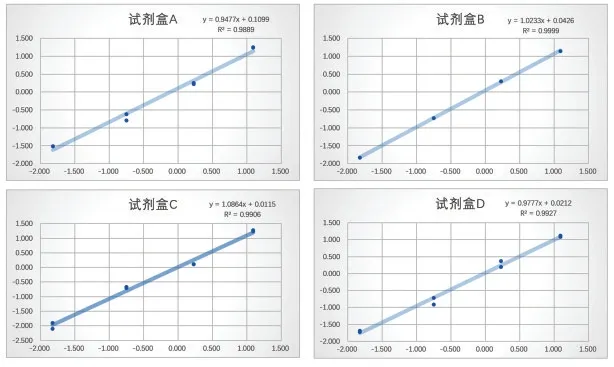
图5 线性拟合曲线Figure 5 Linear fitting curve
3 讨论
BCR⁃ABL的定量检测必须准确和稳定,才能保证CML 患者疗效的准确评价。不同实验室由于内参基因的选择、试剂及仪器等各种影响因素,检测同一样本BCR⁃ABL融合基因转录本水平可能会有差异。2005 年,在国际CML 共识会议上专家们提出了国际标准(international scale,IS)的建议,即通过转换系数(conversion factor,CF),将各实验室的BCR⁃ABL融合基因检测值均转换为国际标准值BCR⁃ABLIS[7]。我国北京大学人民医院组织了用于转换国际标准的慢性髓性白血病的BCR⁃ABL(P210)转录本水平的转换系数(CF)的有效性研究工作,对国内BCR⁃ABL 融合基因的检测进行规范[8⁃9]。BCR⁃ABLIS是CML 分子检测国际通用语言,能够指导临床医师根据国内外CML 治疗指南并参考相关临床数据对CML 患者进行正确的治疗。
2009 年,世界卫生组织(World Health Organi⁃zation,WHO)提供了“第一代BCR⁃ABLmRNA 的国际遗传定量标准品”(NIBSC code:09/138),由冻干的K562 和HL⁃60 细胞混合制成,用于BCR⁃ABL主要型(e13a2 和e14a2)的国际标准(IS)校准[10⁃11]。BCR⁃ABL融合基因定量检测试剂盒(荧光PCR 法),具有灵敏、特异以及准确定量的特点,通过分别检测BCR⁃ABL和ABL基因,然后利用试剂盒工作标准品的标准曲线定量各自的拷贝数,计算出样本的BCR⁃ABLmRNA 水平:(BCR⁃ABL copies/ABL copies)×100%,并获得样本的BCR⁃ABLIS=(BCR⁃ABL 拷贝数/ABL 拷贝数)*100*转化系数(CF)。本研究使用的4 个BCR⁃ABL融合基因定量检测试剂盒(荧光PCR 法),只有1个试剂盒提供了转化系数(CF),说明BCR⁃ABL融合基因的标准化检测还需要规范。
中国食品药品检定研究院提供的BCR⁃ABL定量标准品溯源至WHO 国际定量标准品(NIBSC code:09/138),WS1~WS4 的融合比例分别为12.359%、1.692%、0.177%和0.015%,在定量检测试剂盒的线性区间内,用于评价定量试剂盒的准确度、检出限和重复性的性能。MR4.0[BCR⁃ABL≤0.01%(IS)]和MR4.5[BCR⁃ABL≤0.003 2%(IS)]是在主要分子学反应(major molecular response,MMR)基础上所追求的深层分子学反应(deep mo⁃lecular response,DMR),是实现无治疗缓解的前提。根据我国BCR⁃ABL融合基因定量检测试剂盒的产品特点和临床应用需要,本研究将融合比例不高于0.01%的样品作为试剂盒的检出限,要求应能检测相应的融合基因阳性。体外诊断试剂产品标准的要求应不低于行业标准的要求,为了推动BCR⁃ABL融合基因检测技术的发展,鼓励生产企业提高产品的检出限要求,可将融合比例提高至不高于0.003 2%。研究结果表明对BCR⁃ABL 定量标准品,各试剂盒均能准确检出相应的融合基因突变,且融合比例满足了定量标准品的准确度和检出限要求,BCR⁃ABL 检测通道Ct值的变异系数(CV,%)均不高于5.0%,各试剂盒的线性相关系数|r|均不低于0.980 0。本研究评价的BCR⁃ABL融合基因定量检测试剂盒(荧光PCR 法),其性能不仅满足了《断裂点簇集区艾贝尔逊白血病病毒(BCR⁃ABL)融合基因检测试剂盒》行业标准的相关要求,也为临床检测提供了有力的技术支撑作用,为产品的注册上市和监督评价工作提供技术指导作用[11]。
