EZH2 介导NLRP3 炎症小体在高糖诱导心肌细胞损伤中的作用及机制
2023-07-01代路高世龙周彦文杨青霞孟馥芬
代路 高世龙 周彦文 杨青霞 孟馥芬
糖尿病性心肌病(Diabetic Cardiomyopathy,DCM)是糖尿病常见的一种慢性并发症[1]。心肌细胞凋亡和炎症反应是高血糖引起心肌损伤重要的病理生理机制[2],可介导糖尿病心脏的结构和代谢变化[3]。Zeste基因增强子人类同源物2(enhancer of zeste homolog 2,EZH2)是一种表观遗传修饰物,具有组蛋白甲基转移酶活性,在调控基因表达过程中至关重要[4]。功能失调的EZH2 与小鼠和人类多种癌症类型的发生发展有关,并可通过抑制肿瘤内抗原呈递、免疫细胞迁移和增强CD4+T 调节细胞(Treg)抑制活性来促进免疫逃避。这些功能使EZH2 成为一个有吸引力的治疗靶点。Nod 样受体蛋白3(Nod⁃like receptor protein 3,NLRP3)炎症小体是一种多分子复合物,活化后促进细胞炎症因子白细胞介素(interleukin,IL)⁃1β、IL⁃18 的成熟和释放[5],可加速心肌细胞凋亡[6]。本研究就EZH2 介导NLRP3 炎症小体对高糖诱导心肌细胞损伤进行分析,汇报如下。
1 材料与方法
1.1 细胞
H9c2 大鼠心肌细胞系(CL⁃0089)购于武汉普诺赛生命科技有限公司。
1.2 主要试剂及仪器
兔抗大鼠EZH2、兔抗大鼠Cleaved caspase⁃3和兔抗大鼠Bax(Cell Signaling Technology,5246s,9661s,2774s);兔抗大鼠NLRP3 和兔抗大鼠ASC(Abcam,ab263899,ab180799);兔抗大鼠caspase⁃1(Proteintech,22915⁃1⁃AP);兔抗大鼠β⁃actin(Sino⁃Biological,100100⁃MM10);辣根过氧化物酶标记的羊抗兔二抗(Bioss,bs⁃40295G⁃HRP);lipo⁃fectamine 8000(碧云天,C0533);SYBR Green PCR试剂盒(Qiagen,208054);si⁃NC、si⁃EZH2、NLRP3过表达载体pcDNA⁃NLRP3 和空载体NLRP3⁃NC均购于吉玛基因。7500 型实时荧光定量PCR 仪(美国ABI,7500fast)。
1.3 实验分组与方法
1.3.1 细胞培养
H9c2 心肌细胞用含10%FBS 和1%双抗混合液的DMEM 培养基置于37℃、5%CO2的细胞培养箱中培养。
1.3.2 H9c2 心肌细胞损伤模型的建立
将接种于96 孔板的H9c2 心肌细胞随机分为5 组,其中葡萄糖浓度依次为5.5、11、22、33、44 mmol/L 分别培养1、2、3、4 d 后检测细胞活力。
1.3.3 实验分组
将对数生长期H9c2 细胞接种于96 孔板中,当细胞融合度为70%时,弃去培养基,更换为不含胎牛血清培养基,用5.5、33 mmol/L 葡萄糖干预48 h后,分别记为正常葡萄糖对照组(CON)、高糖损伤组(HG);按照脂质体法将si⁃NC、si⁃EZH2、NLRP3⁃NC 和NLRP3⁃OE 转染至H9c2 细胞,然后用33 mmol/L 葡萄糖干预48 h 后,分别记为A 组、B 组、C 组、D 组、E 组、F 组。
1.3.4 流式细胞术检测细胞凋亡
使用PBS 冲洗各组H9c2 细胞,结束后加400 μL 缓冲液制备成细胞悬液,先后依次加入10 μL Annexin V⁃FITC 和5 μL 7⁃AAD 试剂,混匀避光反应30 min,加100 μL 缓冲液,用流式细胞仪检测细胞凋亡情况。
1.3.5 Western blot 检测EZH2、NLRP3、ASC、cas⁃pase⁃1、Cleaved caspase⁃3、Bax 蛋白表达
收集各组心肌细胞加入RIPA 裂解液提取细胞总蛋白,于-80℃下保存蛋白裂解物,BCA 法测定各组细胞蛋白浓度,加入5×蛋白上样缓冲液后将蛋白转移至PVDF 膜,5%脱脂牛奶封闭。兔抗大鼠EZH2(1∶1 000)、NLRP3(1∶800)、ASC(1∶800)、caspase⁃1(1∶500)、Cleaved caspse⁃3(1∶1 000)、Bax(1∶1 000)、β⁃actin(1∶1 000)4℃孵育过夜,TBST 洗涤3 次后与结合HRP 二抗(1∶10 000)室温下孵育1 h。ECL 显影,凝胶成像系统曝光、显影。Image J 软件分析各组蛋白表达水平。
1.3.6 qRT⁃PCR 检测IL⁃1β、IL⁃18的mRNA 表达
收集各组培养上清液,用Trizol 试剂抽提总RNA,逆转录试剂盒得到cDNA,以cDNA 为模版,按照qRT⁃PCR 试剂盒说明配置PCR 反应体系并设定程序。以GAPDH为内参,根据2⁃ΔΔCt算法,计算IL⁃1β和IL⁃18的mRNA 表达水平。
1.3.7 细胞转染
根据制造商说明,使用lipofectamine 8000 分别将其转染至H9c2 心肌细胞。将转染细胞培养48 h后,qRT⁃PCR 检测EZH2和NLRP3的mRNA 表达水平以证实转染成功。
1.4 统计学方法
采用SPSS 19.0 统计软件分析,计量资料以()表示,两组间比较采用独立样本t检验,多组间比较采用F分析。P<0.05 为差异有统计学意义。
2 结果
2.1 细胞转染效率验证
qRT⁃PCR 结果表明,与A 组比较,B 组1062 具有较好的沉默效果,差异有统计学意义(P<0.05),与C 组比较,D 组具有较好的过表达效果(P<0.05)。见图1。

图1 EZH2⁃siRNA 敲减效率和pcDNA⁃NLRP3 过表达效率验证Figure 1 Verification of EZH2⁃siRNA knockdown efficiency and pcDNA⁃NLRP3 over⁃expression efficiency
2.2 高糖诱导H9c2 心肌细胞发生炎症反应
qRT⁃PCR 结果显 示,CON 组IL⁃1β、IL⁃18mRNA 表达分别为(0.92±0.13)、(1.02±0.25),低于HG 组的(1.82±0.32)、(2.10±0.26),差异有统计学意义(t=8.240,9.469,P<0.05)。
2.3 EZH2 和NLRP3 炎症小体在高糖诱导H9c2心肌细胞中的蛋白表达
Western blot 结果显示,CON 组EZH2、NLRP3、ASC、caspase⁃1 蛋白表达均低于HG 组,差异有统计学意义(P<0.05)。见表1。
表1 EZH2 和NLRP3 炎症小体在高糖诱导H9c2 心肌细胞中的蛋白表达()Table 1 Protein expression of EZH2 and NLRP3 inflammasome in H9c2 cardiomyocytes induced by high glucose()

表1 EZH2 和NLRP3 炎症小体在高糖诱导H9c2 心肌细胞中的蛋白表达()Table 1 Protein expression of EZH2 and NLRP3 inflammasome in H9c2 cardiomyocytes induced by high glucose()
2.4 抑制EZH2 可抑制高糖诱导H9c2 心肌细胞凋亡
Cleaved caspase⁃3、Bax 蛋白表达及凋亡率比较,HG 组>A 组>B 组>CON 组,HG 组与B 组无统计学意义(P>0.05),其余均有统计学意义(P<0.05)。见表2。
表2 抑制EZH2 对高糖诱导H9c2 心肌细胞Cleaved caspase⁃3、Bax 蛋白表达及凋亡率的影响()Table 2 Effects of EZH2 inhibition on Cleaved caspase⁃3,Bax protein expression and apoptosis rate of H9c2 cardiomyocytes induced by high glucose()
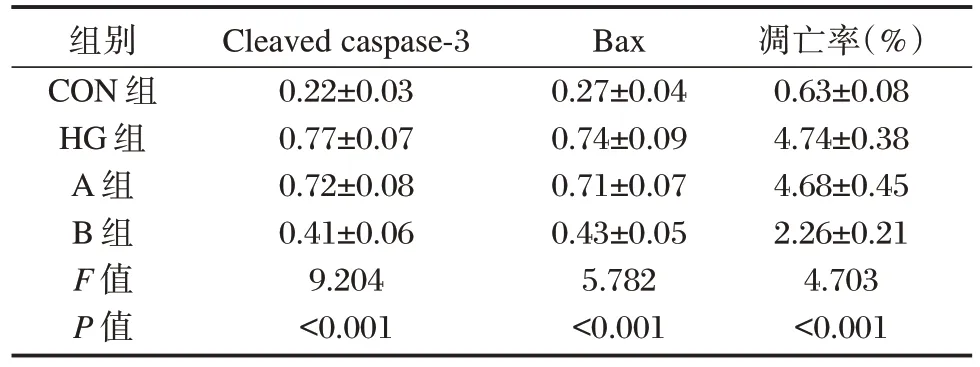
表2 抑制EZH2 对高糖诱导H9c2 心肌细胞Cleaved caspase⁃3、Bax 蛋白表达及凋亡率的影响()Table 2 Effects of EZH2 inhibition on Cleaved caspase⁃3,Bax protein expression and apoptosis rate of H9c2 cardiomyocytes induced by high glucose()
2.5 抑制EZH2 可抑制高糖诱导H9c2 心肌细胞炎症反应
RT⁃PCR 结果显示,IL⁃1β、IL⁃18表达量比较,CON 组,HG 组>A 组>组>CON 组,差异有统计学意义(P<0.05)。见表3。
表3 抑制EZH2 可抑制高糖诱导H9c2 心肌细胞IL⁃1β 和IL⁃18 的表达量()Table 3 Inhibition of EZH2 inhibited the expression of IL⁃1β and IL⁃18 in H9c2 cardiomyocytes induced by high glucose()

表3 抑制EZH2 可抑制高糖诱导H9c2 心肌细胞IL⁃1β 和IL⁃18 的表达量()Table 3 Inhibition of EZH2 inhibited the expression of IL⁃1β and IL⁃18 in H9c2 cardiomyocytes induced by high glucose()
2.6 抑制EZH2 对高糖诱导H9c2 心肌细胞NLRP3 炎症小体蛋白表达的影响
Western blot 结果显示,HG 组EZH2、NLRP3、ASC、caspase⁃1 蛋白表达均高于CON 组,B 组低于HG 组与A 组。见表4。
表4 抑制EZH2 对高糖诱导H9c2 心肌细胞NLRP3 炎症小体蛋白表达的影响()Table 4 Inhibitory effect of EZH2 on NLRP3 inflammasome protein expression in H9c2 cardiomyocytes induced by high glucose()

表4 抑制EZH2 对高糖诱导H9c2 心肌细胞NLRP3 炎症小体蛋白表达的影响()Table 4 Inhibitory effect of EZH2 on NLRP3 inflammasome protein expression in H9c2 cardiomyocytes induced by high glucose()
2.7 过表达NLRP3 对高糖诱导H9c2 心肌细胞损伤的影响
与C组比较,D组细胞凋亡率、Cleaved caspase⁃3、Bax 蛋白表达及IL⁃1β、IL⁃18mRNA 表达均升高(P<0.05)。见图2、表5。
表5 过表达NLRP3 对高糖诱导H9c2 心肌细胞Cleaved caspase⁃3 和Bax 蛋白表达及凋亡率的影响()Table 5 Effect of overexpression of NLRP3 on the protein expression of Cleared caspase⁃3 and Bax and apoptosis rate of H9c2 cardiomyocytes induced by high glucose()
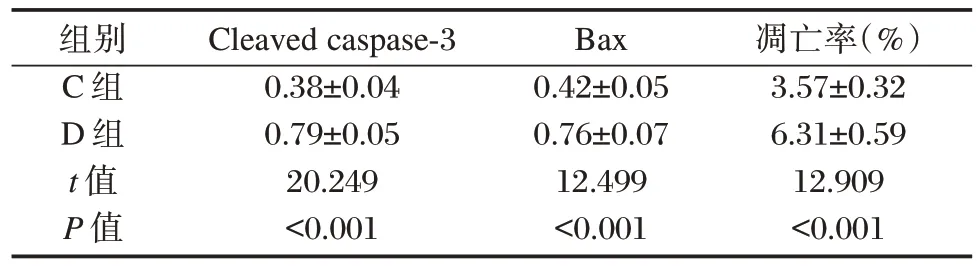
表5 过表达NLRP3 对高糖诱导H9c2 心肌细胞Cleaved caspase⁃3 和Bax 蛋白表达及凋亡率的影响()Table 5 Effect of overexpression of NLRP3 on the protein expression of Cleared caspase⁃3 and Bax and apoptosis rate of H9c2 cardiomyocytes induced by high glucose()
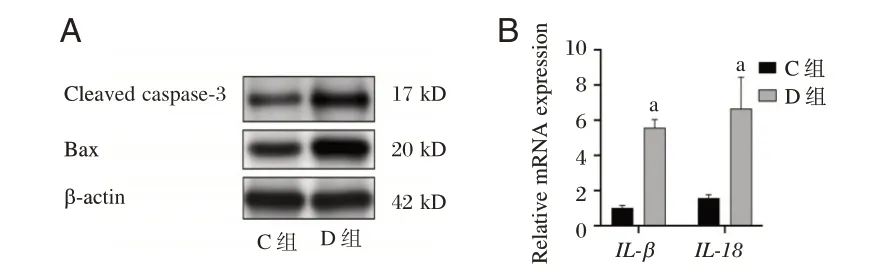
图2 过表达NLRP3 对高糖诱导H9c2 心肌细胞Cleaved caspase⁃3 和Bax 蛋白表达及IL⁃1β、IL⁃18 mRNA 表达的影响Figure 2 Effect of overexpression of NLRP3 on the protein expression of Cleaved caspase⁃3 and Bax and the mRNA expression of IL⁃1β and IL⁃18 in H9c2 cardiomyocytes induced by high glucose
2.8 过表达NLRP3 对干扰EZH2 后高糖诱导H9c2 心肌细胞损伤的影响
与E 组比较,F 组凋亡率、Cleaved caspase⁃3、Bax 蛋白表达及IL⁃1β、IL⁃18mRNA 表达均升高(P<0.05)。见图3、表6。
表6 过表达NLRP3 对干扰EZH2 后高糖诱导H9c2 心肌细胞Cleaved caspase⁃3 和Bax 蛋白表达及凋亡率的影响()Table 6 Effect of overexpression of NLRP3 on the protein expression of cleared caspase⁃3 and Bax and apoptosis rate of H9c2 cardiomyocytes induced by high glucose after interference with EZH2()

表6 过表达NLRP3 对干扰EZH2 后高糖诱导H9c2 心肌细胞Cleaved caspase⁃3 和Bax 蛋白表达及凋亡率的影响()Table 6 Effect of overexpression of NLRP3 on the protein expression of cleared caspase⁃3 and Bax and apoptosis rate of H9c2 cardiomyocytes induced by high glucose after interference with EZH2()
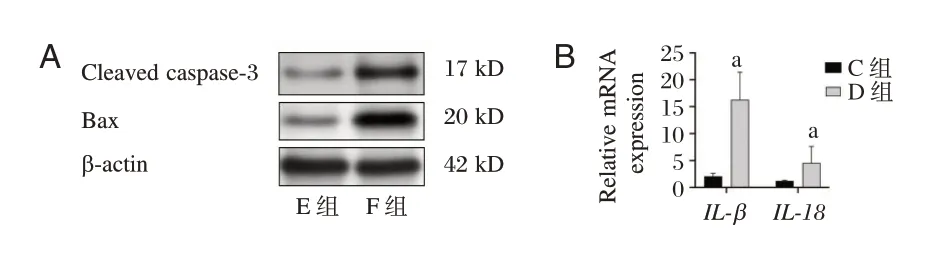
图3 过表达NLRP3 对干扰EZH2 后高糖诱导H9c2 心肌细胞Cleaved caspase⁃3 和Bax 蛋白表达及IL⁃1β、IL⁃18 mRNA 表达的影响Figure 3 Effect of overexpression of NLRP3 on the protein expression of Cleared caspase⁃3 and Bax and the mRNA expression of IL⁃1β and IL⁃18 in H9c2 cardiomyocytes induced by high glucose after interference with EZH2
3 讨论
持续高血糖状态会引起心肌细胞代谢紊乱、心脏自主神经的病变等,进而引起心肌炎,因此高血糖是导致心肌炎症的先决条件[7⁃8]。许多研究表明,在各种糖尿病小鼠模型中,组织细胞因子表达增加,进而诱导心肌细胞凋亡,提示炎症在DCM 的发生发展中起着重要作用[9]。本研究结果显示,在高糖环境下,H9c2 大鼠心肌细胞凋亡率、Cleaved caspase⁃3、Bax 蛋白表达和IL⁃1β、IL⁃18mRNA 表达水平上调,提示高血糖可以诱导心肌细胞发生凋亡和炎症反应,这与以往的研究结果相一致。
据报道,染色质中组蛋白的表观遗传转录后修饰障碍与DCM 有关[10],组蛋白甲基化是一种关键的翻译后修饰,可以调节心血管疾病,包括心脏炎症反应[11]。EZH2 是一种组蛋白甲基转移酶,通过其SET 结构域催化组蛋白H3 赖氨酸27 的三甲基化修饰(H3K27me3),从而来保持下游靶基因的沉默状态。在许多癌症中,EZH2 高表达且促进癌症发生和恶变。因此EZH2 成为抗癌药物的理想靶点[12]。一项研究发现,沉默EZH2 可改善db/db 小鼠和HG 培养小鼠心肌细胞的心脏功能和并防止心肌细胞凋亡[13]。一项研究表明,在大鼠和小鼠I 型糖尿病模型中,高糖通过EZH2 上调心肌成纤维细胞纤维化相关蛋白表达、心肌成纤维细胞分化、迁移和增殖,促进心肌纤维化[14]。这些研究结果表明,EZH2 与心脏炎症有关,并参与了DCM 的病程进展。
本研究结果表明,高糖诱导后,H9c2 心肌细胞中NLRP3 炎症小体蛋白表达增加,提示高糖能激活NLRP3 炎症小体,进而促进IL⁃1β 和IL⁃18 的表达和释放。在H9c2 细胞的体外研究表明,NLRP3炎症小体和IL⁃1βmRNA 表达增加遵循葡萄糖浓度依赖性模式,证实葡萄糖是NLRP3 炎症小体的有效激活剂[15],抑制H9c2 细胞中的NLRP3 表达,可使高糖状态下caspase⁃1 和IL⁃1β 的蛋白表达减少,降低细胞死亡率。
本研究结果表明,高糖诱导心肌细胞后,NLRP3 炎症小体表达增加,siRNA 沉默EZH2 可降低NLRP3 炎症小体蛋白表达,提示EZH2 可通过调节表观遗传修饰靶向调控NLRP3 炎症小体。EZH2 能够调控中性粒细胞和树突状细胞内整联蛋白信号途径和细胞黏附的动态变化。EZH2 缺失会损伤先天性粒细胞整联蛋白依赖性的跨内皮迁移,并且在多发性硬化动物模型中,EZH2 缺失会限制疾病进展。NLRP3 是介导动脉粥样硬化与炎症反应的桥梁,EZH2 能够对其进行甲基化阻断NLRP3 与相关蛋白的结合,进而促进黏附结构的改变。靶向阻断EZH2 与NLRP3 炎症小体因子的相互作用,能够消除NLRP3 炎症小体对心肌细胞损伤的诱导作用。进一步研究结果提示,siRNA沉默EZH2 的同时过表达NLRP3 蛋白可逆转干扰EZH2 减轻高糖诱导心肌细胞凋亡和炎症反应的影响,证实EZH2 通过调节表观遗传修饰促进NLRP3 炎症小体表达,从而介导高糖诱导心肌损伤的分子机制。
综上所述,高糖环境下EZH2 通过调节表观遗传修饰激活NLRP3 炎症小体,从而介导H9c2 心肌细胞损伤的调节作用机制,为寻找临床防治糖尿病心肌损伤提供新思路。
