灯盏花素联合低分子肝素钙治疗对进展性脑梗死ET⁃1、sTM 及CEC 水平变化的影响
2023-07-01张建丽张霞
张建丽 张霞
进展性脑梗死表现出的神经功能缺损后相对较轻,但会以阶梯状方式逐渐增加或加重,当病情呈持续性发展可导致严重神经功能缺损的脑梗死[1]。目前临床治疗进展性脑梗死的有效措施为溶栓、抗血小板聚集、抗凝治疗,但由于溶栓治疗时间窗极短,单独使用抗血小板聚集药物或抗凝药物对于阻止脑梗死的进展效果并不突出[2]。低分子肝素钙生物利用度较高,为临床常用的抗凝血药物,可抑制凝血因子表达,达到抗凝的作用[3]。灯盏花素具有抗凝和抗血栓的作用,能够改善微循环障碍,增加脑血流量,被广泛用于脑血管病的治疗[4]。本文研究将探讨灯盏花素联合低分子肝素钙治疗对进展性脑梗死患者内皮缩血管肽⁃1(Endothelin,ET⁃1)、循环内皮细胞(Circulating endothelial cells,CEC)、血栓调节蛋白(Soluble thrombomodulin,sTM)水平变化的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2019 年6 月至2021 年12 月期间于郑州大学第二附属医院南阳路院区就诊的123 例进展性脑梗死患者。纳入标准:①经头颅CT 或MIR 确诊为脑梗死[5],且发病12 h 后局灶神经功能缺失症状逐渐进展或呈阶梯式加重,发病时间均在72 h以内。②临床资料完整者;③无凝血功能障碍者。排除标准:①严重肝肾功能异常者;②神经功能缺损者;③颅内出血者。
遵医嘱根据治疗方式将其分为对照组(61 例,低分子肝素钙治疗)和观察组(62 例,灯盏花素联合低分子肝素钙),其中对照组男31 例,女30 例,年龄51~82 岁,平均年龄为(67.75±4.34)岁。观察组男32 例,女30 例,年龄51~81 岁,平均年龄为(67.12±4.28)岁。两组一般资料比较差异无统计学意义(P>0.05)。本研究经院医学伦理委员会批准通过,受试者家属已签署知情同意书。
1.2 方法
入院后,两组患者立即完善相关检查以明确进展性脑梗死诊断,根据病情需要选用脑细胞保护剂、控制血压和改善脑循环等基础治疗。
对照组在基础治疗上同时皮下注射低分子肝素钙注射液(深圳赛保尔生物药业有限公司,国药准字H20060191,规格:0.5 mL),0.5 mg/次,1 次/d,以7 d 为1 疗程,连续治疗2 个疗程。
观察组在对照组治疗基础上采用灯盏花素注射液(哈尔滨圣泰生物制药有限公司,国药准字Z23020817,规格:2 mL:5 mg)50 mg+0.9%生理盐水注射液250 mg 静脉滴注,1 次/d,以7 d 为1 疗程,连续治疗2 个疗程。
1.3 观察指标
①临床疗效[6]:判定标准:症状及体征均恢复,病残程度0 级为基本痊愈;症状及体征均显著改善,病残程度1~3 级为显著进步;症状及体征均改善为进步;症状及体征无明显改变为无变化;症状及体征加重为恶化。②于治疗前、治疗14 d 分别采取早晨空腹静脉血5 mL,使用离心机以离心半径为8 cm,3 000 r/min 分离血清,10 min 后取出。采用放射免疫分析法测定ET⁃1 水平,试剂盒购自武汉博士德生物工程有限公司,采用流式细胞仪(美国Beckman⁃Coulter 公司,型号:EPICS⁃XL II MCL)测定每0.9 μL CEC 计数,采用ELISA 法检测sTM 水平,检测方法严格按照试剂盒说明书进行。③观察两组治疗前、治疗14 d 后的美国国立卫生院卒中量表(Nation⁃al Institute of Health Stroke Scale,NIHSS)[7]和日常生活活动能力(Activities of daily living,ADL)[8]。④不良反应包括:头痛、皮疹、胃肠道反应。
1.4 统计学方法
采用SPSS 22.0 统计软件包处理,计量资料以()表示,行t检验;计数资料以n(%)进行描述,行χ2检验;以P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组临床疗效比较
观察组治疗总有效率为96.77%,明显高于对照组的73.77%,差异有统计学意义(P<0.05)。见表1。

表1 两组临床疗效比较[n(%)]Table 1 comparison of clinical efficacy between the two groups[n(%)]
2.2 两组血清ET⁃1、sTM 及CEC 水平比较
治疗后,两组血清ET⁃1、sTM 及CEC 水平均低于治疗前,且观察组血清ET⁃1、sTM 及CEC水平低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组血清ET⁃1、sTM 及CEC 水平比较()Table 2 comparison of serum ET⁃1,sTM and CEC levels between the two groups()
注:与同组治疗前比较,aP<0.05。
2.3 两组NIHSS 评分和ADL 评分比较
治疗后,两组NIHSS 评分低于治疗前、ADL 评分高于治疗前,且观察组NIHSS 评分低于对照组、ADL 评分均高于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组NIHSS 评分和ADL 评分比较(分,)Table 3 Comparison of NIHSS score and ADL score between the two groups(score,)
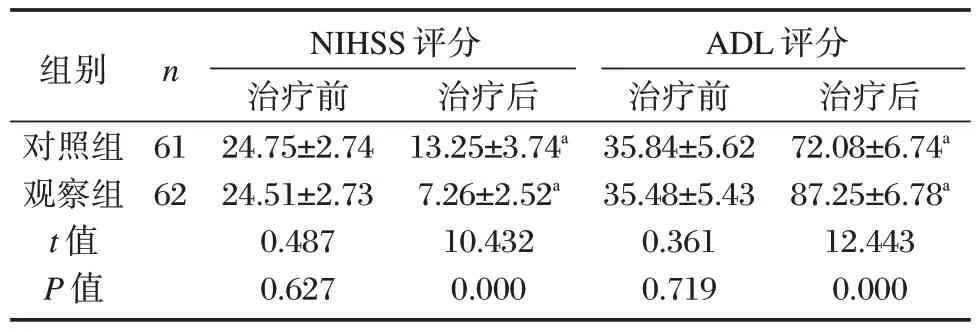
表3 两组NIHSS 评分和ADL 评分比较(分,)Table 3 Comparison of NIHSS score and ADL score between the two groups(score,)
注:与同组治疗前比较,aP<0.05。
2.4 两组不良反应比较
对照组不良反应发生率为6.56%,观察组不良反应发生率为9.68%,两组不良反应比较差异无统计学意义(P>0.05)。见表4。

表4 两组不良反应比较[n(%)]Table 4 Comparison of adverse reactions between the two groups[n(%)]
3 讨论
进展性脑梗死可出现动脉粥样硬化或动脉炎合并动脉痉挛或血液中凝血因子变化,在发病6 h至数周神经功能缺损程度呈阶梯式或进行性加重[9]。可对血栓扩展、脑水肿、再灌注损伤等方面进行相关治疗,降低危险因素,联合有效的抗凝、抗栓、降纤以及脑保护类药物控制进展性脑梗死的恶化[10]。
近年来,随着医学技术的不断发展,越来越多的研究证明使用抗凝治疗可以防止梗死扩大[11]。低分子量肝素钙对血浆蛋白的非特异性结合力低,具有分子量小、易吸收、生物利用度高、剂量效应可预测等优点,可促进纤溶,增强血管内皮细胞的抗血栓作用和抑制凝血过程,可作为治疗脑梗死的理想药物[12]。灯盏花素能改善脑微循环,增加脑血流量,提高血脑屏障的通透性,有显著的抗血小板聚集作用,还有较强的抑制血管内凝血和促进纤溶活性功能,从而使血浆黏度降低,改善梗死区血流供应,有利于梗死区的功能恢复[13]。
张素真等[14]报道,sMT 作为血栓调节蛋白,是一种重要的抗凝辅助因子,可作为血栓形成的评价指标,是血管内皮细胞损伤的特异性标志物,在内皮损伤疾病中,可以检测到sMT 升高。CEC 可从患者生理或病理情况下从循环血中获取,当患者处于生理情况下,外周血中存在定量CEC,当处于病理状态下,CEC 数量明显升高,CEC 为目前能够在活体中直接反映血管内皮损伤的标记物。ET⁃1 具有较强的血管收缩作用,与血管平滑肌细胞上的受体结合,可调节血管紧张度使血管收缩,当ET⁃1 合成或释放增加,可引起各项组织器官的损害。本研究结果显示,经治疗后,观察组血清ET⁃1、sTM 及CEC 水平低于对照组,且能将临床疗效由70%左右提升至90%以上,说明灯盏花素联合低分子肝素钙能够减少血管内皮损伤,减轻患者血管收缩现象,与刘丹丹等[15]研究结果相似。其原因可能与低分子肝素钙能减少脑组织内氧自由基的生成,改善血液粘稠度,促进血液流动,加速膜结合物质释放,从而保护脑组织和脑神经元;灯盏花素能够抑制脂质过氧化反应,具有舒张脑血管,降低脑血管阻力,增加脑血流量,减轻自由基对脑组织损害减轻脑细胞水肿有关。其中肝素钙与灯盏花素的作用机制相似,可将其进行叠加治疗,增强临床疗效。另一方面发现,观察组NIHSS 评分低于对照组、ADL 评分均高于对照组,提示灯盏花素联合低分子肝素钙能够恢复进展性脑梗死患者的神经功能,改善患者日常生活能力,与李凤等[16]研究结果相一致。且在治疗期间患者头痛、皮疹、胃肠道反应等不良反应发生率较低,以上两种药物联用具有较高的安全性。
综上所述,进展行脑梗死患者使用灯盏花素联合低分子肝素钙治疗能降低脑血管ET⁃1、sTM及CEC 水平,改善患者神经功能及日常生活能力,且具有较高的安全性,值得临床广泛应用。
