RasGRF1 在乳腺癌中的表达及其临床意义
2023-06-30高漫芝马勇杰
高漫芝,马勇杰
(天津医科大学肿瘤医院肿瘤细胞生物学实验室,国家恶性肿瘤临床医学研究中心,天津市恶性肿瘤临床医学研究中心,乳腺癌防治教育部重点实验室,天津市“肿瘤防治”重点实验室,天津 300060)
乳腺癌是女性最常见的恶性肿瘤之一。虽然在过去的几年里,乳腺癌的诊断和治疗取得了显著进展,但由于高复发和转移发生率,其死亡率仍然很高[1]。早期诊断、早期治疗对于乳腺癌的预后至关重要,准确的生物标志物可有助于早期诊断和指导治疗。
RasGRF1 是Ras 的鸟嘌呤核苷酸交换因子(RasGRF)家族的一员,是哺乳动物Ras GTPases 的鸟苷酸交换因子,在小鼠中具有父系印迹[2]。全长RasGRF1 蛋白包含多个结构域:pleckstrin 同源结构域、1 个coil -coil 区域、1 个钙调素依赖激活结构域、ilimaquinon 基序、1 个DBL 同源结构域和1 个CDC25 结构域[3-4]。RasGRF1 可以通过促进Ras 与GDP 解离以及Ras 与GTP 的结合来激活Ras,Ras蛋白在某些细胞类型的增殖、存活和分化中发挥关键作用[5]。Ras 蛋白可充当分子开关,在GTP 结合的活性状态和GDP 结合的非活性状态之间循环,Ras蛋白和GTP 结合且持续处于活化状态,可与下游的效应蛋白结合产生第二信使,使细胞增殖失去控制,同时细胞凋亡减少,导致细胞恶性转化[6]。现有研究表明,RasGRF1 是一种多结构域蛋白,能够调节肿瘤细胞生物学行为,参与肿瘤进展[7]。例如在星形细胞瘤中RasGRF1 的敲降可以抑制肿瘤细胞的增殖并促进肿瘤细胞的凋亡[8];在胶质瘤细胞和肺癌细胞中RasGRF1 可以通过提高Ras 的活性,促进肿瘤细胞的生长[9-10]。但是RasGRF1 在乳腺癌的发生以及发展中的作用鲜有报道,本研究分析RasGRF1表达与乳腺癌患者临床病理特征和生存预后之间的关系,为寻找乳腺癌患者预后的生物标志物奠定科学基础。
1 材料与方法
1.1 免疫组织化学染色 选取天津医科大学肿瘤医院收治的术前未接受放化疗等抗肿瘤治疗的乳腺癌患者石蜡标本,将石蜡标本切为厚度为4 μm左右的切片,固定于防脱片载玻片上,进行组织化学染色:(1)脱蜡复水:在多次二甲苯及不同浓度乙醇中浸泡。(2)将脱蜡复水后的切片置于清水中轻柔洗涤3 次,每次5 min。(3)抗原热修复:柠檬酸盐溶液煮沸后,将组织切片置于高压锅中加热加压2.5 min,目的是破坏组织上的抗原因甲醛浸泡而形成醛键。(4)热修复后使用清水洗涤组织切片3次,每次5 min。(5)封闭:使用3%H2O2封闭组织切片上的过氧化物酶,室温静置25 min。封闭结束后用清水轻柔洗涤多次,最后1 次用PBS 工作液洗涤;再使用山羊血清室温封闭25 min。(6)一抗孵育:弃去血清封闭液后,滴加使用一抗稀释液稀释的RasGRF1 抗体(1∶50,Abcam,Ab-111830),将切片置于湿盒中,4℃过夜孵育,再复温50 min,弃去抗体,清洗3 次。(7)二抗孵育:滴加的二抗,置于湿盒中,室温孵育20 min。弃去二抗,清洗3 次。(8)滴加链霉亲和素连接的辣根过氧化物酶溶液,37℃孵育20 min。(9)显色:用现配制的DAB 溶液显色,在显微镜下实时控制显色状态,所有切片显色时长均为3.5 min。(10)使用苏木精复染5 min,盐酸酒精分化1 s,于1%氨水中返蓝约3 s,晾干后使用中性树胶封片,莱卡万能正置显微镜观察评分。
1.2 Western 印迹检测 弃除细胞培养液后用PBS冲洗细胞,弃除PBS 后加裂解液裂解蛋白,测定浓度后进行SDS-PAGE 变性电泳,结束后将蛋白转到硝酸纤维素膜上,使用5%的脱脂奶粉室温封闭1 h,加入一抗(β-actin:稀释比例:1∶5 000;RasGRF1:稀释比例:1∶500)4℃过夜孵育。结束后用TBST 洗膜3次,然后避光加入二抗(稀释比例:1∶8 000),室温孵育50 min。孵育完成后用TBST 洗膜,结束后使用双色红外激光成像系统进行曝光。
1.3 TCGA 和GEO 的临床资料分析 大标本的浸润性乳腺癌组织与正常组织的临床信息来源于癌症和肿瘤基因图谱网站(TCGA,http://tcga-data.nci.nih.gov/)。从网站提取乳腺浸润癌和GTEx 中对应的正常组织数据,其中浸润性乳腺癌组织1 099 例,乳腺正常组织292 例;浸润性乳腺癌组织与配对癌旁组织的临床信息来自于TCGA 数据库,包括112 对浸润性乳腺癌组织与配对癌旁组织,将TPM(transcripts per million reads)格式的RNAseq 数据进行log2 转化后进行样本间的表达比较。其次,在GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中下载GSE25066 的表达数据,共508 例乳腺癌患者样本,并使用singerBox 中GEO ID 转换器提取RasGRF1基因表达信息和患者的临床信息,包括年龄(>50,n=231;≤50,n=277)、TNM 分期(T0~T2,n=288;T3、T4,n=220)、淋巴结状态(N0、N1,n=401;N2、N3,n=107)、雌激素受体(ER)状态、病理分期以及预后情况等。单因素多因素Cox 回归分析使用IBM SPSS Statistics 25 进行分析。
1.4 TIMER 的临床资料分析 TIMER(https://cistrome.shinyapps.io/timer/)中包括32 种肿瘤类型[11]。选取该数据的差异基因表达(Diff Exp)模块,Ras GRF1 在32 种肿瘤类型中的基因表达水平分布采用箱线图显示,差异表达采用Wilcoxon 检验评估差异有统计学意义。
1.5 DriverDBv3 的临床资料分析 选择DriverDBv3 (http://driverdb.tms.cmu.edu.tw/)[12]“Gene”和“survival”模块,分析RasGRF1 在肿瘤中的表达,及其对患者预后的影响,包括五年生存率、总生存期(OS)、无病期(DFI)、无进展期(PFI)和疾病特异性生存期(DSS)。以各组数据的平均值为cut off值,其中OS 和PFI 中高表达RasGRF1 有227 例,低表达RasGRF1 有849 例;其中DFI 中高表达RasGRF1 有194 例,低表达RasGRF1 有742 例;其中DSS 中高表达RasGRF1 有222 例,低表达Ras-GRF1 有835 例。
1.6 bc-GenExMiner 的临床资料分析 选取bc-GenExMiner(http://bcgenex.ico.unicancer.fr/BC-GEM/GEM-Accueil.php)[13]的SCAN-B 数据,用于分析RasGRF1 在乳腺癌中表达情况。分析RasGRF1 在不同类型的乳腺癌患者中的表达情况:病例样本为4 421 例,具有淋巴结转移情况数据的有3 870 例,具有阳性和阴性受体免疫组织化学状态包括:ER、孕激素受体(PR)、人体表皮生长因子2(HER2)和ER/PR 组合的病例3 666 例。分析RasGRF1 对乳腺癌患者的生存情况:淋巴结转移(n=1 167)、无淋巴结转移(n=2 013)、ER+(n=2 832)、ER-(n=241)、PR+(n=2 554)、PR-(n=386)、ER+/PR+(n=2 520)、ER-/PR+(n=29)、ER+/PR-(n=175)、ER-/PR-(n=211)。
1.7 统计学处理 采用Wilcoxon 检验分析比较RasGRF1 在正常乳腺组织和乳腺癌组织中的表达水平;采用Log-rank 检验计算高低表达水平,|log2|<-1 表示差异具有统计学意义,Kaplan-Meier生存分析法判断RasGRF1 表达水平与乳腺癌患者预后的关系;使用Pearson 统计学方法分析ER-/PR-乳腺癌中与RasGRF1 表达相关的miRNA。
2 结果
2.1 免疫组织化学染色检测 RasGRF1 在乳腺癌中的表达结果显示,RasGRF1 蛋白在乳腺癌组织中主要为胞浆和胞膜表达,细胞核中几乎没有表达(图1)。

图1 RasGRF1 在乳腺癌组织中免疫组化染色结果Fig 1 Immunohistochemical staining of RasGRF1 in breast cancer tissues
2.2 浸润性乳腺癌和正常组织中RasGRF1 的差异表达 TIMER 数据库分析结果显示RasGRF1 在多种肿瘤中具有差异表达,与乳腺正常组织相比,RasGRF1 在乳腺癌组织中高表达(P<0.05,图2A);在TCGA 和GTEx 数据库联合分析得到同样的结果(P<0.000 1,图2B),并且生信分析和Western 印迹验证表明RasGRF1 在乳腺癌组织中表达水平高于其配对癌旁组织(图2C、2D)。

图2 RasGRF1 mRNA 在乳腺癌组织和正常组织中的表达情况Fig 2 Expression of RasGRF1 mRNA in breast cancer tissues and normal tissues
2.3 RasGRF1 对乳腺癌患者预后的影响 结果显示,在乳腺癌中,与RasGRF1 低表达组相比,Ras-GRF1 高表达乳腺癌患者OS(HR=2.04,P=0.000 677)(图3A)、DFI(HR=1.77,P=0.023 5)(图3B)、PFI(HR=1.85,P=0.001 36)(图3C)和DSS(HR=2.83,P=3.23e-05)(图3D)较差。进一步通过单因素和多因素Cox 回归分析GSE25066 数据发现,RasGRF1可作为乳腺癌患者的独立预后因子(表1)。
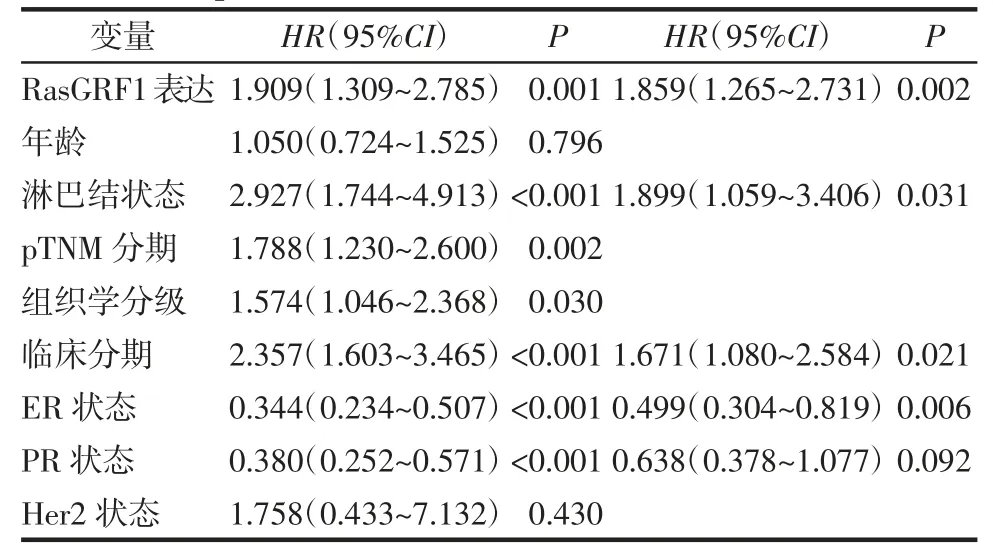
表1 508 例患者预后的单因素和多因素分析Tab 1 Univariate and multivariate analysis of the prognosis of 1 508 patients
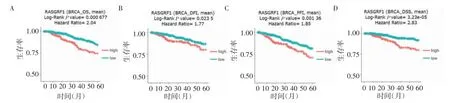
图3 RasGRF1 mRNA 表达水平与乳腺癌患者预后的关系Fig 3 Relationship between expression of RasGRF1 mRNA and prognosis in breast cancer patients
2.4 RasGRF1 在不同ER/PR 状态的乳腺癌中的表达以及与患者预后的关系 在bc-GenExMiner 数据中,分析RasGRF1 表达和乳腺癌患者激素水平以及淋巴结状态的关系发现:与无淋巴结转移的乳腺癌组织相比,RasGRF1 在淋巴结转移的乳腺癌组织中高表达(图4A,P<0.000 3),并且在有淋巴结转移的乳腺癌组织中,与RasGRF1 低表达组相比,RasGRF1高表达患者具有较差的OS(HR=1.86,95%CI:1.34~2.57,P=0.000 2)(图4C),RasGRF1 表达对无淋巴结转移的乳腺癌患者预后无显著影响(HR=0.94,95%CI:0.69~1.28,P=0.688 9)(图4B);分析乳腺癌患者ER 状态时发现:与ER+的乳腺癌组织相比,Ra sGRF1 在ER-的乳腺癌组织中高表达(图4D,P<0.000 1),但是RasGRF1 表达对单独ER+或者ER-的乳腺癌患者的预后无显著影响(图4E、4F);分析乳腺癌患者PR 状态时发现:与PR+的乳腺癌组织相比,RasGRF1 在PR-的乳腺癌组织中高表达(4G,P<0.000 1),并且在PR-的乳腺癌中,与Ras-GRF1 低表达组相比,RasGRF1 高表达患者具有较差OS 的趋势(HR=1.66,95%CI:0.99~2.79,P=0.056 3)(图4I),RasGRF1 表达对PR+乳腺癌患者预后无显著影响(HR=0.90,95%CI:0.68~1.18,P=0.444 8)(图4H)。
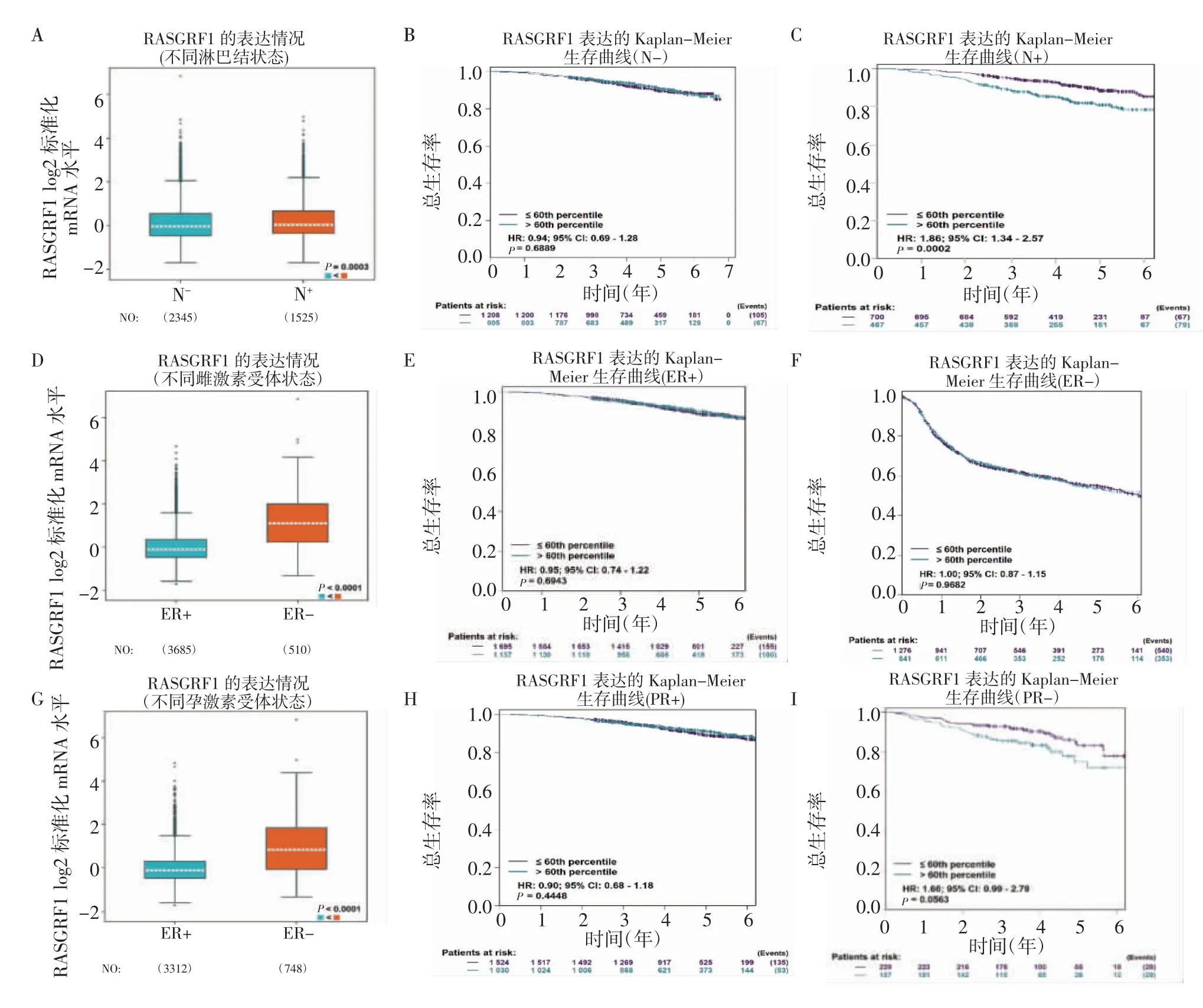
图4 bc-GenExMiner 数据分析RasGRF1 在不同分型乳腺癌患者中的表达及其与预后的关系Fig 4 Analysis of RasGRF1 expression in different types of breast cancer patients and its relationship with prognosis by using bc-GenExMiner data
进一步在bc-GenExMiner 数据中联合分析RasGRF1 在不同ER/PR 状态的乳腺癌中的表达以及与患者预后的关系,结果表明,与ER+/PR+、ER+/PR-、ER-/PR+类型的乳腺癌组织相比,RasGRF1 在ER-/PR-类型乳腺癌组织中表达最高,在ER+/PR+的乳腺癌中表达最低(图5A,P<0.000 1)。同时分析生存数据结果显示,在乳腺癌组织中,RasGRF1 高表达的乳腺癌患者具有较差的OS(HR=1.29,95%CI:1.04 ~1.6,P=0.019)(图5B);RasGRF1 表达对ER+/PR+(HR=0.85,95%CI:0.64~1.12,P=0.252 9)(图5C)、ER+/PR-(HR=1.37,95%CI:0.63~2.96,P=0.427 6)(图5D)、ER-/PR+(HR=0.65,95%CI:0.06~7.18,P=0.725 2)(图5E)类型的乳腺癌患者预后无显著影响。在ER-/PR-类型乳腺癌患者中,Ras-GRF1 高表达患者具有较差的OS(HR=2.05,95%CI:1.01~4.19,P=0.048 4)(图5F)。
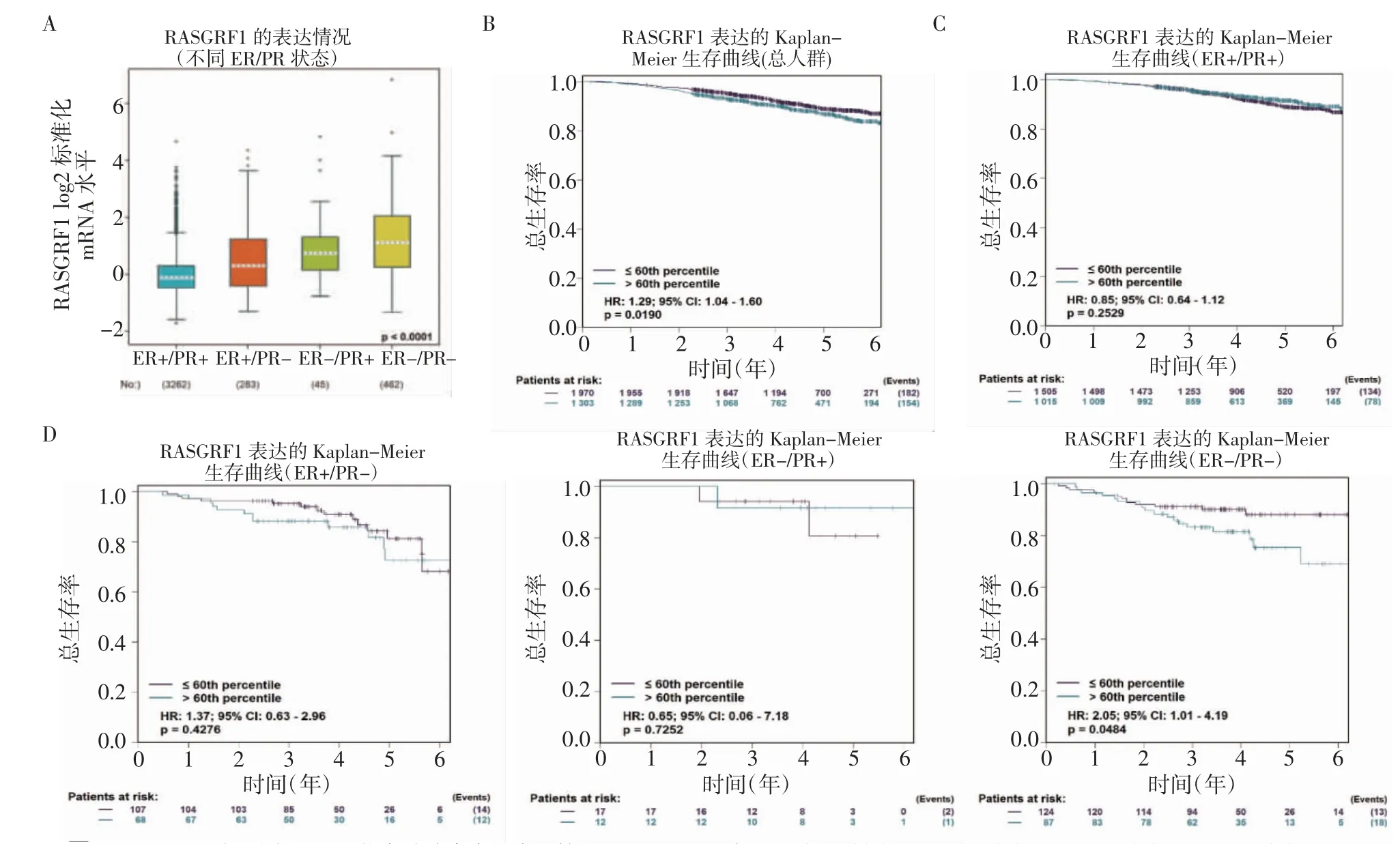
图5 bc-GenExMiner 数据分析RasGRF1 在ER/PR 状态的乳腺癌患者中的表达及其与预后的关系Fig 5 Analysis of RasGRF1 expression and its relationship with prognosis in breast cancer patients with ER/PR status by using bc-GenExMiner data
2.5 RasGRF1 影响PR-和ER-/PR-类型乳腺癌患者预后的分子机制 图6A 为ER-乳腺癌中与Ras-GRF1 表达相关的基因火山图,进一步筛选与Ras-GRF1 表达高度相关的基因进行KEGG 富集分析发现:多数基因参与细胞黏附信号通路(图6B)。同样,在ER-/PR-型乳腺癌分析发现,多数基因参与辅助性T 细胞(Th)1 和Th2 细胞分化的通路(图6C、6D)。
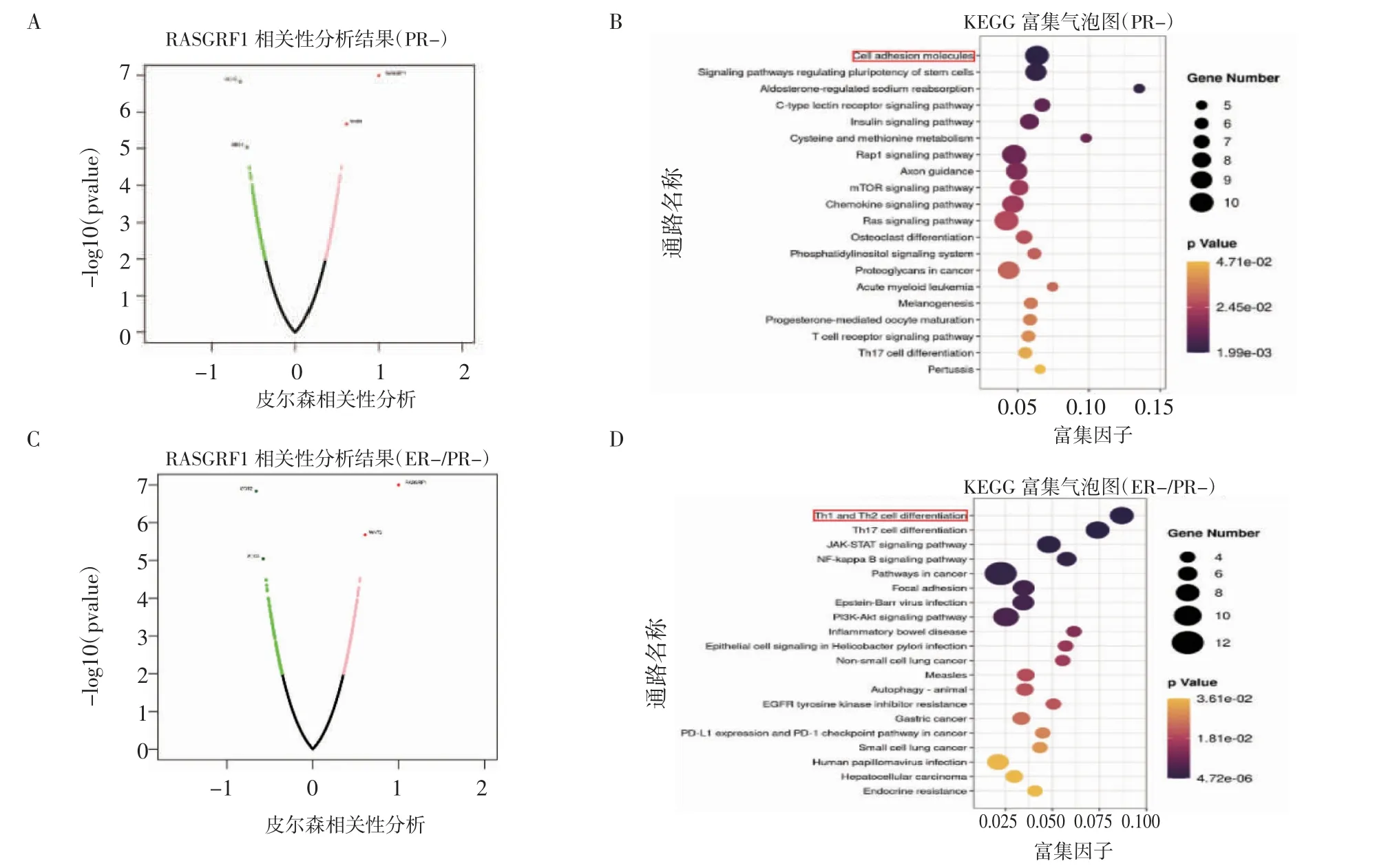
图6 乳腺癌中与RasGRF1 表达相关的基因分析Fig 6 Analysis of genes associated with RasGRF1 expression in breast cancer
2.6 在ER-/PR-类型的乳腺癌中筛选调控 Ras-GRF1 表达的miRNA 在LinkedOmics 数据资料中,选择PR-和ER-/PR-类型的乳腺癌,分析该类型的乳腺癌中与RasGRF1 表达相关的miRNA,图7A 是与RasGRF1 呈正相关的前50 个基因,其中,hsa-mir-769 和RasGRF1 相关性最强(图7B,P=1.348e-04,RS=0.659 50)。

图7 分析ER-/PR-乳腺癌中与RasGRF1 表达相关的miRNAFig 7 Analysis of miRNA associated with RasGRF1 expression in ER-/PR-breast cancers
3 讨论
研究显示,RasGRF1 可以通过促进Ras 与GDP释解离以及Ras 与GTP 的结合来激活Ras[5]。Ras蛋白在某些细胞的增殖、存活和分化中发挥关键作用[4-5]。且参与并促进多种肿瘤进展[8-10,14-15]。
笔者通过免疫组织化学染色首先明确Ras-GRF1 在乳腺癌组织中主要为胞浆和胞膜表达,然后基于TIMER 数据库和TCGA 数据库分析发现:相较于正常乳腺组织,乳腺癌组织中RasGRF1 表达水平明显升高。并且进一步的预后分析结果显示:与正常乳腺组织相比,RasGRF1 在乳腺癌组织中高表达,且乳腺癌组织中RasGRF1 高表达的患者预后更差,同时单因素和多因素Cox 回归分析发现Ras-GRF1 可作为乳腺癌患者预后的独立预测因子。这一点与既往研究报道的RasGRF1 在星形细胞瘤、胶质瘤瘤和结直肠癌等恶性肿瘤中的表达与患者的预后呈负相关是一致的[8-9]。
乳腺癌治疗和预后主要受激素受体和人表皮生长因子2(HER2)的影响[16]。不同ER 和PR 状态对乳腺癌患者预后影响不同[17-19]。因此,准确定义不同类型的乳腺癌生物标志物对于精准治疗至关重要。同时笔者还发现:与淋巴结阴性的乳腺癌组织相比,RasGRF1 在淋巴结阳性的乳腺癌组织中高表达,并且在淋巴结阳性的乳腺癌中,RasGRF1 高表达患者预后较差;与ER+的乳腺癌组织相比,Ras-GRF1 在ER-的乳腺癌组织中高表达,但是Ras-GRF1 表达对ER+或者ER-的乳腺癌患者的预后无显著影响;与PR+的乳腺癌组织相比,RasGRF1 在PR-的乳腺癌组织中高表达,并且在PR-的乳腺癌中,RasGRF1 高表达具有较差预后的趋势。联合分析RasGRF1 在不同ER/PR 状态乳腺癌中的表达发现:RasGRF1 在ER-/PR-的乳腺癌中高表达,并且高表达者预后差。综上所述,RasGRF1 表达可能是影响PR-和ER-/PR-乳腺癌进展的关键因素。
进一步研究发现,在ER-和ER-/PR-型乳腺癌中RasGRF1 可能分别通过调控细胞黏附和Th1/Th2 细胞分化来影响乳腺癌患者生存。在ER-/PR-乳腺癌中hsa-mir-769 可能是调控RasGRF1 表达的microRNA。先前的研究表明,hsa-mir-769-5p 可以促进多个肿瘤的发生和进展,例如在食管癌、肝癌、骨肉瘤和胶质瘤中高表达,且hsa-mir-769-5p高表达的患者预后差[20-23]。在肝癌、骨肉瘤和胶质瘤中hsa-mir-769-5p 通过促进肿瘤细胞增殖和迁移促进肿瘤进展[21-23]。同时,hsa-mir-769 在黑色素瘤中高表达,并且促进黑色素瘤细胞增殖[24],但hsamir-769 在乳腺癌中作用和机制尚无报道,需进一步研究。
综上所述,本研究通过分析RasGRF1 表达与乳腺癌患者临床病理特征和生存预后之间的关系,为寻找乳腺癌患者预后的生物标志物奠定了科学基础。
