芹菜素对化学法氧糖剥夺/复氧复糖损伤大鼠心肌细胞保护作用研究
2023-06-30禹博祁琳金鑫曹清文田晨李佳颖王越周建妹陈康寅
禹博,祁琳,金鑫,曹清文,田晨,李佳颖,王越,周建妹,陈康寅
(1.天津医科大学第二医院心脏科,天津市心血管病离子与分子机能重点实验室,天津心脏病学研究所,天津 300211;2.武警特色医学中心药剂科,天津 300162;3.武警后勤学院军事药学教研室,天津 300309;4.天津中医药大学中西医结合学院,天津 301617;5.浙江医院干部保健科,杭州 310013)
中国心血管疾病患病率处于持续上升阶段,急性心肌梗死的死亡率于2002—2018 年总体呈上升态势[1]。急性心肌梗死后,通过溶栓或经皮冠状动脉介入治疗及早恢复心肌灌注是减少心肌梗死面积、改善临床预后最有效地方法。但恢复血供又可能造成心肌顿抑、无复流,甚至心肌损伤加重的现象,即心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI),成为再灌注疗法获益的主要障碍。MIRI 主要涉及氧化应激、线粒体损伤、凋亡、自噬等机制[2-5],目前MIRI 发生机制尚不完全清楚,缺少疗效确切的预防及治疗药物[6]。因此,进一步探讨MIRI 的机制,寻找安全有效的治疗药物,仍有重要的现实意义。
芹菜素是一种广泛存在于自然界的黄酮类化合物。作为一种脂溶性还原剂,其可在治疗帕金森病、脑缺血再灌注损伤、肿瘤等多种疾病中发挥重要作用[7-9]。研究表明,芹菜素可通过抑制p38 丝裂原活化蛋白激酶(p38MAPKs)信号通路减轻大鼠离体心肌缺血再灌注损伤,也可通过上调Janus 激酶2(JAK2)-信号传导与转录激活因子3(STAT3)和磷脂酰肌醇3 激酶(PI3K)/蛋白激酶B(AKT)信号通路在物理缺氧诱导的氧糖剥夺/复氧复糖(oxygen-glucose deprivation/restoration,OGD/R) 损伤中发挥保护作用[10-12]。但目前尚无关于芹菜素对MIRI中自噬作用的报道。利用化学性缺氧模拟剂氯化钴(cobalt chloride,CoCl2)构建OGD/R 模型[13],相比物理缺氧,无需专门低氧培养设备,具有操作更方便,缺氧效果稳定等特点。因此,本研究利用氯化钴建立H9c2 细胞的OGD/R 模型,初步探讨芹菜素对H9c2细胞OGD/R 损伤的影响,并探讨其调节凋亡和自噬相关分子机制,为进一步研究芹菜素抗MIRI 提供实验依据和理论基础。
1 材料与方法
1.1 实验材料 大鼠H9c2 心肌细胞(购自中国科学院细胞库);胎牛血清、DMEM 高糖培养基和0.25%胰蛋白酶(Gibco,Waltham,MA);DMEM 无糖培养基、PBS 缓冲液、CoCl2粉剂、MTT、PMSF 抑制蛋白降解液和二抗(北京索莱宝科技有限公司);芹菜素(上海源叶生物科技有限公司);RIPA 裂解液(康为世纪生物科技有限公司);BCA 蛋白浓度测定试剂盒(碧云天生物技术有限公司);5×蛋白上样缓冲液(北京鼎国昌盛生物技术有限责任公司);PVDF膜(密理博科技有限公司);HIF-1α 抗体、β-actin抗体及超敏ECL 发光液(Affinity Biosciences 公司);SIRT-1、p62、LC3A/B、Bax、Bcl-2 抗体(ABclonal 公司);LDH 测定试剂盒、SOD 测定试剂盒(南京建成生物工程研究所);Caspase-3 ELISA 检测试剂盒(伊特生命科学研发有限公司)。
1.2 细胞培养及分组 处理大鼠H9c2 心肌细胞在含有10%FBS、100 U/mL 青霉素/100 μg/mL 链霉素的DMEM 高糖培养基中,置于37℃,5%CO2培养箱中培养,实验使用的细胞均处于对数生长期。实验分3 部分:(1)模拟1%低氧等效CoCl2浓度确定实验:分为①对照组;②1%O2组;③CoCl2(0.1~1.2 mmol/L)组。1%O2组是将细胞在三气培养箱(1%O2、5% CO2、94% N2)中用含1%FBS 的DMEM 高糖培养基培养24 h,CoCl2组是用不同浓度CoCl2处理并在含1%FBS 的DMEM 高糖培养基培养24 h。(2)模拟1%O2OGD/R 模型等效CoCl2浓度确定实验:分为①对照组;②1%O2组;③CoCl2(0.6 和0.8 mmol/L)组。根据第一部分实验结果确定的CoCl2浓度处理细胞,1%O2组是将细胞置于三气培养箱中用含1%FBS 的DMEM 无糖培养基培养16 h 后,置于正常条件(复氧复糖)培养4 h;CoCl2组将细胞用0.6 和0.8 mmol/L CoCl2处理并在含1%FBS 的DMEM 无糖培养基培养16 h 后,置于正常条件培养4 h。(3)芹菜素对H9c2 细胞OGD/R 作用的影响:①对照组;②OGD/R 组(CoCl2浓度为0.8 mmol/L);③OGD/R+芹菜素组。不同浓度芹菜素预处理24 h。
1.3 细胞活力测定 将H9c2 细胞根据实验分组以8×103个/孔的密度接种于96 孔板,培养24 h 后用含1%FBS 的DMEM 高糖培养基同步化24 h,然后根据实验分组处理细胞。结束培养前4 h,弃去上清,避光加入100 μL/孔MTT(0.5 mg/mL,PBS 配制),作用4 h 后弃上清,加入100 μL/孔DMSO,充分震荡,492 nm 处测定每孔吸光度值。细胞活力计算公式:细胞活力(%)=(实验组吸光度值/对照组吸光度值)×100%。每组设5 个复孔。
1.4 蛋白提取和Western 印迹 按照实验分组,将H9c2 细胞以2×105个/孔的密度接种于6 孔板中,培养24 h 后用含1%FBS 的DMEM 高糖培养基同步化24 h,然后根据实验分组处理细胞。弃去培养液,用PBS 清洗细胞2 遍,每孔加入适量含有1%PMSF 的RIPA 裂解液提取蛋白并用BCA 蛋白定量试剂盒测定蛋白浓度。蛋白变性后,以每泳道20 μg的蛋白上样量用10% SDS-PAGE 凝胶进行电泳、转膜,TBST 洗膜3 次,每次10 min,使用5%脱脂牛奶阻断非特异性蛋白结合,TBST 洗膜3 次,每次10 min,4℃下孵育一抗(1∶500 稀释)过夜。次日,吸出一抗,TBST 洗膜3 次,每次10 min,HRP 结合二抗(1∶10 000)室温孵育1 h,TBST 洗膜3 次后,ECL 化学发光试剂盒显色,采用Image J 软件对蛋白条带的光密度值进行分析。
1.5 细胞caspase-3 含量测定 将H9c2 细胞以2×105个/孔的密度接种于6 孔板中,依据实验分组处理细胞并收集细胞,在细胞沉淀中加入约0.4 mL 的PBS,混匀,在冰水浴中进行超声破碎细胞,使细胞内蛋白充分释放,4℃3 000 r/min 离心10 min 得到样品,用BCA 蛋白定量试剂盒测定蛋白浓度。设置空白孔、标准品孔及样本孔,根据ELISA 试剂盒操作说明加入试剂及待检样本,覆膜,37℃温育1 h;洗涤,加入底物,37℃温育15 min;加入终止液,在450 nm 波长处测定各孔的OD 值,绘制标准曲线,并计算细胞的caspase-3 浓度。
1.6 细胞SOD 含量测定 细胞分组和处理同1.5,设置对照孔、对照空白孔、样品孔及样品空白孔,根据SOD 试剂盒操作说明书加入相关试剂,混匀后37℃温育20 min,在450 nm 波长处测定各孔的OD值,根据说明书计算SOD 含量。
1.7 细胞外液LDH 水平测定 将H9c2 细胞以2×105个/孔的密度接种于6 孔板中,依据实验分组处理细胞后收集各自的培养液上清。设置空白孔、标准孔、测定孔及对照孔,根据LDH 试剂盒说明书加入相关试剂并依次37℃温育后加入终止液后,在450 nm 波长处测定各孔的OD 值,根据说明书计算LDH 漏出量。
1.8 统计学处理 应用Graph Pad Prism 9.0 软件进行数据处理及作图,计量资料中符合正态分布资料以±s 表示,多组间比较采用单因素方差分析,多组内两两比较采用SNK 法,P<0.05 为差异有统计学意义。
2 结果
2.1 模拟1%O2的等效CoCl2浓度 结果图1a 所示,与对照组相比,1%O2及CoCl2(0.4~1.2 mmol/L)组细胞活力均明显降低(P<0.05);与1%O2组相比,CoCl2(0.5~0.8 mmol/L)组细胞活力降低程度无统计学差异(P>0.05)。图1b 所示,与对照组相比,1%O2及CoCl2(0.5~0.8 mmol/L)组HIF-1α 表达均明显上调(P<0.05),且与1%O2组相比无显著差异(P>0.05)。因此选取0.6 mmol/L 和0.8 mmol/L CoCl2用于OGD/R 模型构建筛选。
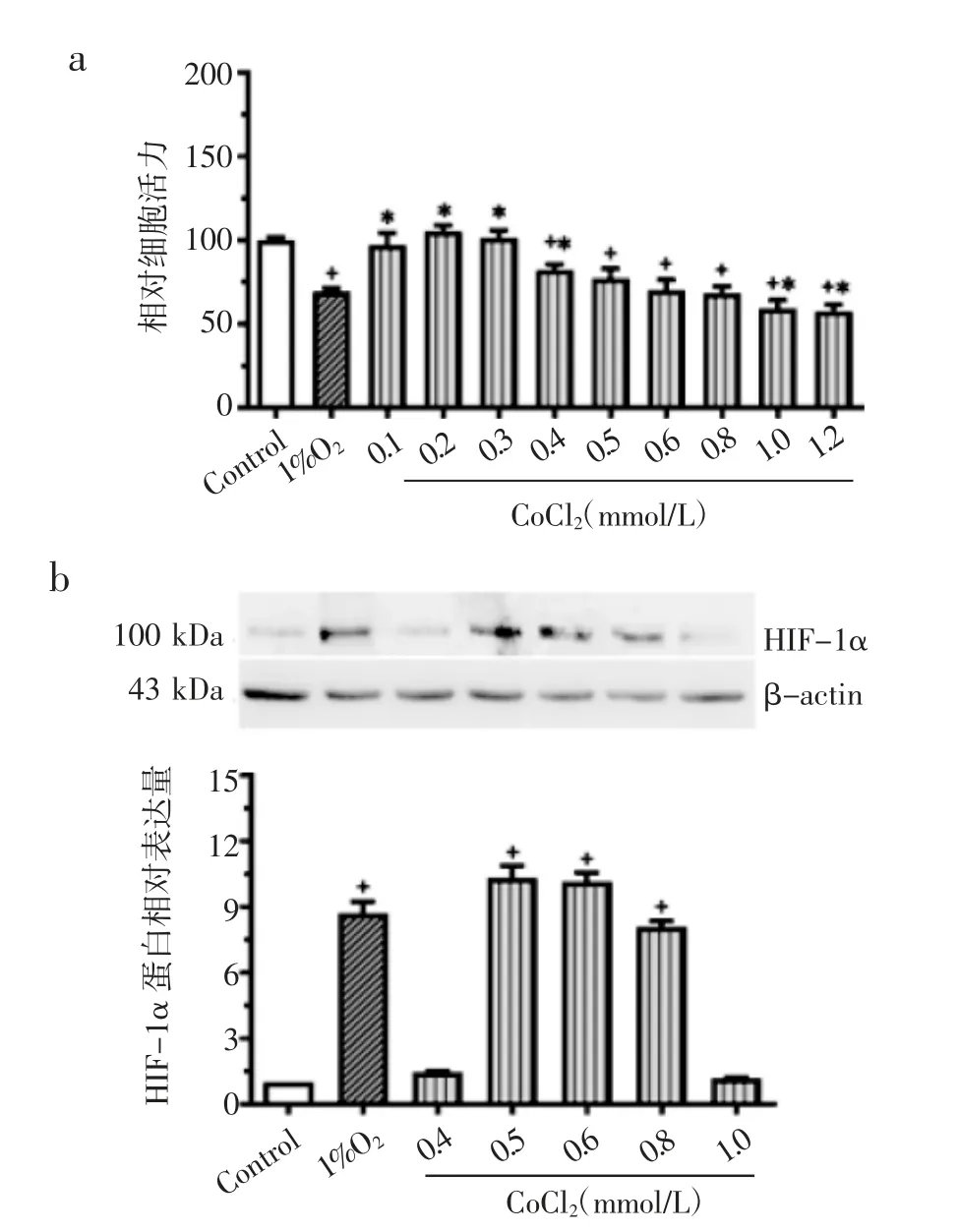
图1 不同浓度CoCl2 对H9c2 细胞活力和HIF-1α 表达的影响Fig 1 The effects of 1%O2 and CoCl2 of different concentrations on the viability and expression of HIF-1α in H9c2 cells
2.2 模拟1%O2OGD/R 模型等效CoCl2浓度 结果图2a 所示,与对照组相比,1%O2及CoCl2(0.6、0.8 mmol/L)组细胞活力明显降低(P<0.05)。与1%O2组相比,0.8 mmol/L CoCl2组细胞活力降低没有统计学意义(P>0.05)。图2b 所示,与对照组相比,1%O2及CoCl2(0.6、0.8 mmol/L)组HIF-1α 表达均明显上调(P<0.05),且与1%O2组相比无显著差异(P>0.05)。因此选取CoCl2(0.8 mmol/L)用于后续OGD/R 模型及检测实验。

图2 OGD/R 条件下不同浓度CoCl2 对H9c2 细胞活力及HIF-1α表达的影响Fig 2 The effect of 1%O2 and CoCl2 of different concentrations on the viability and expression of HIF-1α of H9c2 cells under the condition of OGD/R
2.3 OGD/R 条件下芹菜素对H9c2 细胞活力、SOD及LDH 的影响 图3a 所示,与对照组相比,OGD/R组的细胞活力均受到明显抑制(P<0.05);与OGD/R组相比,芹菜素(0.01~10 μmol/L)组细胞活力有显著差异(P<0.05);图3b 所示,与对照组相比,OGD/R 组的SOD 含量明显下降(P<0.05);与OGD/R 组相比,10 μmol/L 芹菜素组SOD 含量显著提高(P<0.05);图3c 所示,与对照组相比,OGD/R 组的LDH 漏出量明显提高(P<0.05);与OGD/R 组相比,10 μmol/L 芹菜素组LDH 漏出量显著下降(P<0.05)。

图3 OGD/R 条件下芹菜素对H9c2 细胞活力、SOD 及LDH 的影响Fig 3 The effects of API on the viability,SOD and LDH of H9c2 cells under the condition of OGD/R
2.4 芹菜素对OGD/R H9c2 细胞凋亡相关指标的影响 图4a、b、c 所示,与对照组相比,OGD/R 组Bcl-2 表达量明显下降(P<0.05),Bax 的表达量明显增加(P<0.05);10 μmol/L 芹菜素可显著提高Bcl-2的表达量(P<0.05),降低Bax 的表达量(P<0.05);图4d 所示,与对照组相比,OGD/R 组的caspase-3 含量明显增加(P<0.05);与OGD/R 组相比,10 μmol/L芹菜素组的caspase-3 含量明显下降(P<0.05)。

图4 OGD/R 条件下芹菜素对H9c2 细胞凋亡相关指标的影响Fig 4 The effects of API on the apoptosis-related indexes of H9c2 cells under the condition of OGD/R
2.5 芹菜素对H9c2 细胞OGD/R 损伤SIRT1 及自噬相关蛋白表达的影响 图5 所示,与对照组相比,OGD/R组SIRT1 及LC3Ⅱ/Ⅰ表达量明显下降(P<0.05),p62 的表达量明显增加(P<0.05);10 μmol/L 芹菜素可显著提高SIRT1 及LC3Ⅱ/Ⅰ的表达量(P<0.05),降低p62 的表达量(P<0.05)。
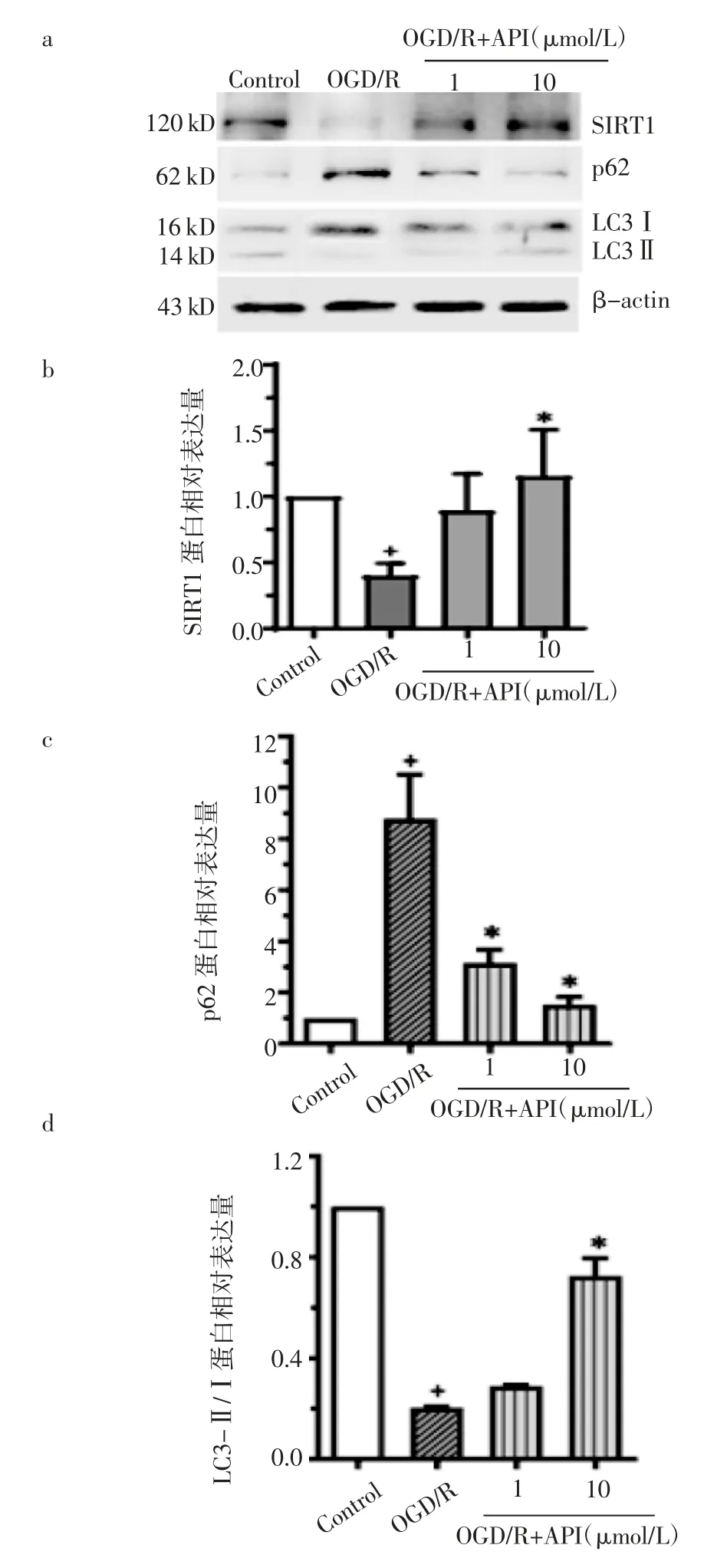
图5 OGD/R 条件下芹菜素对H9c2 细胞SIRT1 及自噬相关指标的影响Fig 5 The effects of API on the SIRT1 and autophagy-related indexes of H9c2 cells under the condition of OGD/R
3 讨论
MIRI 是由多种细胞因子和信号通路参与的复杂病理过程,对心血管病患者的治疗和预后造成了严重影响。因此,MIRI 机制的研究一直是心血管领域的热点。如何减轻MIRI 对改善心肌梗死患者预后具有重要意义。OGD/R 诱导的H9c2 细胞损伤是经典的体外心肌细胞损伤模型,常用于心肌梗死和MIRI 的药物筛选和机制研究。根据剥氧方式不同,可分为物理缺氧和化学缺氧。物理缺氧存在设备复杂昂贵,模型稳定性差,缺氧程度难以控制的缺点,而化学缺氧则可以有效避免上述缺点且操作简便易行。CoCl2通过钴离子代替HIF 的脯氨酰羟化酶活性位点中的Fe2+,能在体外诱导细胞产生缺氧损伤[14-15],因此CoCl2常用于化学缺氧损伤模型。HIF-1α 是由缺氧刺激产生的重要转录因子,在缺氧诱导的哺乳动物细胞中广泛表达,为缺氧应答的全局性调控因子,与氧化应激密切相关[16]。故本研究以H9c2 细胞为实验对象,采用细胞活力和HIF-1α 相结合作为评价指标,比较1%O2和CoCl2建立的缺氧和OGD/R 损伤效果,构建简便易行且稳定的H9c2 细胞化学OGD/R 模型。结果显示,0.8 mmol/L CoCl2联合剥糖作用16 h,复氧复糖4 h的方案与此条件下1%O2造成的损伤相近,可作为H9c2 细胞稳定的OGD/R 损伤模型。
本研究通过MTT 实验阐明了芹菜素对OGD/R H9c2 细胞活力的影响。结果显示,低浓度的芹菜素(0.000 1、0.001 μmol/L)对OGD/R H9c2 细胞没有作用;中等浓度的芹菜素(0.01~10 μmol/L)对OGD/R H9c2 细胞有保护作用;而高浓度的芹菜素(40~100 μmol/L)对OGD/R H9c2 细胞有明显毒性作用,故接下来的研究选用1、10 μmol/L 的芹菜素进行实验。OGD/R 会造成心肌细胞氧化应激损伤,SOD 和LDH 是氧化应激损伤的重要标志物[17]。SOD 与氧自由基的清除能力密切相关,检测SOD 水平可反映氧自由基攻击引起的细胞脂膜损伤的严重程度。LDH作为一种催化酶,主要参与丙酮酸和乳酸的转化,当细胞膜损伤时其可释放到细胞外基质,检测LDH水平可反映细胞膜完整性及细胞损伤程度。本研究显示芹菜素可提高OGD/R 所致的细胞SOD 降低,可减少OGD/R 所致的LDH 漏出,提示芹菜素可以保护OGD/R 导致的细胞氧化应激损伤。
心肌细胞凋亡是MIRI 的主要致病机制之一,心肌细胞是永久细胞,凋亡会导致心肌收缩功能障碍,阻断凋亡过程可防止心肌细胞的丢失,减少心脏损伤。Bcl-2 家族是重要的细胞凋亡调控蛋白,而其中的Bcl-2(抑制凋亡蛋白)和Bax(促进凋亡蛋白)发挥着关键作用,两者可以结合,形成二聚结合体,调节线粒体的稳定状态,进而调控细胞凋亡[18]。Caspase-3 是细胞凋亡的主要执行者,可引起DNA降解、细胞核碎裂,最终导致细胞凋亡的发生[19]。本研究发现,芹菜素可提高OGD/R 所致的Bcl-2 降低,减少OGD/R 所致的细胞Bax 和Caspase-3 增加,提示芹菜素可以减少OGD/R 导致的细胞凋亡。
自噬是一种复杂保守的自我降解过程,对维持细胞内稳态至关重要。自噬在心脏疾病中的作用取决于特定的病理情况和发病阶段,适度的自噬有助于保持心脏健康,而自噬不足或过度则对心脏造成损伤[20-21]。LC3 是自噬的标志物,其中存在LC3-Ⅰ、LC3-Ⅱ两种形式,泛素样作用下的LC3-Ⅰ与膜结构上的磷脂共价结合,形成LC3-Ⅱ存在于自噬体的内外膜上,所以LC3-Ⅱ/Ⅰ的比值可反映自噬水平[22]。p62 是选择性自噬接头蛋白,是连接LC3 与待降解泛素化底物的重要桥梁。作为自噬待降解的产物,自噬流受阻时大量泛素化蛋白会堆积到细胞内,此时p62 表达水平会升高;而在自噬流活化状态下,p62 被降解,表达水平降低[23]。因此,LC3-Ⅱ/LC3-Ⅰ及p62 表达水平能可评价细胞自噬流水平。Liu 等[24]通过动物实验证实,盐诱导蛋白2 可能通过mTOR/ULK1 信号通路促进自噬,抑制该蛋白可通过减少异常自噬减轻心肌MIRI。而Li 等[25]通过动物和细胞实验证实促进自噬通量可抑制MIRI 诱导的细胞凋亡。这说明自噬在MIRI 中的两面性。SIRT1 是sirtuins 蛋白家族的一员,主要位于常染色体区域,可在细胞核和细胞质中穿梭调节,其通过催化组蛋白和转录因子的赖氨酸去乙酰化修饰,从而影响细胞增殖、衰老与代谢等生理活动[26]。SIRT1通过其脱乙酰酶活性参与自噬从起始到降解的不同步骤的调节。当然,SIRT1 的水平和功能也受自噬过程的调节[27]。Zhang 等[28]发现去甲肾上腺素抑制剂可在心肌缺血再灌注损伤小鼠中发挥保护作用,其机制与SIRT1 对自噬小体的清除密切相关。Zhong等[29]研究表明SIRT1 可通过减少炎症和诱导自噬发挥抗心肌缺血损伤的作用。Wang 等[30]利用H9c2细胞证实,SIRT1 可通过促进自噬抑制心肌肥厚。本研究显示,OGD/R 条件下,SIRT1 和LC3-Ⅱ/Ⅰ明显降低,p62 蛋白表达明显上调,提示自噬水平降低。芹菜素可一定程度逆转上述自噬通量的变化,表明芹菜素增强了OGD/R H9c2 的自噬水平,该过程可能与SIRT1 的作用有关。
综上所述,自噬、氧化应激和凋亡之间存在复杂的相互作用关系。氧化应激可以激活自噬,也可促进凋亡[31-32]。自噬可以通过清除受损的线粒体,降低活性氧,减轻细胞氧化应激损伤,进而减少细胞的凋亡[33]。本研究结果显示,芹菜素能提高H9c2 细胞OGD/R 模型的细胞活力,减少细胞凋亡,具有明显抑制氧化应激损伤的作用,可能与其通过调控SIRT1 促进细胞自噬有关,但它们之间的相互关系及深入机制,仍需要进一步实验加以验证。
