茵陈蒿汤对阻塞性黄疸大鼠肝细胞ATF6/GRP78/CHOP凋亡信号通路的影响
2023-06-30孙一萌刘浩刘军舰吴艳丽张西波戚经天李忠廉
孙一萌,刘浩,刘军舰,吴艳丽,张西波,戚经天,李忠廉
(1.天津医科大学研究生院,天津 300070;2.湖北省第三人民医院肾内科,武汉 430033;3.天津市中西医结合医院肝胆胰外科二,天津 300100;4.东营市中医院重症医学科,东营 257055)
阻塞性黄疸多因胆管结石、胆道闭塞、肿瘤压迫等胆管机械性梗阻使胆汁淤积,无法排除所致。通常会引起肝功能指标异常和肝细胞损害以及高胆红素血症、高胆汁酸血症、内毒素血症、细菌移位等病理改变,造成多器官功能障碍,其中肝损伤首当其冲[1]。肝细胞凋亡是肝损伤最重要的基本发病机制之一,细胞凋亡是引起肝脏损伤和肝脏疾病的中心环节[2]。茵陈蒿汤的主要组成药物是茵陈蒿、栀子、大黄,具有清热利胆、保肝疏肝、抗纤维化、降低血糖、降低血脂、抗炎止痛、抑制肝细胞凋亡的多种功效,对治疗肝损伤有很好的作用。近年来,内质网应激(ERS)在肝细胞凋亡中的作用机制是当前的研究热点,目前尚未完全阐明。未折叠蛋白(UPR)应答是ERS 的一个重要信号转导通路,它包括肌醇依赖性激酶(IRE)1α 和蛋白激酶R 样内质网激酶(PERK)、转录活化因子6(ATF6)3 个内质网跨膜蛋白。葡萄糖调节蛋白78(GRP78)是ERS 诱导表达的关键蛋白,是ERS 与UPR 应答启动的一个标志。课题组在前期实验研究中发现,IRE1α、PERK 介导ERS 过程中可能存在阻塞性黄疸肝细胞凋亡现象,茵陈蒿汤肝脏保护机制也可能与ERS 在IRE1α 和PERK 介导下发挥相关作用有关[3-4]。本研究通过建立阻塞性黄疸肝损伤细胞模型,探讨阻塞性黄疸的肝损伤机制与ATF6 介导的信号通路的关系,进一步阐明茵陈蒿汤减轻肝损害的可能机制。
1 材料和方法
1.1 材料
1.1.1 动物与细胞 健康SPF 级Sprague-Dawley(SD)大鼠12 只[许可证号:SCXK-(军)2014-0001],体重200 g 左右(北京华阜康生物科技股份有限公司),在室温20~25℃,相对湿度(50±20)%,12 h/12 h明暗周期的环境下分笼饲养于动物实验室。实验细胞为大鼠正常肝细胞BRL-3A,购自中国科学院上海细胞库,使用DMEM 高糖培养基+1%青链霉素培养。接种于直径6 cm 的培养皿中,每2~3 d 传代1次,取生长情况良好的细胞用于本次实验。
1.1.2 主要试剂、药物与仪器 茵陈蒿汤由茵陈蒿30 g、栀子20 g、大黄10 g 组成(天津市中西医结合医院);DMEM 高糖培养基(Hyclone 公司,美国);胎牛血清、胰蛋白酶(EDTA)(Gibco 公司,美国);二甲基亚砜(DMSO)(Sigma 公司,美国);Anti-actin、Anti-ATF6、Anti-CHOP、Anti-GRP78、兔二抗、鼠二抗(北京百奥思科公司,货号分别为MD409、MD4830、MD4846、MD886、MD2141、MD2142);cDNA 反转录试剂盒(Thermo Scientific 公司,美国,货号K1621);实时荧光定量聚合酶链式反应(real-time PCR)试剂盒(南京建成公司,货号N117);BCA 蛋白浓度测定试剂盒(MDL 公司,货号MD913053);TUNEL 细胞凋亡检测试剂盒(德国罗氏,货号11684795910);大鼠谷丙转氨酶(ALT)ELISA 试剂盒(泽叶生物公司,货号ZY60182R);大鼠天冬氨酸转氨酶(AST)ELISA 试剂盒(泽叶生物公司)。BHC-1300ⅡA2 型超净工作台(苏州金净净化设备科技有限公司);311 型CO2恒温培养箱(Thermo 公司,美国);3-30型号K 低温离心机(Sigma 公司,德国);电热恒温水浴槽(上海医用恒温设备厂);倒置相差显微镜(Olympus 公司,日本);TS-100 型脱色摇床(海门其林贝尔仪器制造公司);BG-sub MIDI 型电泳仪(北京百晶生物技术有限公司);170-8280 型ChemiDoc MP 化学发光成像系统(Bio-rad 公司,美国);Gel Doc-It310 型凝胶成像系统(UVP 公司,美国);SDSPAGE 电泳系统(BIO-Rad 公司,美国);QuantStudio 3 型PCR 扩增仪(ABI 公司,美国);T100 型热循环聚合酶链式反应(PCR)仪。
1.1.3 中药及含药血清制备 中药冷水浸泡30 min后大火烧开,转文火煎药45 min,再次加水以文火煎30 min,保留汤药。阻塞性黄疸血清:SD 大鼠麻醉后消毒,上腹正中切口入腹,胆总管中上1/3 行双重结扎,7 d 后留取阻塞性黄疸模型大鼠血清。茵陈蒿汤含药血清:根据茵陈蒿汤的临床用量计算出大鼠的等效剂量,按每100 g 体重1 mL 茵陈蒿汤剂量给SD 大鼠灌胃[5],2 次/d,连续灌胃7 d,末次给药2 h 后采血,留取茵陈蒿汤含药血清。下腔静脉采血,3 000 r/min 离心15 min,分离血清,经56℃、30 min 灭火处理后,用0.22 μm 微孔滤膜过滤细菌,-80℃冻存备用。
1.2 方法
1.2.1 细胞分组与处理 将浓度为2×105/mL 的BRL-3A 细胞接种到12 孔培养板中,每孔2 mL,共接种27 孔,置CO2恒温箱中培养24 h,观察细胞贴壁达80%左右后将培养板移至超净工作台,吸弃每孔中的培养基并用PBS 缓冲液洗2 次,27 孔被随机分为3 组,每组9 孔,分别为对照组(S 组):DMEM高糖培养基+15%胎牛血清常规培养;阻塞性黄疸组(O 组):DMEM 高糖培养基+5%阻塞性黄疸血清+10%胎牛血清;阻塞性黄疸+茵陈蒿汤组(Y 组):DMEM 高塘培养基+5%阻塞性黄疸血清+10%茵陈蒿汤含药血清。3 组细胞加入含相应血清的培养基2 mL,分别在培养6、24、48 h,3 个时间点取细胞沉淀与上清液,每个时间点每组取3 孔。用Western 印迹法与q-PCR 测每组细胞中ATF6、GRP78、CHOP蛋白与基因含量,上清液中测ALT、AST 含量。
1.2.2 细胞一般形态观察 将细胞培养板从培养箱中取出,观察细胞培养液的颜色和清澈度,用20 倍物镜观察细胞的轮廓、形状和内部结构。
1.2.3 实时荧光定量PCR(q-PCR)检测BRL-3A细胞中ATF6、GRP78、CHOP mRNA 的水平 按照说明书裂解组织,提取总RNA 并检测其浓度和纯度。根据逆转录试剂盒将RNA 逆转录合成扩增前cDNA。以2 μL cDNA 为模板,甘油醛-3-磷酸脱氢酶(GAPDH)为内参mRNA,用SYBR Green 按95℃顺序预变性2 min,94℃变性20 s,60℃退火20 s,72℃延伸30 s,共40 个循环,按照2-ΔΔCt法进行定量分析,PCR 引物由北京赛百盛基因技术有限公司设计,所需引物见表1。

表1 引物序列Tab 1 Primer sequences
1.2.4 Western 印迹检测BRL-3A 中ATF6、GRP78、CHOP 蛋白表达 根据BCA 蛋白定量试剂盒测定蛋白浓度。将蛋白变性后,以每孔40 μg 的量进行上样,进行电泳分析,转膜,封闭,裁剪目的条带,按照说明书配制稀释比例均为1∶1 000,将剪取条带置于一抗4℃条件下孵育过夜,TBST 洗膜,按照说明书以兔二抗1∶2 000 的稀释比例配制二抗稀释液,室温孵育2 h,洗膜,成像仪上进行信号检测,分析条带。
1.2.5 原位末端标记法(TUNEL)检测细胞凋亡情况 根据说明书,使用TUNEL 细胞凋亡检测试剂盒进行TUNEL 染色,检测细胞凋亡。通过末端脱氧核苷酸转移酶(TdT)结合生物素化的脱氧核苷酸DNA 片段。用TACS Blue Label 检测生物素化核苷酸。TUNEL 染色后,切片用4′-6-二氨基-2-苯基吲哚(DAPI)复染以检测细胞核,呈蓝色染色。TUNEL阳性细胞为绿色染色的细胞(波长488 nm)。
1.2.6 ELISA 试剂盒检测培养液中ALT、AST 情况 收集得各孔细胞培养液,将细胞培养液经离心机3 000 r/min 离心10 min,取上层液使用全自动生化仪检测各组血清ALT、AST 水平。
1.3 统计学处理 应用SPSS 26.0 软件包分析数据。正态分布的计量资料用±s 表示,多组之间的比较用单因素方差分析,进一步两两比较用LSD-t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 细胞形态学变化 BCL-3A 大鼠肝细胞的正常形态特征如图1A、1B、1C 所示。与S 组相比,O 组和Y 组细胞在所有时间点(图1D、1E、1F)均明显变小、变形,数量减少;但与O 组相比,Y 组细胞状态在每个时间点(图1G、1H、1I)均有显著改善。
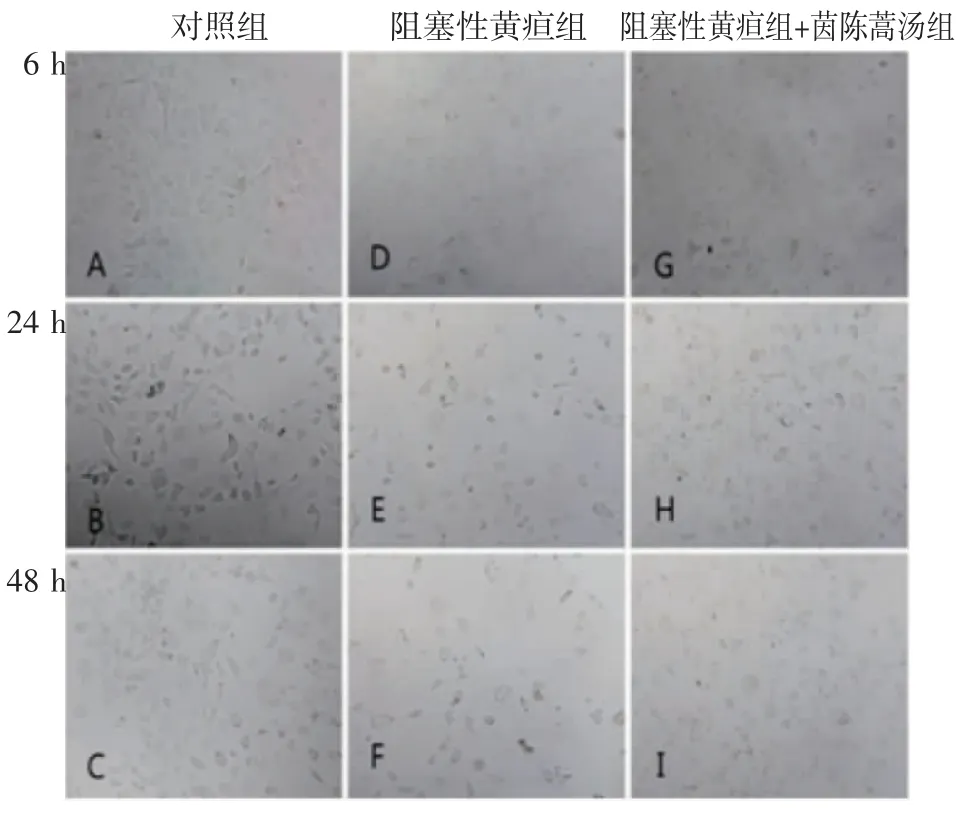
图1 细胞形态学变化(100×)Fig 1 Changes in cell morphology(100×)
2.2 TUNEL 法检测细胞凋亡 TUNEL 阳性染色结果如图2 所示。与S 组相比,O 组和Y 组在每个时间点的凋亡指数均升高;与O 组相比,Y 组在各时间点的凋亡指数均下降(均P<0.05),见表2。
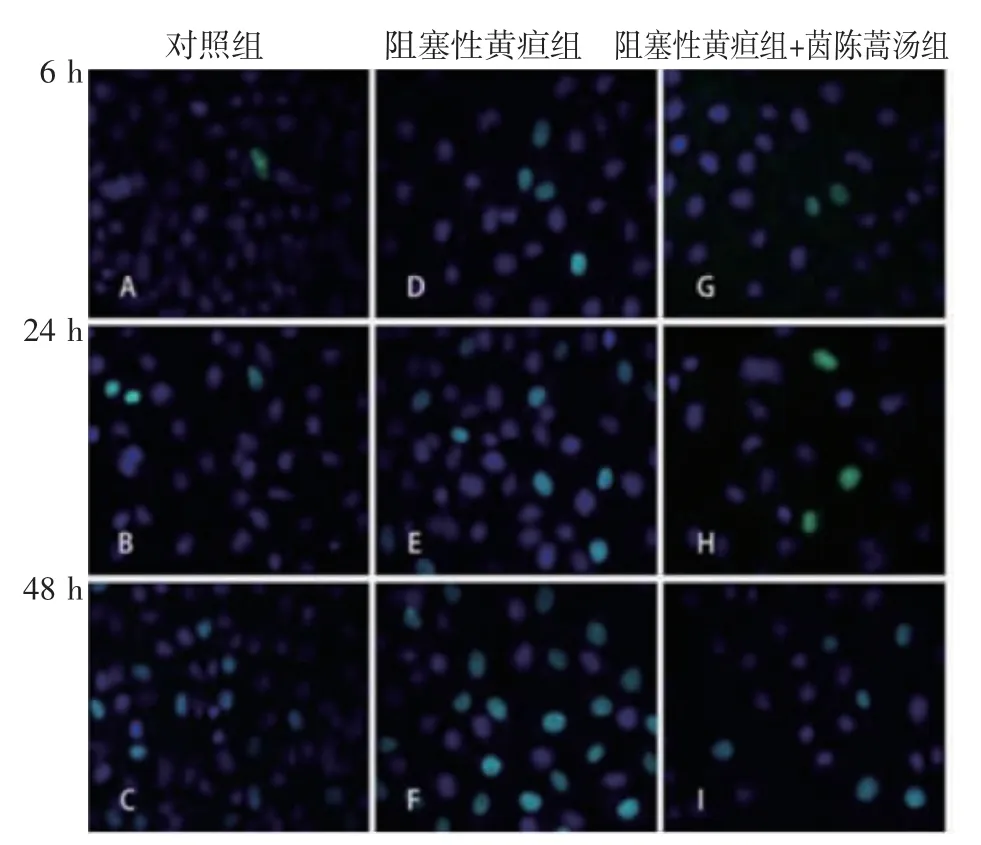
图2 TUNEL 法检测细胞凋亡(100×)Fig 2 Apoptosis detected by TUNEL(100×)
表2 BCL-3A 大鼠肝细胞凋亡指数(%,±s)Tab 2 Hepatocyte apoptosis index in BCL-3A rats(%,±s)
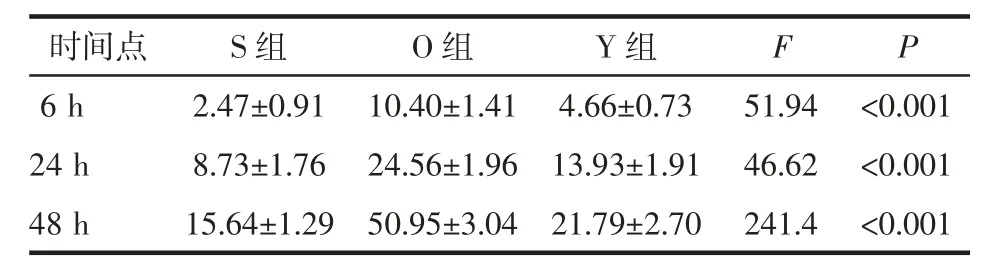
表2 BCL-3A 大鼠肝细胞凋亡指数(%,±s)Tab 2 Hepatocyte apoptosis index in BCL-3A rats(%,±s)
注:O 组:阻塞性黄疸血清配制的培养基培养的阻塞性黄疸组;Y 组:梗阻性黄疸血清+茵陈蒿汤含药血清配制的培养基培养的阻塞性黄疸+茵陈蒿汤组
时间点S 组O 组Y 组FP 6 h2.47±0.91 10.40±1.41 4.66±0.7351.94 <0.001 24 h8.73±1.76 24.56±1.96 13.93±1.91 46.62 <0.001 48 h15.64±1.29 50.95±3.04 21.79±2.70 241.4 <0.001
2.3 mRNA 的表达水平 q-PCR 显示,在每个时间点,O 组和Y 组的ATF6、GRP78 和CHOP 的mRNA表达水平均高于正常组(均P<0.05)。与O 组相比,Y 组在各时间点的ATF6、GRP78 和CHOP mRNA表达水平均显著降低(F=52.46、129.5、280.9,91.87、81.36、108.4,79.95、62.98、43.40,均P<0.05),见图3。
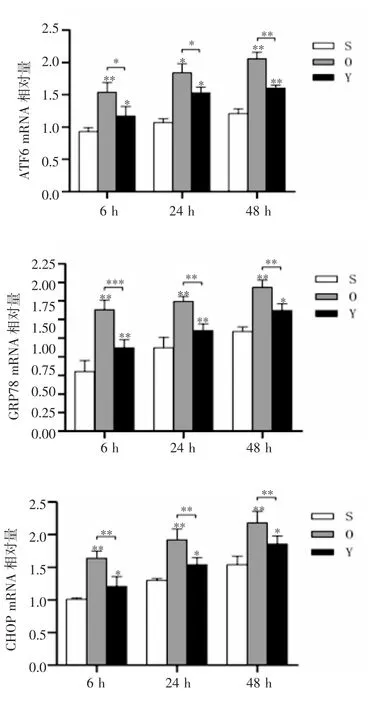
图3 茵陈蒿汤对ATF6、GRP78 和CHOP mRNA 表达的影响Fig 3 Effects of Yinchenhao decoction on the expression of ATF6,GRP78 and CHOP mRNA
2.4 蛋白质表达水平 Western 印迹显示,与S 组比较,O 组和Y 组的CHOP、ATF6 和GRP78 蛋白表达水平在各时间点均高于S 组(均P<0.05)。与O 组相比,Y 组的CHOP、ATF6 和GRP78 蛋白表达水平在各时间点均显著降低(F=88.36、59.90、46.07,127.7、111.2、107.1,71.09、107.0、154.3,均P<0.05),见图4。
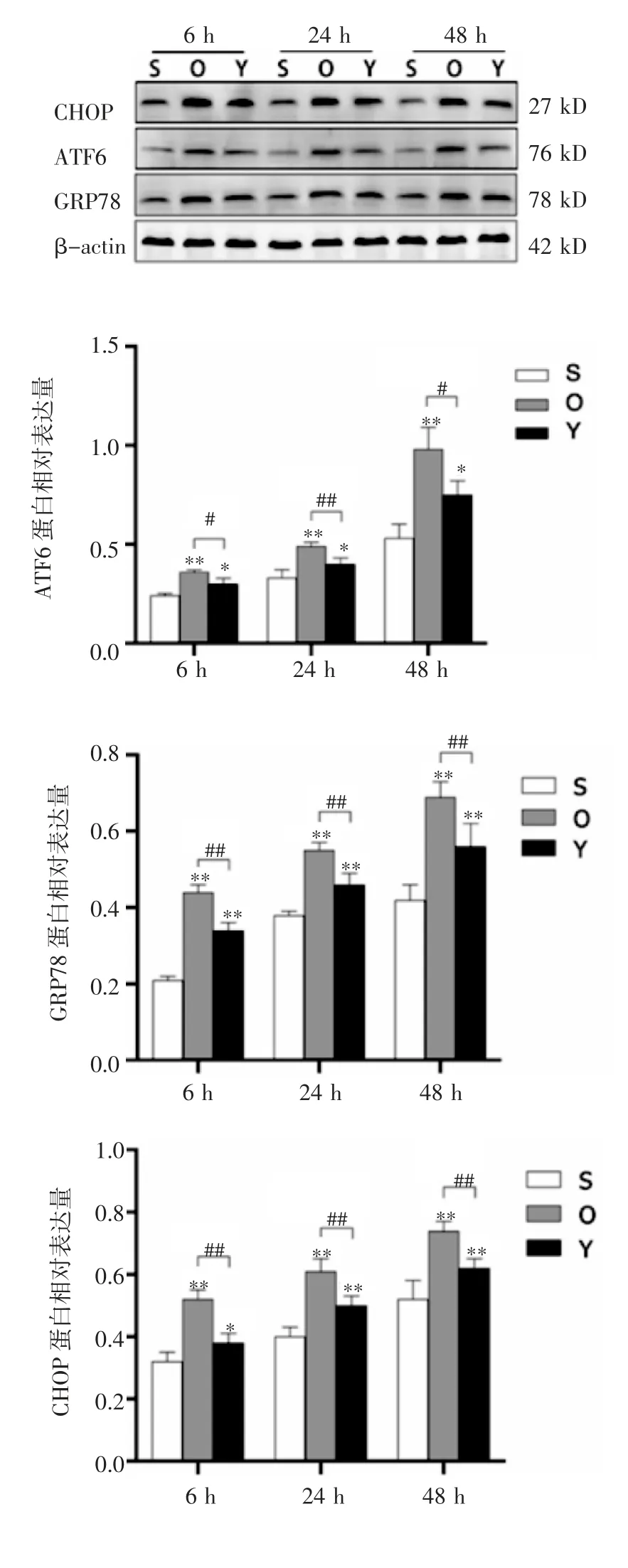
图4 Western 印迹检测蛋白质的表达水平Fig 4 The expression of the protein detected by Western blotting
2.5 各时间点培养液中ALT、AST 测定结果 与S组比较,O 组与Y 组在各时间点AST、ALT 水平均高于S 组(均P<0.05);与O 组比较,Y 组在各时间点AST、ALT 水平均低于O 组,但较S 组高(均P<0.05),见表3。
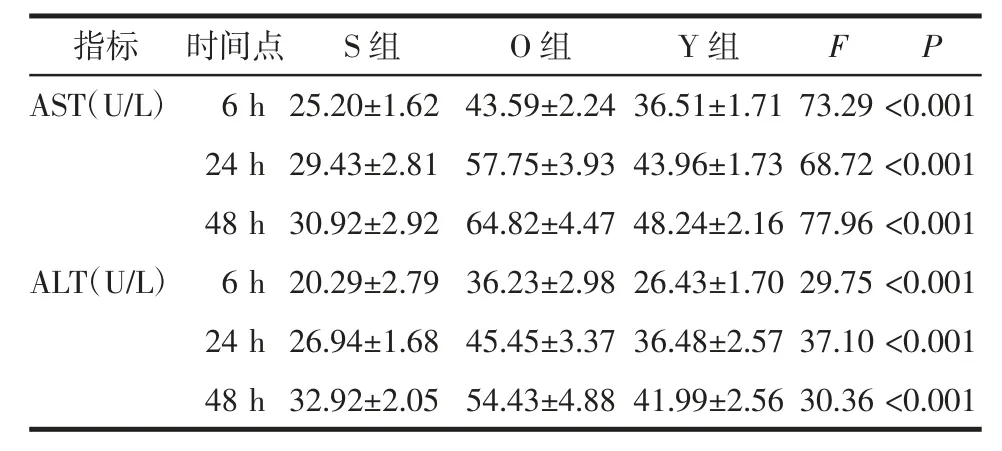
表3 ALT、AST 测定结果Tab 3 Results of ALT and AST determination
3 讨论
长期胆道梗阻可使胆汁阻塞无法正常排出,胆汁瘀滞不畅使胆管增宽扩张,含毒素胆汁也随流入血中,肝脏在毒素作用下产生炎症,毒素在胆道梗阻的作用下因不能排出体外而形成内毒素血症,内毒素与肝损伤的形成有直接关系,进而可能导致肝纤维化,严重者会导致肝功能衰竭[6-7]。从中医理论来讲,黄疸多以感染湿热、疫毒、寒湿为主,皮肤橘黄、颜色鲜明为多阳黄,病因以感受湿热之邪,邪湿内蕴为主,发病较急,病程较短;皮肤虽黄但颜色晦暗多为阴黄,多以感受寒湿之邪为主,发病较缓,病程较长。梗阻性黄疸的病因若持续存在,会升高胆红素,引起皮肤巩膜黄染,严重时可能会引起肝细胞损害,因此利用茵陈蒿汤降低胆红素,进而褪去黄疸和治疗肝损害成为治疗本病的关键。茵陈蒿汤作为古今清热、利湿、退黄的代表方剂,主要用于治疗湿热证为主的黄疸病。虽用药颇简,配伍却十分严谨。此方茵陈为君药,药量达6 两,重取其清热利湿、利胆退黄之功效,从而利小便排出湿热之邪。栀子作为臣药,用量14 枚以清利中焦与下焦的湿热之邪,佐以大黄2 两,增强其清热泻火退黄、泻下攻积之功效,使谷疸不留于宿食,湿热瘀积之邪褪去,黄疸则消。现代药理学研究表明,茵陈色原酮可以阻滞细胞周期从而抑制前列腺癌细胞增殖[8],茵陈蒿中乙酸乙酯能够通过阻断磷脂酰肌醇3 激酶/蛋白激酶B 信号通路来诱导肝癌细胞的凋亡[9]。栀子中的藏红花素在肠道内的水解为西红花酸,有研究显示,西红花酸可显著抑制乙醛诱导的大鼠肝星状细胞增殖模型,降低Ⅰ型及Ⅲ型胶原的合成并通过调控肝星状细胞Bax、Bcl-2 的表达,促进细胞凋亡[10]。
内质网可以通过一系列协同适应性反应,使内环境处于稳定状态,当细胞受到缺氧、钙平衡紊乱、氧化应激或毒物反应等刺激时,会影响内质网折叠修饰蛋白质的功能,导致未折叠蛋白在内质网腔内聚集,称为ERS。研究发现,许多肝脏疾病的发生、发展过程与ERS 诱导的肝细胞凋亡均有密切关系。ERS 作为细胞对内质网压力反应的自我保护机制,具有重要意义,适度的ERS 可通过UPR 来减轻内质网蛋白质负荷,保护内质网功能,而UPR 在内质网中的长时间积聚则会损伤内质网功能,细胞会以凋亡的形式消除受损细胞。
ATF6 是一种Ⅱ型跨膜感受蛋白,存在于真核细胞内质网膜上,是CREB/ATF 转录因子家族的一员。在非应激状态下,ATF6 以酶原的形式处于抑制状态,在应激状态下时,激活的ATF6 在高尔基体上转位后发生切割。之后,裂解的ATF6 移动到细胞核,作为一个活性转录因子,上调GRP78 蛋白的转录,使X-盒结合蛋白1(XBP1)与CHOP 等内质网相关伴侣分子蛋白的表达增加,提高了细胞对UPR的处理能力[11]。GRP78 作为分子伴侣主要存在于真核生物中的内质网膜上,它与错误折叠的蛋白质和未组装的复合物结合,并启动负责UPR 调节的内质网相关降解(ERAD)[12-14]。在非应激状态下,GRP78与ATF6、PERK、IRE1 以非活性形式相结合,在细胞接触内质网内累积的未折叠蛋白质后,GRP78 被释放出来,在消耗能量后促进蛋白的正确折叠,与此同时,GRP78 过量表达可以减少内质网内钙离子水平,减轻ERS,在内质网稳态中发挥重要作用[15-16]。非应激状态下,细胞内CHOP 的含量极少,当ERS诱导细胞凋亡时,活化的ATF6 在胞核内与ERS 反应元件结合,启动CHOP 转录与表达并积聚于细胞核内,作为转录因子,CHOP 能调节如Bcl-2、TRB3、GADD34 等许多促凋亡因子的表达,进而诱导细胞凋亡[17-18]。
本研究结果显示,与S 组比较,O 组肝细胞在各时间点肝功能指标及凋亡指数均高于S 组,O 组肝细胞在各时间点ATF6、GRP78、CHOP 蛋白与mRNA 表达水平均高于S 组,提示阻塞性黄疸肝损伤中存在ERS 的激活,ERS 中的ATF6 信号通路及细胞凋亡途径在阻塞性黄疸肝损伤细胞中被激活。与O 组比较,Y 组肝细胞在各时间点肝功能指标及调往指数均明显降低,Y 组肝细胞在各时间点ATF6、GRP78、CHOP 蛋白与mRNA 表达水平均低于O组,提示茵陈蒿汤含药血清干预阻塞性黄疸肝损伤细胞模型后GRP78 表达下调,使ERS 得到一定程度缓解,茵陈蒿汤含药血清一定程度上抑制了阻塞性黄疸肝损伤细胞中ATF6 的表达,从而降低了其对下游信号分子CHOP 的激活,减少了ERS 诱导的肝细胞凋亡,进而改善阻塞性黄疸肝功能损伤。
综上所述,ERS 中的ATF6 信号通路可能被激活并参与了阻塞性黄疸诱导的肝细胞凋亡病理过程,茵陈蒿汤含药血清可改善阻塞性黄疸细胞模型的肝功能情况,其机制可能与其下调ATF6、GRP78和CHOP 的表达,进而缓解ERS 进而抑制肝细胞凋亡相关。
