青蒿素缓释微粒对铜绿微囊藻的抑制机理研究
2023-06-29张铮惠张建华陈旭清倪利晓
张铮惠,李 霞,张建华,陈旭清,倪利晓
(1. 无锡市河湖治理和水资源管理中心,江苏 无锡 214071;2.江苏省水利厅生态河湖处,江苏 南京 210029;3. 河海大学环境学院,江苏 南京 210098;4.河海大学浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 210098)
0 引言
近年来水体富营养化问题已经成为世界环境的巨大挑战之一,特别是在欧洲[1-5]和中国[6-9],情况更加严峻。 根据联合国环境规划署的最新报告《第五次全球环境展望(GEO-5)》[10],全世界超过40%的水体正遭受中度或重度富营养化。 高浓度的P 和N直接在湖泊、河流和其他生态系统中造成藻类水华(蓝藻),同时导致植物和藻类的过度生长[5]。蓝藻水华能够严重消耗自然水系统中的O2,同时大量的藻细胞生物阻碍了光对沉水植被的照射穿透,导致水生植物死亡,水环境群落受到严重破坏[11-12]。除了上述危害之外,蓝藻水华还会产生大量的次生代谢物质,如藻毒素,这些藻毒素可以被其他水生生物摄取并累积,使蓝藻水华对其他生物生命的危害变得更加致命[13],同时,藻毒素被释放到水体中并进入公共供水系统,一旦饮用了含有藻毒素的饮用水,将严重危害人类的生命健康[14]。
蓝藻水华的存在造成的直接、间接经济损失不计其数[15],控制蓝藻水华十分必要。 目前,生物化感效应因其无二次污染和经济性等优点受到研究者的广泛关注。青蒿素是一种由植物黄花蒿产生和释放的化感物质,因其优秀的抗疟效果而被人们知晓。 据报道,青蒿素及其衍生物不仅具有抗疟的功效而且还具有潜在的植物毒性,在一些单子叶和双子叶植物中,显示出抑制幼苗生长的作用[16]。 因此,不少研究者开始关注青蒿素对藻类的化感效应。BHARATI A 等[17]发现青蒿素作为藻细胞的PSII 系统中次级醌(QB)的抑制剂,可以抑制光合系统中的电子传递效率。 NI L X 等[18-19]从黄花蒿中分离鉴定出抑藻活性物质青蒿素,并通过抑藻试验证实青蒿素能够引起藻细胞生理功能紊乱。 由此可见,青蒿素对蓝藻具有较强的抑制效果。本文通过离子交联法制备了青蒿素缓释微粒,并通过测定在青蒿素缓释微粒胁迫下藻细胞生物量,光合色素合成,胞外电导率变化、核酸和蛋白质含量变化,胞内活性氧(ROS)活性,研究其对铜绿微囊藻的抑制机理,为蓝藻水华的治理提供了新的方法和思路。
1 方法和材料
1.1 铜绿微囊藻的培养
铜绿微囊藻(Microcystis aeruginosa,FACHB905)由中国科学院水生生物研究所淡水藻类培养库提供 (中国武汉)。 接种前,将所有培养基和烧瓶于121 ℃高压灭菌30 min。 供试铜绿微囊藻接种到BG-11 培养基中在光照培养箱内培养,培养箱中明、暗比为14 ∶10,光照强度为3 000 lux。所有样品1式3 份,每天摇动3 次,随机更换位置以避免沉淀和光照不均。
1.2 青蒿素缓释微粒的制备
通过离子交联制备青蒿素缓释微粒[20]。 步骤如下:①在质量浓度为1 mg/mL 的海藻酸钠溶液中加入青蒿素(纯度98%,上海阿拉丁生化科技有限公司),得到混合液; ②将混合液滴入含体积分数为1%的壳聚糖(脱乙酰度≥95%,粘度为100 ~ 200 mPa·s,上海阿拉丁生化科技有限公司)和质量浓度为6 mg/mL 的CaCl2(AR,上海国药化学试剂有限公司)酸性水溶液中;③将悬浮液离心(8 000 r/min,30 min),清洗并冷冻干燥,以获得青蒿素缓释微粒。
1.3 青蒿素缓释微粒对铜绿微囊藻抑制效果
参考ISO8692—2012 标准进行抑藻试验。初始藻密度为1.6 ×106cells/mL,同时设置1 个空白对照组和1 个青蒿素缓释微粒处理组(投加之前课题组研究出具有最佳抑藻效果的青蒿素缓释微粒质量浓度为0.2 g/L),每组3 个平行,连续培养30 d。定期用紫外分光光度计在680 nm 处测定各组培养液中铜绿微囊藻的藻密度。前期试验获得藻密度与吸光度标准曲线公式如下:
式中:Y 为藻细胞密度,× 105cells/mL;X 为680 nm波长处的光密度。
抑制率计算公式为:
式中: IR 为抑制率(Inhibition Ratio),%;N0为空白对照组藻细胞密度,×105cells/mL;N 为处理组藻细胞密度,×105cells/mL。
1.4 叶绿素a 浓度的测定
测定叶绿素a 浓度具体步骤如下:①取20 mL青蒿素处理后的铜绿微囊藻置于离心管内低速离心(3 000 r/min,10 min),弃上清液,再用蒸馏水重复步骤清洗2 遍;②向剩下的固体中加入体积分数为95%的乙醇定容至5 mL,然后将样品冷冻,再将冷冻好的样品放置于避光的环境下融化,重复操作3 次; ③将样品进行高速离心后 (12 000 r/min,3 min),倒出上清液,以体积分数为95%的乙醇为空白对照在波长665 和750 nm 测定其吸光度,根据公式计算叶绿素a 含量。
式中:ρ 为叶绿素a 的质量浓度,mg/L;A665和A750分别为乙醇萃取液于波长665 和750 nm 的吸光度。
1.5 藻液蛋白、核酸、电导率、活性氧的测定
藻液蛋白、核酸、电导率的测定方法如下[21]:取20 mL 藻液,将其置于高速离心机中于6 000 r/min下离心10 min,取上清液。 一部分用于测定在其280 nm 处的吸光度值,即为藻液中的蛋白含量,测定260 nm 处的吸光度值即为藻液中核酸含量,剩余部分用于测定电导率和活性氧自由基。
用流式细胞仪测定活性氧(ROS)活性,流式细胞仪的参数为λ激发= 488 nm,λ发射= 525 nm,根据荧光强度的均值来表征ROS 的活性。
1.6 数据处理
在表型数据分析中,数据分析采用Excel 2019和SPSS 24.0 统计软件,并采用单因素方差分析(ANOVA),然后应用邓肯后验 (Duncan Post-hoc test)处理组间的显著差异(p < 0.05)。 数值均采用均值± 误差值,均值为3 组平行数据的均值,最后用Origin 2019 绘图。
2 结果与讨论
2.1 青蒿素缓释微粒对铜绿微囊藻的抑制率
在最佳投放剂量下,研究单次投放青蒿素缓释微粒对初始密度为1.6 × 106cells/mL 的铜绿微囊藻的生长抑制作用。青蒿素缓释微粒对铜绿微囊藻藻密度与抑制率的影响结果见图1。

图1 青蒿素缓释微粒对铜绿微囊藻的影响
由图1 可以看出,该微粒具有良好的抑藻性能。 在试验的前10 d,试验组的藻密度增大速率明显小于空白组的,同时抑制率也验证了这一点。 抑制率在前10 d 的迅速增加可能是由于缓释微粒的表面附着了一定量的青蒿素,一旦将微粒放入中,这部分青蒿素就可以从微粒表面转移到藻类溶液中,青蒿素在藻液中的积累量迅速增加[24]。 第10 ~20 d,微粒持续释放青蒿素到藻液中,青蒿素对铜绿微囊藻的抑制率持续增大,但是增速放缓。 20 d后微粒释放青蒿素与抑藻消耗的青蒿素均达到动态平衡,抑制率也保持稳定,最终接近98%,此时藻液已经近乎是透明的状态,这与已有的抑藻试验研究结果一致[25-26]。 以上研究表明青蒿素缓释微粒对藻类生长的抑制具有持久性。
2.2 青蒿素缓释微粒对藻细胞叶绿素a 含量的影响
叶绿素a 作为藻类主要色素之一,通常被用来评估藻类的光合作用。青蒿素缓释微粒胁迫下藻细胞叶绿素a 浓度变化见图2。
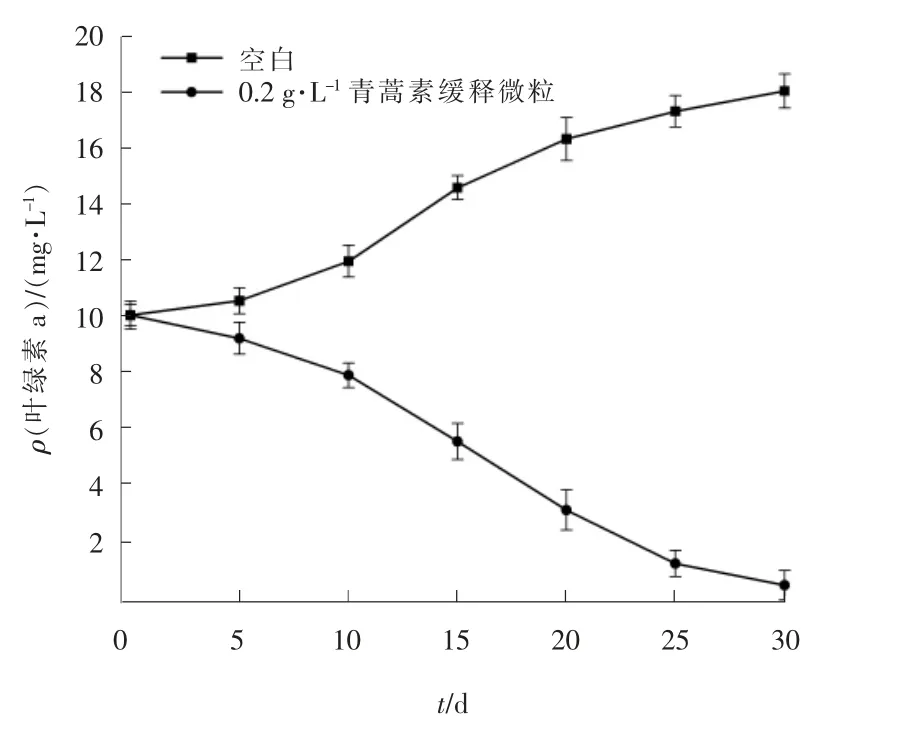
图2 叶绿素a 浓度变化
由图2 可以看出,空白组在0~5 d 内叶绿素a浓度基本保持不变,从第5 天开始到试验结束,叶绿素a 的浓度保持一定增速,与2.1 中空白组藻密度的增长趋势一致。青蒿素缓释微粒组在试验周期内,叶绿素a 浓度持续降低,在0 ~ 15 d 内降低速率较慢,15 ~ 20 d 内降低速率最快,20 ~ 30 d 内浓度降低速率趋于平缓,在第30 天时叶绿素a 质量浓度接近于0 mg/L。青蒿素缓释微粒组的藻密度变化与叶绿素a 浓度变化趋势一致,两者之间有着密不可分的联系[27]。 叶绿素a 浓度减少说明在青蒿素的胁迫下铜绿微囊藻的光合系统被破坏,藻细胞的光合色素生成通道受限,藻细胞光合作用被抑制,从而无法为藻细胞提供正常生理活动所需要的营养,最终导致藻细胞死亡。有研究发现,青蒿素缓释微粒会抑制铜绿微囊藻叶绿素a 等光合色素的合成,进而抑制藻胆蛋白的合成,最终抑制光反应的进行[25]。
2.3 青蒿素缓释微粒对藻细胞膜通透性的影响
细胞膜是藻细胞的重要组成部分之一,能够保护细胞内部生理环境不受外界影响。在化感物质胁迫下铜绿微囊藻的细胞膜往往遭到破坏,藻细胞膜受损之后细胞内部环境失去保护,导致细胞无法进行正常生命活动。 研究通过对藻液中的电导率、核酸和蛋白含量的测定来评估青蒿素对铜绿微囊藻细胞膜的损伤。青蒿素缓释微粒胁迫下铜绿微囊藻液中电导率核酸核酸蛋白、含量变化见图3。
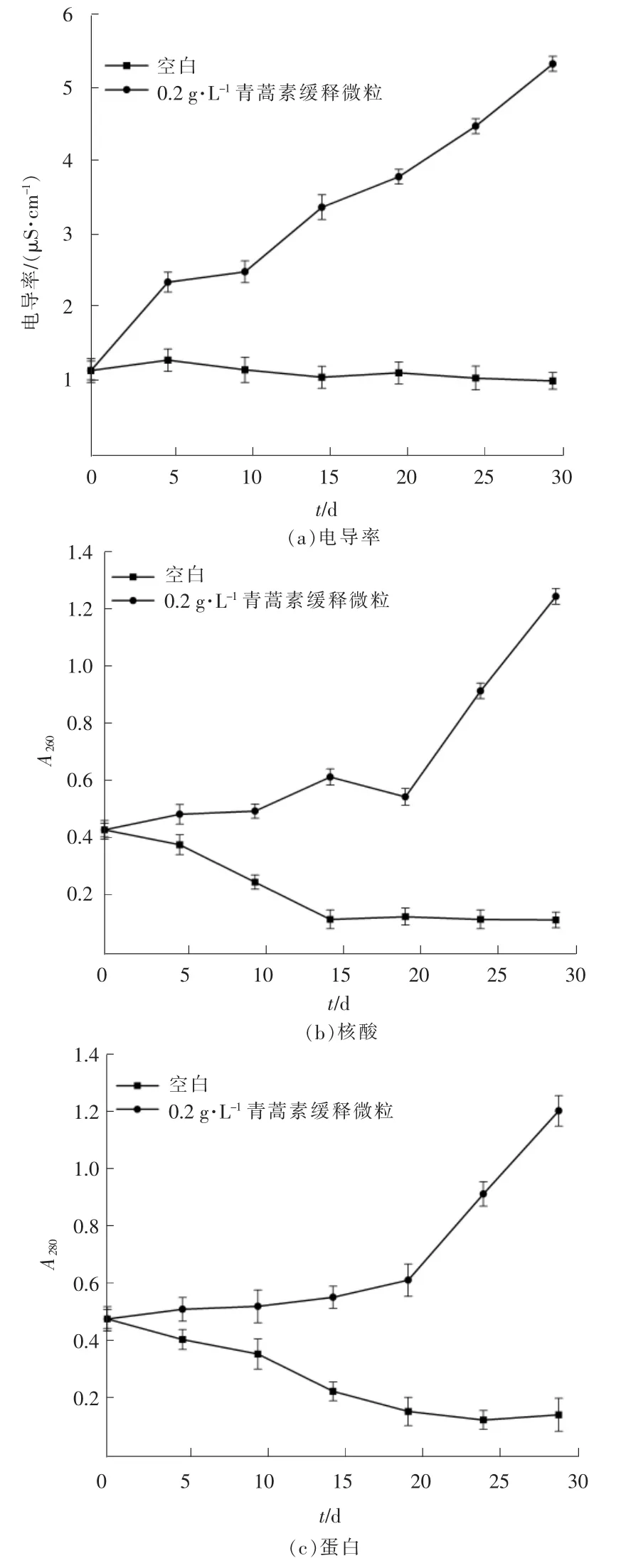
图3 青蒿素缓释微粒对藻细胞膜通透性的影响
由图3(a)可以看出,空白组藻液中的电导率在试验初期有轻微升高,随后又回落并保持稳定,总体变化较小。而青蒿素缓释微粒组藻液的电导率则持续升高,从添加青蒿素后一直到试验结束均处于升高趋势中。 在整个试验周期内除BG-11 培养基中含有金属盐,会对电导率会有影响外,未添加其他的外源离子改变电导率,考虑到空白组和青蒿素缓释微粒组中的BG-11 初始用量一致,故排除培养基对电导率测定的干扰影响。分析青蒿素缓释微粒组的电导率持续升高的原因为青蒿素破坏了藻细胞膜造成细胞膜破裂,藻细胞内的K+,Ca2+,Fe3+和酸根离子等物质泄露到藻液中。
由图3(b)~(c)可以看出,空白组藻液中的核酸含量和蛋白含量在试验前15 d 呈下降趋势,在第16 ~30 d 内几乎保持不变,而青蒿素缓释微粒组藻液中的两者浓度总体上均呈上升趋势。青蒿素缓释微粒组2 种物质的变化趋势说明藻细胞受到了破坏,导致正常情况下难以透过细胞膜的大分子大量泄露到藻液中。ZHANG T T 等[28]利用酚酸类化感物质破坏铜绿微囊藻细胞膜,导致藻液中蛋白质和核酸含量大幅上升,与本文结论一致。
2.4 青蒿素缓释微粒对藻细胞ROS 的影响
正常条件下,藻细胞内产生的ROS 和被细胞抗氧化机制清除的ROS 处于平衡状态。 然而,随着化感物质的胁迫,细胞的氧化应激反应加强,细胞内的ROS 过度增加[29],这些细胞内过量的ROS 在被破坏的光合作用电子传递链内的电子低效转移下产生[31],或者通过分子氧和三重态激发的叶绿素之间的反应产生[30]。过量的ROS 可以损坏细胞各种生理机制,因此,测定ROS 的活性可以评估青蒿素对铜绿微囊藻的抑制作用。青蒿素缓释微粒对铜绿微囊藻活性氧的影响见图4。
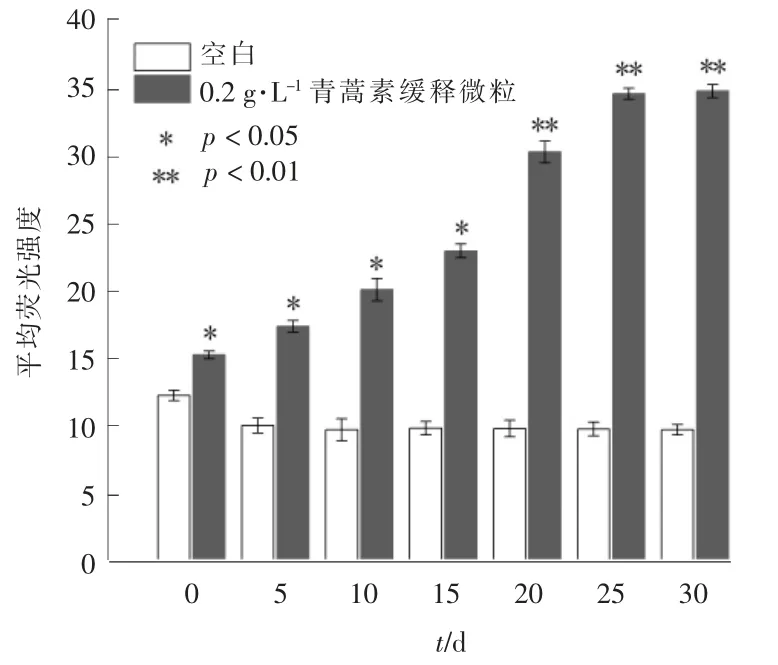
图4 铜绿微囊藻ROS 活性变化
由图4 可以看出,空白组的自由氧活性在实验未开始时最高,第5 天ROS 活性开始下降,在随后的几次测定中ROS 活性变化较小。 铜绿微囊藻对外界环境的改变具有相当的敏锐性,并且会做出应激反应[31]。 将空白微粒加入到藻类中,铜绿微囊藻感受到外界环境的改变产生了应激反应,细胞内ROS 活性增强。 空白微粒对铜绿微囊藻无毒性,所以在很短的时间内藻细胞适应了添加了空白微粒的环境,细胞内的ROS 活性又恢复正常水平。 青蒿素缓释微粒组的ROS 活性随着处理时间加长持续增长,活性均强于空白组,在第30 天时,ROS 活性强度达到空白组的3.5 倍。 由于青蒿素抑制藻细胞叶绿素合成并破坏光合作用系统,推测可能是青蒿素迫使藻细胞在光合系统中的低效率电子传递过程中产生了过量的ROS,也可能是青蒿素直接氧化藻细胞产生了过量的ROS。
3 结论
(1)使用质量浓度为0.2 g/L 的青蒿素缓释微粒进行为期30 d 的抑藻试验,试验20 d 后抑制率保持稳定,最终接近98%,说明青蒿素具有较好的抑藻效果;
(2)对青蒿素缓释抑藻剂的抑藻机理为其通过降低叶绿素a 浓度,阻碍藻细胞进行光合作用;同时,通过刺激藻细胞内产生大量的ROS,致使细胞膜脂质过氧化,对藻细胞膜的通透性产生不可逆的损伤。
