烟草叶宽性状主效 QTL 定位及育种评价
2023-06-29赵会纳雷波程立锐余婧蒋彩虹刘旦杨爱国王兵余世洲
赵会纳 雷波 程立锐 余婧 蒋彩虹 刘旦 杨爱国 王兵 余世洲
摘要:為研究烟草叶宽性状调控的遗传规律,定位其主效 QTL 位点,利用烟草 SNP 芯片对构建的重组自交系(Recombinant Inbred Lines, RILs )群体(小黄金1025×Beinhart1000-1)进行基因分型,并使用 IciMapping 4.2软件的 ICIM-ADD 方法在全基因组范围内定位到6个与叶宽性状相关的 QTL ,分别位于2、4、9、13、17和20号连锁群上,可以解释2.9%~36.8%的表型遗传变异;其中 qMLW20-1可解释36.8%的表型变异,为主效基因。以 K326为轮回亲本、Samsun 为主效基因 qMLW20-1供体亲本构建染色体片段代换系评估烟草叶宽主效 QTL 的遗传效应,结果表明,导入 qMLW20-1主效基因能显著提高烟叶叶宽,其中 G3材料显著提高了烟叶钾含量,感官质量等其他重要性状与对照无显著性差异,未携带不良性状基因,具有较好的育种利用价值。研究结果为克隆叶宽性状主效基因和进行分子改良奠定了基础。
关键词:叶宽;重组自交系;染色体片段代换系; QTL;育种评价
中图分类号: S572.03 文献标识码: A 文章编号:1007-5119(2023)01-0001-07
Identification of Major-effect QTLs Associated with Leaf Width of Tobacco and Breeding Evaluation
ZHAO Huina1, LEI Bo1, CHENG Lirui2, YU Jing1, JIANG Caihong2, LIU Dan1,YANG Aiguo2, WANG Bing1, YU Shizhou1*
(1. Guizhou Academy of Tobacco Science, Molecular Genetics Key Laboratory of China Tobacco, Guiyang 550081, China;
2. Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Key Laboratory of Tobacco Gene Resources, Qingdao266101, China)
Abstract: In order to study the genetic regulation of leaf width traits in tobacco, to locate the dominant QTL loci and promote the breeding of tobacco varieties, the recombinant inbred lines (RILs) population (Xiaohuangjin 1025×Beinhart1000-1) was genotyped using a tobacco SNP chip. The ICIM-ADD method of IciMapping 4.2 software was used to identify six QTLs related to leaf width traits in the whole genome, which were located in groups 2, 4, 9, 13, 17 and 20, respectively and could explain 2.9% to 36.8% of the phenotypic genetic variation. qMLW20-1 accounted for 36.8% of the phenotypic variation and was the major-effect QTL. A chromosome fragment substitution line which using K326 as the transmutation parent and Samsun as the dominant gene qMLW20-1 donor parent was constructed to evaluate the genetic effect of the dominant gene QTL for leaf width in tobacco. The results showed that the introduction of qMLW20-1 as the dominant gene could significantly increase leaf width, and G3 significantly increased the potassium content in tobacco leaves. The sensory quality and other important characters had no significant difference from the control, and no bad character genes were carried. The line has good breeding utilization value. The results laid a foundation for cloning and molecular improvement of the major gene of leaf width trait.
Keywords: leaf width; recombinant inbred lines; chromosome segment substitution lines; QTL; breeding evaluation
煙草是以收获叶片为目的的经济作物,在国民经济中占有重要地位。培育优质高产的新品种是现代育种的重要目标[1-3]。烟草的产量和品质与株高、叶片数、叶形、叶长和叶宽等诸多农艺性状相关,受多基因控制及环境的影响,遗传机制较为复杂[4-5],其中叶宽是重要农艺性状之一,直接影响烟叶的产量和品质[6]。
遗传分析表明,烟草叶宽受2~3个主效基因+多基因控制[4],主效基因遗传率约为60.61%~90.17%[5],且各基因间主要以加性效应为主。童治军等[7]利用 QTL 定位的方法在207个株系组成的烤烟 DH 群体中定位到了12个与叶宽相关的 QTL,分别分布在第4、5、7、14、17、22、24号连锁群,同时在262个 F6株系的重组自交系群体(RILs)中定位到了4个与叶宽相关的 QTL,分布在第4、17、22、24号连锁群[8]。李茜[9]用红花大金元和 SWU109构建了 F2群体,定位获得4个与叶宽相关的 QTL,分布在第1、17、23号连锁群。这些研究为解决当前烟叶开片不充分问题,提供了分子辅助选择标记,确定了主效基因所在区间范围,但存在获得的主效基因区间范围较大(>3.5 cM ),遗传率相对较低(<20.30%)等问题,限制了叶宽性状相关基因的挖掘及在育种中的进一步利用。
相比 F2、BC 群体等双亲遗传群体,重组自交系(Recombinant Inbred Lines, RILs)和染色体片段代换系(Chromosome Segment Substitution Lines , CSSLs)因其群体基因型纯合,是进行基因定位的理想群体材料。特别是 CSSLs 群体,因仅将受体亲本染色体的部分片段替换成为供体亲本的染色体片段,遗传背景明确,QTL 定位、遗传效应分析和功能基因定位结果相对准确,已在水稻、玉米、小麦等作物重要性状基因定位研究上广泛应用[10-13]。
本研究以小黄金1025为母本(窄叶材料), Beinhar1000-1为父本(宽叶材料),构建了基于双亲杂交的重组自交系(F10),对烟草叶宽性状进行全基因组 QTL 定位,发掘控制烟草叶宽的主效位点。同时选择普通烟草栽培品种 K326为轮回亲本,香料烟 Samsun 为供体亲本,构建染色体片段代换系(BC4F3),评价主效 QTL 的遗传效应和育种价值,为进一步定位和克隆相关基因,开展烟草重要农艺性状分子改良提供理论依据。
1材料与方法
1.1供试材料
以窄叶烟草品种小黄金1025为母本(P1),宽叶烟草品种 Beinhar1000-1为父本(P2),杂交获得 F1,进而利用单粒传法繁育9代,获得重组自交系群体(F10代)209份,用于 QTL 定位分析试验。以普通烟草栽培品种 K326(G1,窄叶亲本)为轮回亲本,以香料烟 Samsun(宽叶亲本)为供体亲本,配置杂交组合,进而连续回交和自交,获得 BC4F3群体。在 QTL 定位分析试验结果上,筛选携带和不携带叶宽主效位点 QTL 的染色体片段代换系材料11份(G2~G12),用于遗传效应评价试验,其中 G3、G6、G7、G8和 G11为携带叶宽主效位点 QTL 的导入系材料, G2、G4、G5、G9、G10和 G12为不携带主效位点 QTL 的导入系材料,上述材料及对应的基因分型数据均由中国农业科学院烟草研究所提供。
1.2试验方法
1.2.1 试验设计 QTL 定位分析试验:2020年在中国农业科学院烟草研究所诸城试验基地种植209份重组自交系及亲本材料进行叶宽表型分析和 QTL 定位分析,每个材料设2个重复,每个重复种植10株,株距50 cm ,行距120 cm ,中心花开放50%打顶,留叶19片,于成熟期测量第10叶位叶宽,其他栽培管理按当地优质烟生产技术措施进行。
遗传效应评价试验:2021年在贵州省烟草科学研究院平坝基地开展叶宽主效位点 qMLW20-1的遗传效应评价试验,参试材料为染色体片段代换系材料11份(G2~G12)及 K326(G1,对照),试验采用完全随机区组设计,每个材料种植4行,每行20株,3次重复,50%中心花开放打顶,留叶19片,测量各叶位叶宽,调查自然条件下花叶病毒病、白粉病、气候性斑点病发病率。正常成熟采收和烘烤,取各材料中部(C3F)和上部(B2F)烟叶进行主要化学成分和物理特性测定及感官质量评价。其他栽培管理按当地优质烟生产技术措施进行。
1.2.2项目调查与测定(1)叶宽测定。各材料每重复选择生长相对一致的5株烟株,于各叶位烟叶成熟期,测量叶宽数据,取所测株烟平均值,测量方法参照 YC/T 142—2010进行。
(2)病害调查。在大田自然发病情况下,调查遗传效应评价试验各材料花叶病毒病、白粉病、气候性斑点病发病率,发病率(%)=发病株数/调查总株数×100%,取3个重复平均值,调查方法参照 GB/T 23222—2008进行。
(3)主要化学成分及物理特性测定。烟碱、糖、总氮、钾、氯含量分别依据 YC/T 160—2002、YC/T 159—2019、YC/T 161—2002、YC/T 217—2007和 YC/T 162—2011测定。单叶质量、含梗率、叶面密度依据 YC/T 142—2010测定。
(4)感官质量评价。感官质量评价以 YC/T 138—1998为基础进行评价。评价指标包括香气质(10分)、香气量(10分)、吃味(12分)、杂气(10分)、刺激性(10分)。
1.2.3 QTL 定位以小黄金1025、Beinhart1000-1及209个重组自交系群体为材料,利用430 K SNP 芯片鉴定基因型,进而构建的烟草高密度单核苷酸多态性(SNP)遗传图谱[14],利用 QTL IciMapping4.2软件的 ICIM-ADD 作图方法对烟草叶宽性状进行 QTL 定位和遗传分析[15],利用费希尔精确检验(Fishers exact test)方法和生物信息学分析方法对定位获得的主效基因进行染色体片段代换系遗传效应分析和育种价值评价。
1.2.4 目标位点导入情况鉴定根据初定位结果,确定与主效 QTL 紧密连锁的 SNP 标记,通过 Blastn 软件将 SNP 分子标记比对至红花大金元参考基因组序列(烟草行业内网 IP :http://10.6.0.76),获得 SNP 上下游300 bp 左右序列,进而利用PCR 在不同双亲(K326和 Samsun)及不同 BC4F3导入系中扩增目标片段,利用一代 sanger 测序方法鉴定不同材料的基因型,确定目标 QTL 的导入情况。
1.2.5遗传效应分析利用 SPSS 16.0软件对病害发病率进行单因素方差分析和多重比较,其中多重比较采用Duncan 法,并采用 SPSS 16.0软件对主要化学成分、物理性状和感官质量得分进行独立样本 t 检验。采用Excel 进行重组自交系及双亲叶宽分布柱形图及各叶位叶宽折线图绘制;采用 GraphPad Prism 7.00软件进行控制叶宽主效位点所在染色体位置的 LOD 图绘制。
2结果
2.1重组自交系群体及双亲叶宽性状分析
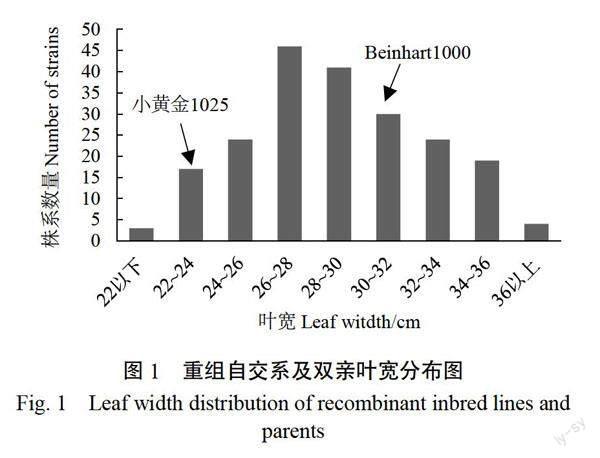
各重组自交系和亲本叶宽范围及对应的材料数量如图1所示,亲本Beinhart1000-1的叶宽为30.0~32.0 cm,小黄金1025为22.0~24.0 cm,两者在叶宽性状上存在明显差异。同时重组自交系不同株系材料叶宽变幅为20.4~40.0 cm,平均为29.0 cm,呈现出连续性变异,部分自交系材料表现出超亲优势,且有近50份超出宽叶亲本 Beinhart1000-1,表明烟草叶寬性状虽为典型数量性状,但通过遗传改良具有提高的潜力。
2.2叶宽性状 QTL定位
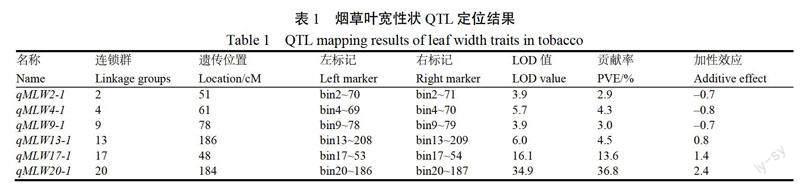
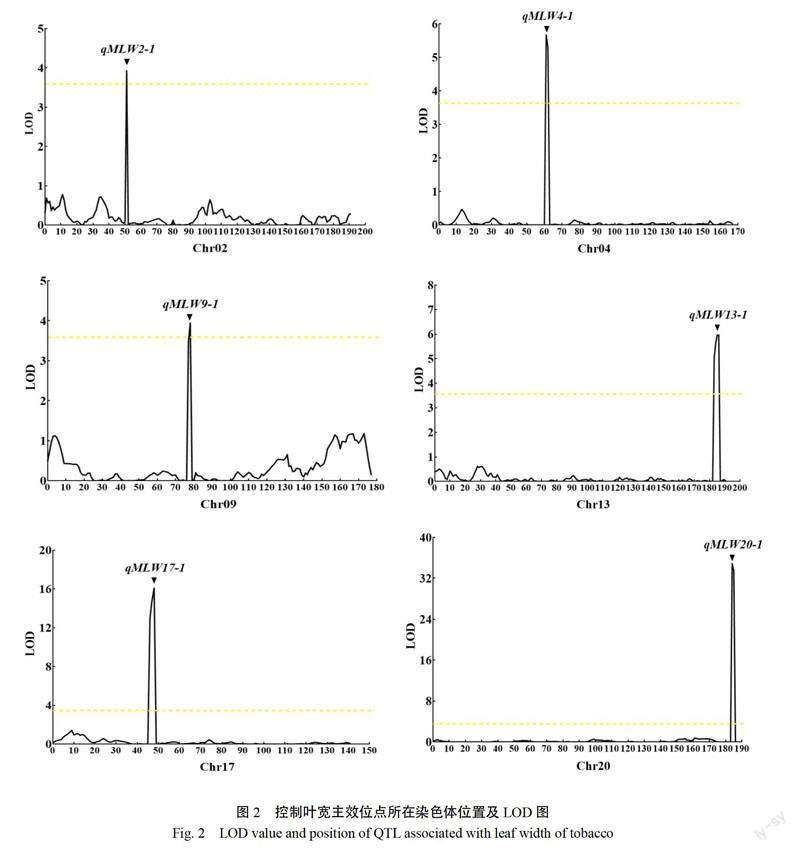
如表1和图2所示,对叶宽性状进行全基因组 QTL 定位,共检测到6个 QTL,分别位于2、4、9、13、17和20号连锁群上,命名为 qMLW2-1、 qMLW4-1、qMLW9-1、qMLW13-1、qMLW17-1和 qMLW20-1。位于20号连锁群上的 qMLW20-1,处于标记 bin20~186和 bin20~187之间,可解释总表型变异的36.8%,为主效 QTL ,来源于亲本 Beinhart1000-1;17号连锁群上的 qMLW17-1,处于标记 bin17~53和 bin17~54之间,可解释总表型变异的13.6%,同样来源于亲本 Beinhart1000-1。此外,在2、4、9和13号连锁群上还定位到4个微效QTL ,可解释总表型变异的2.9%~4.5%,除 qMLW13-1外,其他3个微效 QTL 都来自于亲本 Beinhart1000-1。筛选携带和不携带叶宽主效位点 qMLW20-1的11份染色体片段代换系材料(G2~G12)进行后续遗传效应评价试验。
2.3叶宽主效位点 qMLW20-1遗传效应分析
2.3.1 叶宽主效位点 qMLW20-1对叶宽性状的影响染色体片段代换系各叶位叶宽如图3所示,携带主效位点 qMLW20-1的 G3、G6、G7、G8和 G11等5份材料各叶位叶宽均明显大于对照 G1,而未携带主效位点 qMLW20-1的 G2、G4、G5、G9、G10和 G12等6份材料的叶宽较 G1窄或相当。表明导入叶宽主效基因 qMLW20-1显著提高了烟叶叶宽。
2.3.2叶宽主效位点 qMLW20-1对主要病害的影响各染色体片段代换系田间自然发病率见表3,携带叶宽主效位点 qMLW20-1的5份材料中的 G3和 G8花叶病、白粉病和气候斑发病率与对照 G1(K326)差异不显著,但 G6、G7和 G11的白粉病发病率显著的高于 G1;未携带叶宽主效位点 qMLW20-1的6份材料中 G4、G5和 G12白粉病发病较轻,发病率显著低于 G1,G10气候斑点病发病率显著高于 G1。
2.3.3叶宽主效位点 qMLW20-1对烟叶主要化学成分的影响由于大部分染色体片段代换系材料烤后烟叶质量较差,综合叶宽性状、田间自然发病率, G3表现相对最好,本研究仅对 G3的品质指标进行了分析。G3主要化学成分见表4,携带叶宽主效位点 qMLW20-1的染色体片段代换系材料 G3的中部叶糖含量显著低于对照 G1(K326),钾含量显著高于 G1,烟碱和总氮含量与 G1无显著差异。G3的上部叶烟碱含量显著低于 G1,其余指标与 G1差异均不显著。
2.3.4叶宽主效位点 qMLW20-1对烟叶主要物理特性的影响从表5可以看出, G3中部叶和上部叶的单叶质量、含梗率、叶面密度与对照 G1(K326)均无显著差异。
2.3.5叶宽主效位点 qMLW20-1对烟叶感官质量的影响 G3株系感官质量评价结果见表6,G3中部叶香气量和刺激性略好于 G1,吃味稍低于 G1,其余指标与 G1相当,但均无显著性差异;上部叶的吃味、杂气和总分略低于 G1,但无显著性差异。导入了叶宽主效等位基因 qMLW20-1的染色体片段代换材料 G3,与对照 K326相比,显著提高了烟叶叶宽和中部叶的钾含量,显著降低了中部叶糖含量和上部叶烟碱含量,对田间自然发病率、主要物理性状和感官质量无显著影响。说明叶宽主效等位基因 qMLW20-1除提高烟叶叶宽性状外,未携带不良性状基因,对育种上改善叶宽性状具有一定价值。
3讨论
叶宽性状作为复杂数量性状,目前已筛选获得了相关分子标记和 QTL[7-9],但定位精度不高且缺乏田间验证和评价。本研究利用群体基因型纯合的染色体片段代换系材料,对定位到的主效 QTL 进行了遗传效应分析和育种价值评价。本研究定位到的叶宽 QTL 位点 qMLW17-1位置与童治军等[7-8]报道中位于17号的 QTL 相近,可能为相同的 QTL 。另外,本研究定位到的叶宽相关 QTL 位点 qMLW20-1,来源于亲本Beinhart1000-1,可解释36.8%的表型遗传变异,为新发现的控制叶宽的主效 QTL。这表明随着群体材料遗传背景的改变,控制叶宽的非等位主效位点可能也存在差异。因此针对叶宽等复杂数量性状,可以利用不同遗传材料,发掘尽可能多的非等位主效位点,开发相应紧密连锁的分子标记,开展分子标记辅助聚合改良。
本研究中,携带 qMLW20-1叶宽基因染色体片段代换系材料的平均叶宽较对照 K326显著增加,推测该主效 QTL 在叶宽性状中起到重要作用,田间种植的片段代换系材料的叶宽表型也证实了这一点。研究还比较了一个导入 qMLW20-1位点的代换系材料对其他重要性状的影响,发现除显著增加叶宽性状外,其他性状如抗性、物理性状、感官质量等与对照 K326差异不显著,推测 qMLW20-1位点未携带其他重要不良性状,对烟草叶宽性状遗传改良起重要作用,具有较大的育种利用价值。
目前改良烟草叶宽性状的主要手段依旧依靠常规育种方法,但存在两个突出问题[16]:一是传统育种方法主要基于表型进行选择,易受环境影响,尤其是对于复杂的数量性状选择准确度差;二是传统育种方法具有很大的盲目性和不可预测性,最终的育种效率不到百万分之一,选择效率不高。本研究在 K326的遗传背景下,定位到 qMLW20-1位点可以解释36.8%的表型遗传变异,为利用分子标记辅助改良 K326品种提供了一种有效策略。今后,在此定位基础上,进一步发掘该主效 QTL 的相关的候选基因,明确其遗传分子机制,对植物叶片发育的分子机制解析及叶宽性状改良具有重要意义。
4结论
結果表明,基于重组自交系群体定位到6个与烟草叶宽相关的 QTL,其中包括两个主效位点;利用染色体片段代换系材料对烟草叶宽主效位点 qMLW20-1进行了遗传效应和育种价值评价,表明该位点在烟草叶宽性状定向改良育种中有较大利用价值。
参考文献
[1] 李雪君,孙计平,孙焕,等.烤烟新品种许金101的选育及特征特性.中国烟草科学,2021,42(5):1-6.
LI X J, SUN J P, SUN H, et al. Breeding and characterization of a new flue-cured tobacco variety Xujin 101. Chinese Tobacco Science, 2021(5):1-6.
[2] 宗钊辉,魏彬,曾涛,等.烤烟新品种粤烟1号的选育及特征特性[J].中国烟草科学,2021,42(3):1-6.
ZONG Z H, WEI B, ZENG T, et al. Breeding and characterization ofa new flue-cured tobacco variety Yueyan 1[J]. Chinese Tobacco Science, 2021, 42(3):1-6.
[3] 吴成林,黄文昌,程君奇,等.中国白肋烟育种研究进展与思考[J].作物研究,2016,30(4):475-482.
WU C L, HUANG W C, CHENG J Q, et al. Reflection on the development of the breeding of burley tobacco in China[J]. Crop Research, 2016, 30(4):475-482.
[4] 张兴伟,王志德,孙玉合,等.烤烟叶数、叶面积的遗传分析[J].植物遗传资源学报,2012,13(3):467-472.
ZHANG X W, WANG Z D, SUN Y H, et al. Genetic analysis of leaf number and leaf area in flue-cured tobacco[J]. Journal of Plant Genetic Resources, 2012, 13(3):467-472.
[5] 肖炳光,朱军,卢秀萍,等.烤烟主要农艺性状对产量的遗传贡献率分析[J].遗传学报,2005,32(10):1089-1093.
XIAO B G, ZHU J, LU X P, et al. Genetic contribution of agronomic traits to yield in flue-cured tobacco[J]. Journal of Genetics and Genomics, 2005, 32(10):1089-1093.
[6] 徐兴阳,欧阳进,张俊文.烤烟品种数量性状与烟叶产量和产值灰色关联度分析[J].中国烟草科学,2008,29(2):23-26.
XU X Y, OUYANG J, ZHANG J W. Gray system analysis of main quantitative traits to yields and output value of flue-cured tobacco varieties[J]. Chinese Tobacco Science, 2008, 29(2):23-26.
[7] 童治军,焦芳婵,吴兴富,等.烤烟6个农艺性状的 QTL 定位(英文)[J].作物学报,2012,38(8):1407-1415.
TONG Z J, JIAO F C, WU X F, et al. Mapping of quantitative trait loci underlying six agronomic traits in flue-cured tobacco (Nicotiana tabacum L.)[J]. Acta Agronomica Sinica, 2012, 38(8):1407-1415.
[8] 童治军,焦芳婵,陈学军,等.7个烤烟产量相关性状的 QTL 定位分析[J].西北植物学报,2018,38(7):1235-1243.
TONG Z J, JIAO F C, CHEN X J, et al. Mapping of quantitative trait loci underlying seven yield-related traits in flue-cured tobacco (Nicotiana tabacum L.)[J]. Acta Botanica Boreali-Occidentalia
[9] 李茜.煙草遗传图谱构建与农艺性状和化学成分的 QTL 定位[D].重庆:西南大学,2015.
LI X. Construction of linkage genetic map and QTL mapping for agronomic characters and chemical quality traits in tobacco [D]. Chongqing: Southwest University, 2015.
[10] SU S, HONG J, CHEN X F, et al. Gibberellins orchestrate paniclearchitecture mediated by DELLA-KNOX signalling in rice[J]. PlantBiotechnology Journal, 2021.19(11):2304-2318.
[11] HUANG R., LI Z, MAO C, et al. Natural variation at OsCERK1regulates arbuscular mycorrhizal symbiosis in rice[J]. NewPhytologist, 2020, 225(4):1762-1776.
[12] SUN Q, HU A Q, MU L Y, et al. Identification of a candidate geneunderlying qHKW3, a QTL for hundred-kernel weight in maize[J]. Theoretical and Applied Genetics, 2022, 135:1579-1589.
[13] VONTIMITTA V, LEWIS R S. Mapping of quantitative trait lociaffecting resistance to Phytophthora nicotianae in tobacco (Nicotiana tabacum L.) line Beinhart-1000[J]. Molecular Breeding, 2012, 29:89-98.
[14] LIU Y T, YUAN G D, SI H, et al. Identification of QTLs associatedwith agronomic traits in tobacco via a biparental population and an eight-way MAGIC population[J]. Frontiers in plant science, 2022, 13:878267.
[15] LI H H, YE G Y, WANG J K. A modified algorithm for theimprovement of composite interval mapping[J]. Genetics, 2007, 175:361-374.
[16]薛勇彪,段子渊,种康,等.面向未来的新一代生物育种技术-分子模块设计育种[J].中国科学院院刊,2013,28(3):308-314.
XUE B Y, DUAN Z Y, ZHONG K, et al. A new generation of biobreeding technology for the future- Molecular module design breeding [J]. Proceedings of the Chinese Academy of Sciences, 2013, 28(3):308-314.
