桦褐孔菌多糖饮料的制备及其活性研究
2023-06-28包东瑞高思惠刘芳兵杨冬雪郭鑫夏广清2
包东瑞,高思惠,刘芳兵,杨冬雪,郭鑫*,夏广清2,3,*
(1.通化师范学院医药学院,通化 134002;2.通化师范学院长白山生物种质资源研究院,通化 134002;3.长白山生物种质资源评价及应用研究院,通化 134002;4.通化师范学院生命科学学院,通化 134002)
桦褐孔菌 (Inonotus obliquus)为锈革孔菌目、锈革孔菌科真菌类[1],一般生长在树皮下面,干燥后质地坚硬,无臭无味,俗称为桦树茸,是十分重要的一类药用真菌[2]。桦褐孔菌中具有多种生物活性成分[3],主要包括多糖类、三萜类、黄酮类和多酚类[4]等。其中桦褐孔菌中多糖类物质具有一定的抗肿瘤、抗氧化、降血糖和免疫调节等生物活性受到广泛关注[5]。近年来,国内学者也十分重视桦褐孔菌的研究和相关产品的开发。
本实验对桦褐孔菌多糖饮料进行制备,并对所得多糖饮料进行了相关抗氧化、降糖活性及酶抑制活性评价,旨在为桦褐孔菌多糖产品的进一步开发与利用提供参考。
1 材料与方法
1.1 材料与仪器
桦褐孔菌多糖,实验室自制;磺胺(99%)、奈乙二胺二盐酸盐、无水磷酸二氢钾(99.5%)、无水磷酸氢二钾(99%)、无水磷酸氢二钠(99%)、无水磷酸二氢钠(99%),萨恩化学;苯酚(99%)、Trolox、3,5-二羟基苯甲酸、可溶性淀粉,西亚化学;酒石酸钾钠、α-淀粉酶、α-葡萄糖苷酶、乙酰胆碱酯酶、丁酰胆碱酯酶、硝普钠、阿卡波糖,美国 sigma 公司;NaOH、HCl、乙醇等常规化学试剂,均为国产分析纯。
VDHG-9245A 型恒温箱,上海一恒科技有限公司;TDL-5-A 型号低速大容量离心机,上海安亭科学仪器;磁力搅拌器,北京欣维尔玻璃仪器有限公司;HWS12 型电热恒温水浴锅,上海-恒科技有限公司;ZNCL-G190×90 磁力搅拌器,巩义市予华仪器有限责任公司;电热鼓风干燥箱,上海-恒科学仪器有限公司;HY-2 旋涡混匀仪,上海仪电科学仪器股份有限公司;ReadMax1900Plus 型光吸收酶标仪,上海闪普生物科技公司。
1.2 实验方法
1.2.1 桦褐孔菌多糖饮料的制备及感官评价
称取桦褐孔菌多糖 0.15 g,用适量饮用水溶解,加入 0.10 g 西洋参多肽,3g 蜂蜜,3g 白砂糖,再次加入适量的水溶解并定容至 100 mL,在 90℃水浴中加热一小时,在 115℃的高压灭菌锅中灭菌 20min,放在冷水中冷却,即得饮料成品。
由 20 个人组成一个感官评价鉴定小组,采用整体感官的方法,对饮料进行色泽、滋味、口感、组织状态四个方面进行鉴定,满分 100 分。取各评价人员总体分数的平均值作为评定结果。
1.2.2 DPPH 清除实验
参照郭鑫[6]等人的方法,进行 DPPH 清除实验。
1.2.3 ABTS 清除实验
参照欧阳小健[7]的方法,进行 ABTS 清除实验。
1.2.4 α-葡萄糖苷酶的抑制实验
参照文献[8]方法,进行 α-葡萄糖苷酶的抑制实验。
1.2.5 α-淀粉酶的抑制实验
参照文献[9]方法,进行 α-淀粉酶的抑制实验。
1.2.6 乙酰胆碱酯酶的抑制实验
参照文献[10]方法,略有改动。桦褐孔菌多糖饮料样品及盐酸多奈哌齐阳性参比溶液配制均采用双蒸水。配制 0.1 M 的 PBS、1.25 mM DTNB、1.775 mM ATCl 和0.8U/mL 乙酰胆碱酯酶。在 96 孔板中加入 20 μl 样品和 120 μl 0.1M PBS(pH=8.0)、20 μl 0.8U/ mL 乙酰胆碱酯酶于 25℃孵化 15min 后,加入 20 μl 1.775 mM ATCl和 1.25 mM DTNB 于 25℃孵化 5min 记为 A 样品。空白组 20 μl 样品用 20 μl 含双蒸水的 PBS 溶液替换标记为 A 空白。用酶标仪分别在 0min、5min 时于 405 nm 处测定 OD。每份样品平行 3 次,取平均值。以盐酸多奈哌齐作为阳性对照。按下列公式计算抑制率。
1.3 数据处理
利用 SPSS 17.0 软件处理数据来进行差异性显著分析,其中 P<0.05 差异显著;Office excel 2003 软件进行数据处理及绘图,每次试验设计 3 个平行,结果用平均值 ±标准差来表示。
2 结果与分析
2.1 桦褐孔菌多糖饮料的感官评价结果
取各评价人员总体分数的平均值作为评定结果。从表1 中我们可以得到,该饮料的感官评价个项目平均分分别为色泽 18 分、滋味 29 分、口感 28 分和组织状态 19 分,综合平均分为 94 分,感官评价结果较好。

表1 感官评价结果
2.2 桦褐孔菌多糖饮料的活性实验结果
2.2.1 DPPH 清除能力
桦褐孔菌多糖饮料可有效的清除实验体系中的DPPH,Trolox 溶液对 DPPH 的清除效果非常显著,如图1 所示,与 Trolox 相比,饮料在 1~15 μL 时的清除率与其浓度呈剂量依赖关系,随饮料体积的增加,清除率也逐渐升高,7~15 μL 时,清除率显著增加,桦褐孔菌多糖饮体积为 15 μL 时,清除率为 83.15 %。
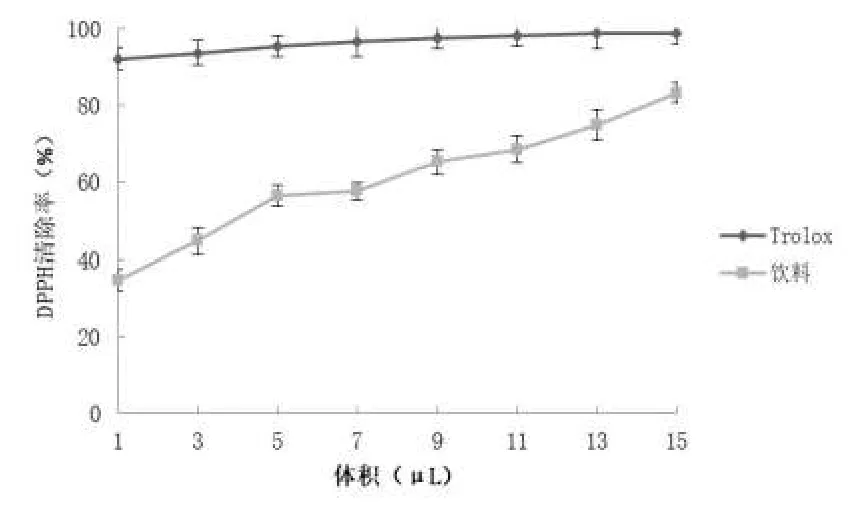
图1 DPPH 清除能力
2.2.2 ABTS 清除能力
当 ABTS 被氧化后会形成稳定的蓝绿色 ABTS 自由基。在该反应体系内存在抗氧化活性成分时,ABTS自由基会与该成分进行反应而被清除,使溶液颜色由深变浅,从而在 734 nm 处的吸光度降低。因此吸光度越低,多糖的抗氧化能力越强,颜色越浅。由图2 可知,小体积饮料的清除自由基能力始终低于 Trolox,但随着饮料体积的增加,清除率不断提高,并显示浓度依赖性。当饮料体积在 8μL 时抑制率达到 77.15 %。表明该多糖饮料具有较好的清除 ABTS 自由基的能力。
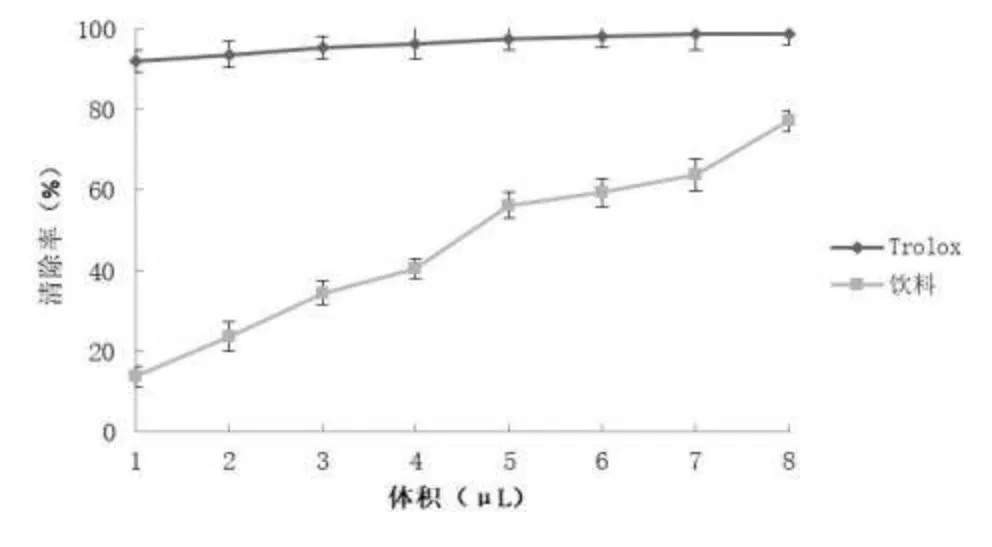
图2 ABTS 清除能力
2.2.3 α-葡萄糖苷酶的抑制作用
从图3 可以看出,不同体积的饮料对 α-葡萄糖苷酶的抑制作用在一定浓度范围内呈现明显的剂量依赖性增长。阿卡波糖通常作为 α-葡萄糖苷酶抑制剂的阳性药,为判断饮料对 α-葡萄糖苷酶抑制效果,本研究选取阿卡波糖为阳性对照,研究不同体积多糖饮料对α-葡萄糖苷酶抑制效果。样品对 α-葡萄糖苷酶抑制率越大,说明样品体外降糖活性越好,即 α-葡萄糖苷酶抑制率与降糖活性呈正相关。由图3 可知,当饮料体积在 4~9μL 范围内,随饮料体积增加 α-葡萄糖苷酶抑制率显著增加,当饮料体积在 9 μL 时,饮料对 α-葡萄糖苷酶抑制率为 48.15%。表明该多糖饮料具有较好的降糖活性。
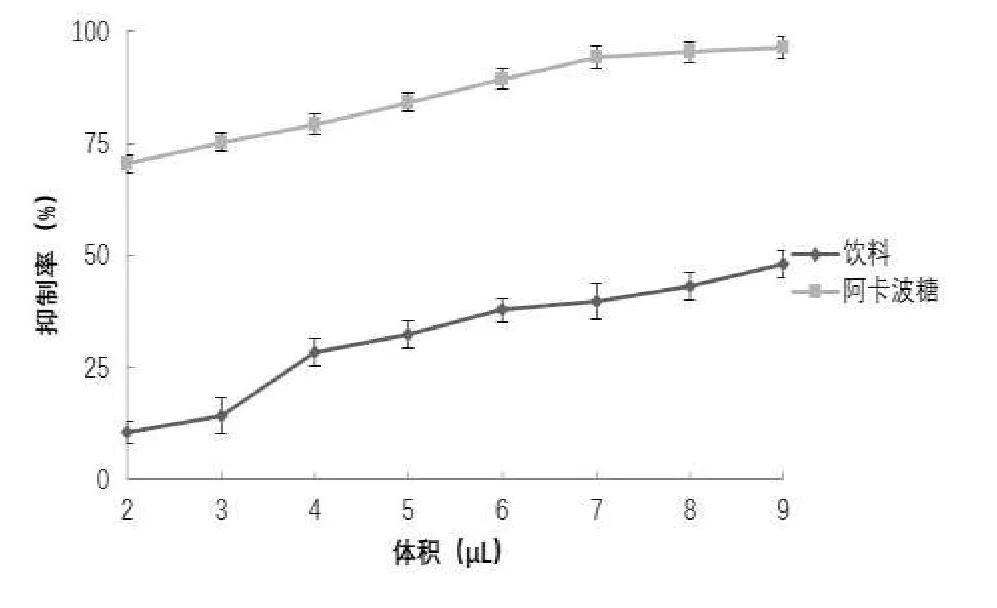
图3 α-葡萄糖苷酶的抑制作用
2.2.4 α-淀粉酶的抑制作用
如图4 所示,随着饮料体积的逐渐增加,多糖饮料抑制 α-淀粉酶活性呈现增长的趋势,抑制率为 12.77%~41%。不同体积饮料对 α-淀粉酶的抑制作用在一定浓度范围内呈现明显的剂量依赖性增长。阿卡波糖通常作为 α-淀粉酶抑制剂的阳性药,为判断饮料对 α-淀粉酶抑制效果,本研究选取阿卡波糖为阳性对照,小体积的饮料对 α-淀粉酶抑制能力始终低于阿卡波糖,研究不同体积多糖饮料对 α-淀粉酶抑制效果。样品对α-淀粉酶抑制率越大,说明样品降糖活性越好,即 α-淀粉酶抑制率与降糖活性呈正相关。由图4 可知,当饮料体积在 4~9 μL 范围内,随饮料体积增加 α-淀粉酶抑制率显著增加,当饮料体积在 9 μL 时,饮料对 α-淀粉酶抑制率为 41.23%。表明多糖饮料具有较好的体外降糖活性。
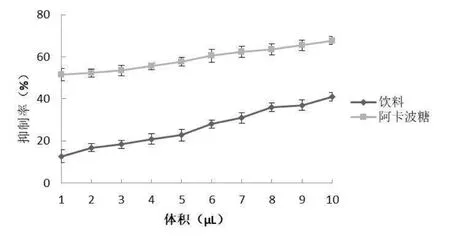
图4 对α-淀粉酶的抑制作用
2.2.5 乙酰胆碱酯酶的抑制
如图5 所示,随着饮料体积的逐渐增加,多糖饮料对乙酰胆碱酯酶的抑制呈增长的趋势,抑制率为62.77%~95%。不同体积饮料对乙酰胆碱酯酶的抑制作用在一定浓度范围内呈现明显的剂量依赖性增长。盐酸多奈哌齐作为乙酰胆碱酯酶抑制剂的阳性药,为判断饮料对乙酰胆碱酯酶抑制效果,研究不同体积多糖饮料对乙酰胆碱酯酶抑制效果。样品对乙酰胆碱酯酶抑制率越大,说明样品抑制胆碱酯酶活性越好。由图5可知,当饮料体积在 1~6 μL 范围内,随饮料体积增加,乙酰胆碱酯酶抑制率显著增加,当饮料体积在 6 μL时,饮料对乙酰胆碱酯酶抑制率为 95%。表明多糖饮料具有较好的抑制乙酰胆碱酯酶的活性。
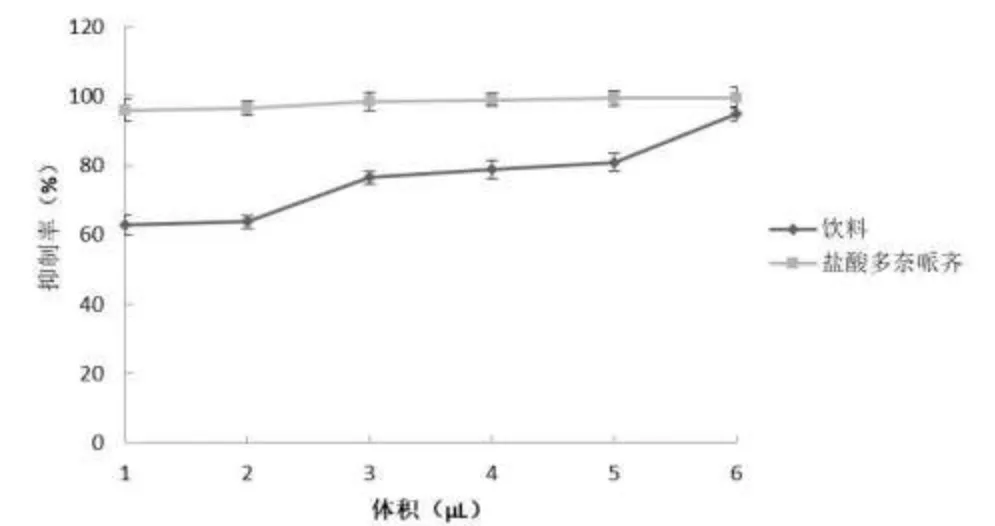
图5 对乙酰胆碱酯酶的抑制作用
3 结论
桦褐孔菌多糖饮料具有较好的感官评价和活性评价结果。桦褐孔菌多糖饮料的 DPPH 清除率、ABTS 清除清除率、α-葡萄糖苷酶、α-淀粉酶以及乙酰胆碱酯酶的抑制率在一定范围内均随着多糖饮料体积的增大而活性增强,表现出较好的体外抗氧化能力、降糖作用及酶抑制活性。本实验中以桦褐孔菌多糖饮料为研究对象,进行了体外抗氧化及酶活性抑制的研究,并未研究其内在的生理功效,可进行更加深入的活性试验研究,进一步开发桦褐孔菌多糖饮料的功效,为今后桦褐孔菌多糖饮料的进一步开发提供理论基础。
