基于网络药理学和分子对接验证探讨黄芪—大黄治疗糖尿病肾病的作用机制
2023-06-28张晶谢伟楠洪玉书刘婧王楚盈李玉梅
张晶,谢伟楠,洪玉书,刘婧,王楚盈*,李玉梅*
(1.长春中医药大学药学院,长春 130117;2.北京中医药大学,北京 100105)
近年来糖尿病患者显著增多,且发病率仍在上升[1]。糖尿病肾病(diabetic kidney disease,DKD)是糖尿病导致的慢性肾脏病(chronic kidney disease,CKD)之一,也是造成终末期肾病(end stage renal disease,ESRD)的主要原因[2]。临床表现为持续性的蛋白尿和肾小球滤过率(eGFR)低于 60 ml·min-1·(1.73 m2)-1[3,4]。中医将 DKD归属为 “消渴症”、“水肿”、“肾衰”等范畴,其会导致阴津损耗,燥热偏盛[5]。核心病理机制主要与虚、浊、泄有关,早期以虚为主,中期为泄,晚期则脾肾阳虚。依据“非重剂无以起沉疴”的理论,善用益气活血降浊方药并加以重剂治疗[6]。目前 DKD 的发病机制复杂,迄今为止尚缺少有力措施来有效控制疾病的发展与恶化。近年来,研究表明中医药在 DKD 的防治研究中有一定进展,其中黄芪及黄芪药对有效成分在抗炎、抗氧化、调节糖脂代谢、调节线粒体功能等方面体现出较好疗效[7]。大黄始载于 《神农本草经》,药理活性广泛,其活性成分为蒽醌类,预计可对自身免疫性疾病(如1 型糖尿病、IgA 肾病等)有良好的疗效[8]。网络药理学为研究提供了一个可以深入挖掘中药多个靶点治疗多种疾病协同效应的平台,可用于中药及其相互作用机理的研究[9,10]。
有鉴于此,本研究利用网络药理学方法来构建 “黄芪-大黄药对-有效组分-交集靶点”网络图,进一步探讨黄芪-大黄药对抗 DKD 的作用机制,为其进一步的深入研究提供理论基础。
1 资料与方法
1.1 黄芪-大黄药对有效活性组分及靶点的收集与筛选
通过 TCMSP(https://old.tcmspe.com/)数据库检索黄芪、大黄的相关作用靶点。中药成分复杂多样,为筛选出对人体有益的物质,按照药动学的原则[11](吸收、分布、代谢和排泄),即口服利用率(OB)≥30%、类药性(DL)≥0.18,筛选出满足要求的有效组分和对应的靶点目标。同时,下载 UniProt 数据库(https://www.uniprot.org/)中 Reviewed 和 Human 的相关基因,把筛选出的黄芪-大黄药对的有效组分转化为相应的 Gene symbol,即将蛋白靶点转化为基因靶点。
1.2 糖尿病肾病相关靶点基因获取
利用 GeneCards[12]、OMIM[13]、Drugbank[14]数据库以“diabetic kidney disease”为关键词检索出与糖尿病肾病有关的基因靶点集,然后对三个数据库中的基因靶点进行合并和去重,最终作为黄芪-大黄药对活性成分治疗糖尿病肾病的疾病靶点。
1.3 药对-有效组分-交集靶点网络图构建
为深入探索黄芪-大黄药对的有效组分与糖尿病肾病靶点之间的作用关系,现将最终获取的 DKD 靶点,分别与黄芪和大黄中经 ADME 筛选后的相关作用靶点进行重复项筛选,得交集靶点,利用 Cytoscape3.7.0 软件建立“黄芪-大黄药对-有效组分-交集靶点”的可视化网络图,各个节点分别代表药对、有效组分、交集靶点,所有节点之间的关系可直接显示出来,并对各靶点的相关参数进行分析。
1.4 PPI 互作网络图的构建及其关键靶点的筛选
将上述所得的药对和疾病交集靶点上传至STRING 数据库 (https://www.string-db.org/),构建 PPI 互作网络图,可得到相关蛋白质信息,利用 Cytoscape 3.7.0 软件根据度值筛选关键靶点,同时分析关键靶点蛋白。
1.5 GO 功能及 KEGG 通路富集分析
富集分析是将目标基因与基因数据库中数千个基因数据集进行比较的过程,是目标基因参与特定的生物过程、蛋白质注释、基因功能或基因的其他特征。为了更进一步探究黄芪-大黄药对治疗糖尿病肾病的作用机制,将用于治疗糖尿病肾病的黄芪-大黄药对相关靶点导入到 Metascape 数据库(https://metascape.org/)中,即所有的靶点基因都被导入到基因列表中,物种定义为 “Homo Sapiens”,选择 “Custom Analysis”。通过上述数据库分别进行生物过程 (biological process)、分子功能(molecular function) 和细胞组分(cellular component)、KEGG Pathway 富集分析。再使用在线作图网站微生信(http://www.bioinformatics.com.cn/)将结果可视化。
1.6 分子对接验证
利用 uniprot 数据库和 PDB 数据库(https://www.rcsb.org/)导入关键靶点信息得到蛋白受体 PDB 文件,再导入 Pymol 软件去水、去残基,得到 PDB 格式的大分子蛋白受体文件。利用 Tcmsp 数据库和 Pubchem 数据库导入有效成分信息得到配体 SDF 的 2D 结构文件,再导入 Chem3D 软件优化为 3D 结构,得到 mol 2格式的小分子配体文件。采用 AutoDock 软件并运用Grid 和 Docking 模块进行蛋白与配体对接,最后利用Pymol 软件对分子对接结果进行可视化分析。
2 结果
2.1 黄芪-大黄药对有效活性组分及靶点
从 TCMSP 数据库中搜索出 87 个黄芪有效组分、92 个大黄有效组分,然后根据 ADME(OB≥30%和DL≥0.18)进行筛选,最终得到 20 个黄芪有效组分、16个大黄有效组分,共 36 个有效活性组分,详见表1,对应的黄芪靶点 333 个、大黄靶点 70 个,合并去重后得到 175 个靶点。
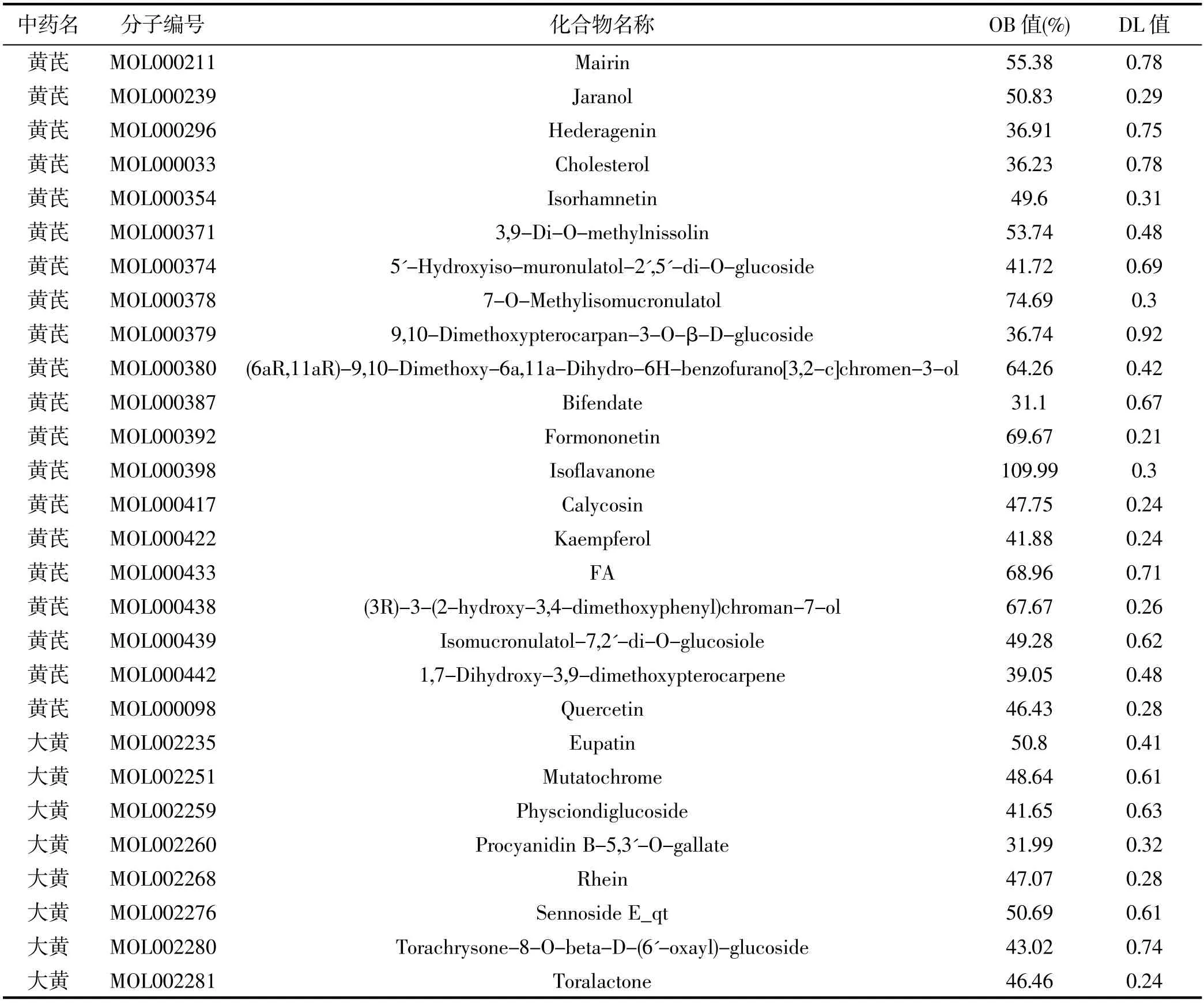
表1 黄芪-大黄药对的活性组分
2.2 交集靶点 PPI 网络分析
以“diabetic kidney disease”为关键字,在GeneCards、OMIM、Drugbank 数据库中进行筛选,去重后得到了 3501 个疾病基因靶点。将黄芪-大黄药对和疾病靶点进行了映射,获得 136 个交集靶点。基于STRING 数据库得到蛋白质交互数据,建立 PPI 网络图,详见图1。利用 Cytoscape3.7.0 的拓扑结构,从共同靶点序列中筛选出前 25 个关键性的靶点,包括AKT1、TP53、TNF 等,建立关键靶点的 PPI 网络图,详见图2。
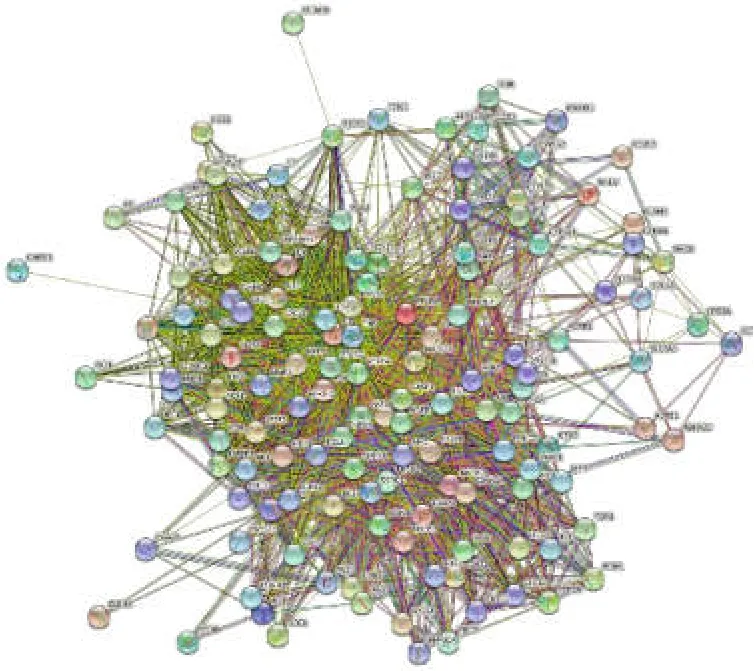
图1 交集靶点蛋白网络互作图
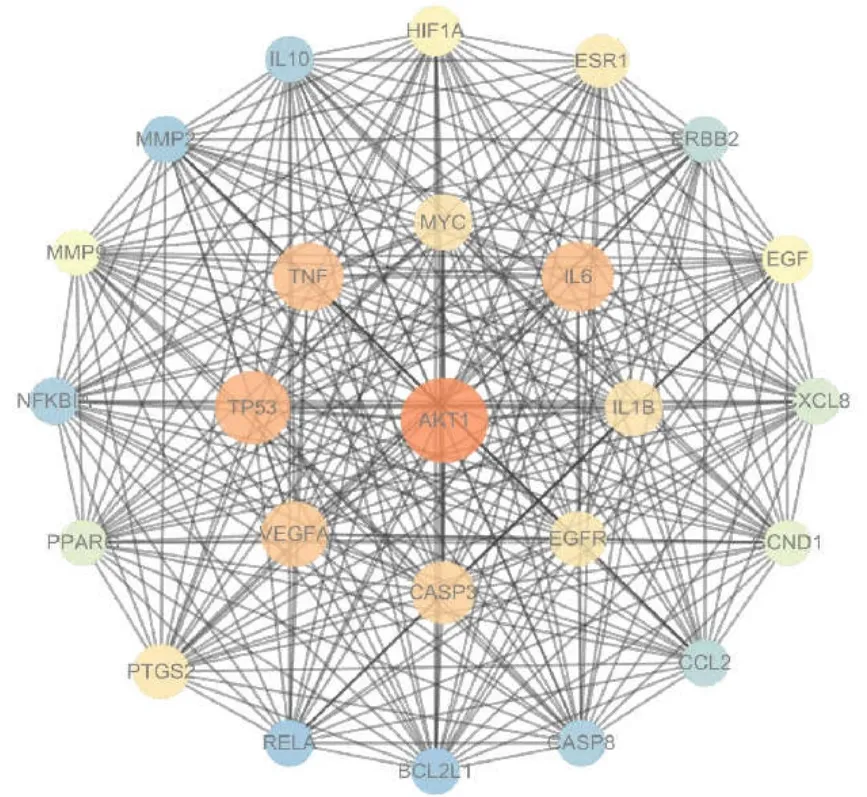
图2 关键交集靶点蛋白网络互作图
2.3 药对-有效组分-交集靶点网络图分析
网络图中包括药物节点 2 个、有效组分节点 23 个(黄芪有效成分节点 16 个、大黄有效成分节点 7 个)、交集靶点节点 354 个,共 379 个节点,详见图3。由网络图分析结果可知,根据 Degree 值,药对治疗糖尿病肾病可能与槲皮素 (quercetin)、山奈酚 (kaempferol)、7-O-甲基异丙醇胺(7-O-methylisomucronulatol)、β-谷甾醇(beta-sitosterol)、芒柄花黄素(formononetin)等有效成分有关;发挥重要作用的交集靶点可能为 AKT1、TP53、TNF、IL-6、VEGFA 等;其中有效成分槲皮素以及交集靶点 AKT1 有较多的连接边数,发挥作用重要。

图3 药对-有效组分-交集靶点网络
2.4 GO 功能与 KEGG 通路富集分析结果
2.4.1 GO 功能富集分析结果
利用 Metascape 数据库进行 GO 功能富集分析,进一步明确交集靶点的可能作用,根据基因富集数目与显著程度,筛选出前 10 名,通过微生信绘制 GO 三合一条形图,详见图4。生物学过程主要涉及对无机物的反应,对活性氧类的反应,对氧化应激的反应,对金属离子的反应,细胞对活性氧类的反应,对镉离子的反应等;细胞组分主要涉及薄膜筏,膜微结构域,细胞膜穴样内陷,质膜信号受体复合体,囊泡腔等;分子功能主要涉及 DNA 结合转录因子结合,转录因子结合,转录调控物结合,类固醇激素受体活性,核受体结合等。
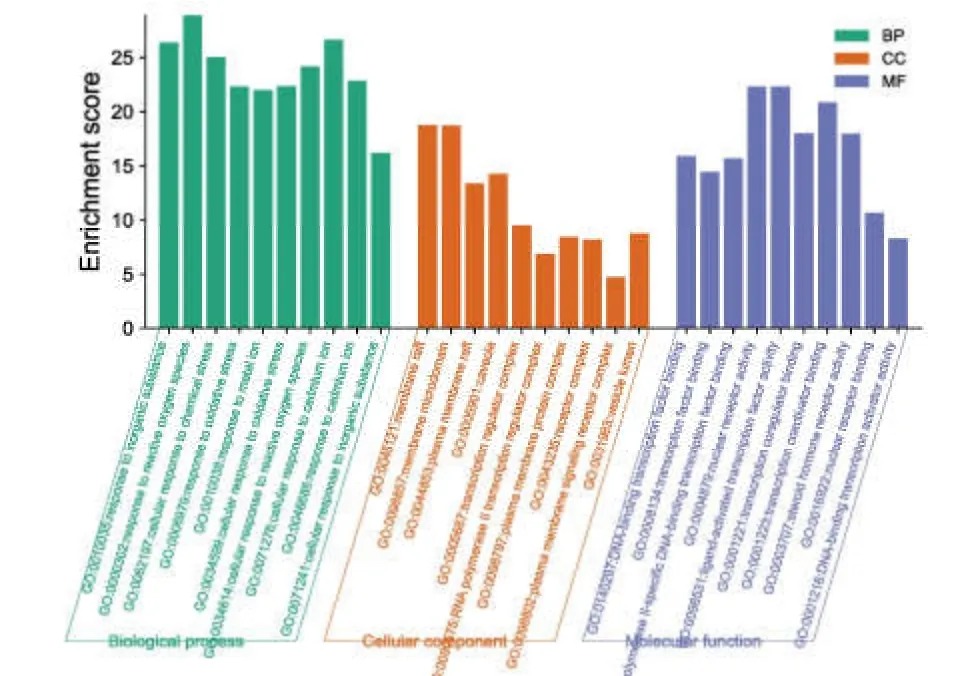
图4 黄芪-大黄药对治疗DKD 的核心靶点GO功能三合一柱状图
2.4.2 KEGG 通路富集分析结果
利用 Metascape 数据库中的 KEGG Pathway 富集分析,根据治疗糖尿病肾病相关靶点以及相应 P 值,从前 50 条通路中筛选出评分较高的 10 条通路,同时通过微生信网站绘制气泡图进行可视化处理,详见图5。通路富集分析结果显示,主要涉及 PI3K-Akt、丝裂原活化蛋白激酶、IL-17、肿瘤坏死因子、Ras、Toll 样受体、Nf-kappa B、FoxO、JAK-STAT、糖尿病并发症中的衰老等信号通路。

图5 黄芪-大黄药对治疗DKD 的核心靶点KEGG 通路富集分析
2.5 分子对接结果分析
根据 Degree 值将主要有效成分槲皮素、山奈酚、7-O-甲基异丙醇胺、β-谷甾醇和关键作用靶点 AKT1、TP53、TNF 进行分子对接验证,结果见表2,表明主要活性成分与关键蛋白受体具有良好的稳定性[15,16],其中槲皮素、山奈酚与 TNF 的结合能,β-谷甾醇与 AKT1、TNF 的结合能均低于-7kcal/mol[15],表明这几者配体受体之间对应的结构更为稳定,绘制的部分分子对接模式图见图6、图7。
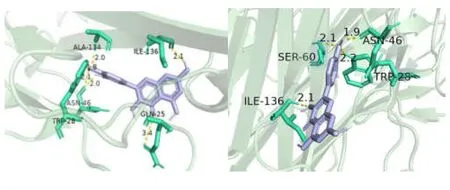
图6 由左至右依次为槲皮素、山奈酚与TNF 的分子对接图
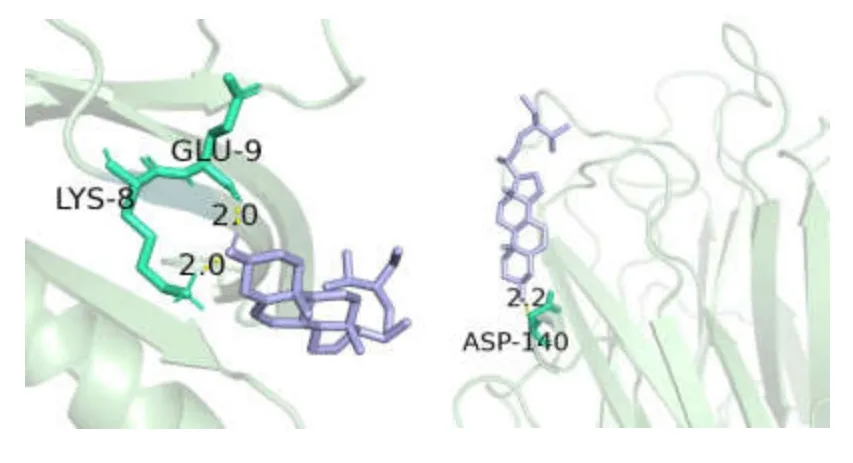
图7 由左到右依次为β-谷甾醇与AKT1、TNF 的分子对接图
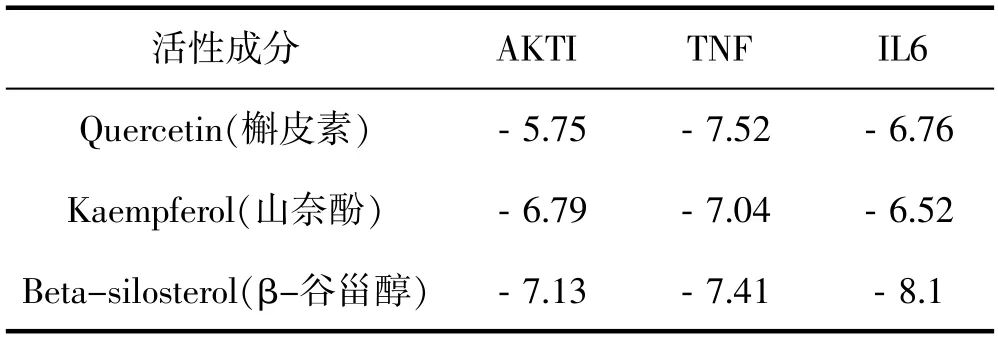
表2 黄芪-大黄药对主要活性成分与关键靶点蛋白最低结合能(kcal/mol)
3 小结与讨论
目前,糖尿病肾病的病因及作用机制比较复杂,至今仍不能完全明确且有效控制疾病的发展与恶化。本文基于网络药理学方法,构建药对-有效组分-交集靶点网络、靶蛋白 PPI 网络、药对-组分-靶点-通路网络等网络图,对黄芪-大黄药对治疗糖尿病肾病的分子机制进行预测分析,为黄芪-大黄药对的深入研究提供理论依据。
药物-成分-靶点-通路的网络图分析表明,槲皮素、山奈酚、7-O-甲基异丙醇胺、β-谷甾醇、芒柄花黄素等有效活性组分 Degree 值较高,在治疗过程中可能发挥重要作用。其中,槲皮素可以改善糖尿病大鼠血脂紊乱和氧化应激水平,提高机体抗氧化能力,能够下调 TGF-β1、上调 Smad7 信号通路的传导,从而发挥改善肾脏纤维化和肾小动脉硬化的作用,有效延缓糖尿病肾病的进展[17]。山柰酚通过降低血糖,维持正常血脂水平,还可以通过抗氧化、抗炎、抑制醛糖还原酶途径,从而对 2 型糖尿病大鼠的心脑血管等慢性并发症起到保护作用[18]。Β-谷甾醇通过调控 IκB 激酶β (IKKβ)/核转录因子-κB (nuclear factor-kappa B,NF-κB)和 c-Jun 氨基末端激酶 (c-Jun N-terminal kinases,JNK)通路信号转导,缓解脂肪组织炎性反应而发挥良好的抗胰岛素抵抗和血糖调节作用,对不同诱因引起的 2 型糖尿病均有较好的临床疗效[19]。芒柄花黄素对链脲佐菌素诱导的糖尿病小鼠认知功能障碍、氧化损伤具有改善作用[20],7-O-甲基异丙醇胺上有治疗 DKD 的关键靶点。
PPI 网络拓扑学分析表明,AKT1、TP53、TNF、IL-6、VEGFA 等为黄芪-大黄药对治疗 DKD 的潜在作用关键靶点。研究表明,AKT1,也被称为蛋白激酶 B,是下游胰岛素信号通路的一个重要靶点,可以防止胰岛素受体的去磷酸化,控制葡萄糖运输途径[21],并在海马神经元的生长和生存中发挥重要的调节作用[22]。TP53,也被称为 p53,是一个参与多个代谢途径的致癌基因,包括葡萄糖[23],醛糖还原酶通过激活 TP53 导致了糖尿病介导功能障碍和线粒体损伤[24]。肿瘤坏死因子 TNF 是糖尿病视网膜病变研究的一个重要目标,它大量参与了 II 型糖尿病的生理和病理过程,TNF 的过度表达与胰岛素抵抗 (IR)的程度呈正相关[25]。白细胞介素-6(IL-6)是一种与糖尿病密切相关的炎症性因子,它参与血管生成,介导炎症反应,促进伤口愈合并改善血液流通[26]。血管内皮生长因子 A(VEGFA)属于VEGF 家族,通过诱导内皮细胞生长、促进细胞迁移、抑制细胞凋亡和增加血管通透性,在血管生成、肿瘤生长和缺血性疾病中发挥着重要作用[27]。
GO 功能和 KEGG 途径富集的分析表明,黄芪-大黄药对可能通过作用于丝裂原活化蛋白 (MAPK)、肿瘤坏死因子(TNF)、IL-17、PI3K-Akt、糖尿病并发症中的衰老 (AGE-RAGE)等信号通路来干预和治疗DKD。其中,AGE-RAGE 信号通路参与了包括胰岛素在内的各种内分泌细胞的凋亡和功能障碍,T2D 后期糖基化产物 (AGEs)与它们的 RAGE 受体结合,导致胰岛细胞凋亡,这引发了一系列的细胞内信号传导,使内皮细胞损伤加速,进而引发 2 型糖尿病的并发症[28]。白细胞介素-17(IL-17)家族是由 IL-17A-F 组成的细胞因子亚群,IL-17 在急性和慢性炎症反应中起着重要作用,它可以调节肾脏组织的氧化应激,并通过增加AMP 蛋白激酶水平来调节炎症反应,还在治愈或逆转糖尿病肾病方面发挥着重要作用[29]。TNF 信号通路通过调节 TNFα 水平,可以缓解胰岛素抵抗,从而引起脂肪和周围组织的炎性反应[30]。MAPK 信号通路与糖尿病患者的高血糖、氧化应激及生长因子等因素有关,有发展慢性糖尿病并发症的可能性。因此,未来治疗慢性糖尿病疾病的一个新概念是使 MAPKs 失活或阻断 MAPK信号通路[31]。磷脂酰肌醇 3-激酶 (PI3K)/蛋白激酶 B(AKT)信号通路是调节血糖水平和胰岛素信号的重要途径,这一信号通路的异常会影响相应组织和器官的细胞增殖、凋亡、转移和侵袭,导致疾病的发生[32]。然而,关于黄芪-大黄药对通过影响这些信号通路来调控糖尿病肾病的文献报道较少,因此未来需要进行实验证实这些信号通路。此外,生物过程和信号通路都是由多个基因靶点共同参与或调控的,说明了中医药具有多成分、多靶点、多通路的特点。
综上所述,黄芪-大黄药对可能通过槲皮素、山奈酚、7-O-甲基异丙醇胺、β-谷甾醇、芒柄花黄素等有效活性成分,作用于 AKT1、TP53、TNF、IL-6、VEGFA等靶点,通过干预糖尿病并发症中的衰老、肿瘤坏死因子、IL-17、PI3K-Akt、丝裂原活化蛋白激酶等信号通路机制,来实现治疗 DKD 的目的。在这项研究中,利用网络药理学方法对黄芪-大黄药对的化学成分和作用靶点以及对 DKD 作用机制进行了探索性研究。结果表明,对多种成分、靶点和途径的作用,是黄芪-大黄药对治疗 DKD 的优势所在,也为后续的细胞和动物研究以及新的临床药物开发和应用提供了思路和理论基础。
