苍术素对非小细胞肺癌细胞上皮间质转化的影响及机制研究
2023-06-28朱亚兰吕世文曾晨欣徐媛青
朱亚兰 吕世文 曾晨欣 徐媛青
非小细胞肺癌(non-small-cell lung cancer,NSCLC)是肺癌的主要病理类型,发病率与病死率较高,晚期NSCLC 患者多采取放疗或化疗的治疗方式,但长期使用化疗药物的患者易发生耐药性,影响患者预后,因此进一步寻找有效治疗药物对改善患者预后具有重要意义[1-2]。苍术素(atractylodin,ATR)是从苍术中提取的有效成分,具有降血糖、抗炎、促胃排空、利尿等作用,研究显示,ATR 在肝癌、胆管癌中具有抗肿瘤活性,如通过抑制磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(phosphatidylinositol-3-kinase/protein kinase B/mammalian target of rapamycin,PI3K/Akt/mTOR)通路和p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)信号通路抑制胆管癌细胞增殖并诱导胆管癌细胞自噬[3-4]。Janus 激酶2/信号转导子与转录激活子3(Janus kinase 2/signal transducer and activator of transcription 3,JAK2/STAT3)通路在肿瘤的转移与侵袭及肿瘤耐药中发挥重要作用,抑制JAK2/STAT3 信号通路的激活可抑制肺癌细胞的增殖与侵袭[5-6]。目前,关于ATR 影响NSCLC 细胞耐药及其机制的研究尚未见报道。本研究探索ATR 对NSCLC 细胞上皮间质转化(epithelial mesenchymal transformation,EMT)的影响及可能的作用机制,为其用于NSCLC 的治疗提供理论依据。
1 材料和方法
1.1 材料
1.1.1 细胞及培养 人NSCLC 细胞HCC827(批号:CTCC-400-0172)购于浙江美森细胞科技有限公司;在含10% FBS、1%青-链霉素的DMEM 培养基中常规培养,细胞融合至80%时,消化细胞并传代培养。每2 d更新培养液。
1.1.2 主要试剂 ATR(纯度≥98%)粉剂购自成都植标化纯生物技术有限公司,批号:PCS0115,用二甲基亚砜溶解,配制成400.0 μmol/L 的母液,备用;CCK-8试剂盒购自北京普利莱基因技术有限公司,批号:E1008-1000;STAT3 激活剂Colivelin 购自MCE 公司,批号:HY-P1061A;兔抗人上皮型钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、锌指蛋白转录因子(Snail)1 购自Santa Cruz 公司,批号分别为sc-71008、sc-59987、sc-393172);RIPA 裂解液、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰氨凝胶电泳(polyacrylamide gel electrophoresis,PAGE)凝胶配置试剂盒购自碧云天生物科技有限公司,批号为P0013B 和P0012A;磷酸化JAK2(p-JAK2)、JAK2、磷酸化STAT3(p-STAT3)、STAT3、β-肌动蛋白(β-actin)抗体购自碧云天生物科技有限公司,批号分别为AF1486、AF1489、AF1495、AF1492 和AF5003。
1.2 方法
1.2.1 细胞存活率检测 取对数生长期细胞以1×104/孔的密度接种于96 孔板中。分别加入10.0、20.0、40.0、80.0、160.0 μmol/L 的ATR 处理24、48、72 h,根据CCK-8 检测试剂盒方法检测细胞生长情况,测定450 nm 处吸光度值,并计算细胞存活率。
1.2.2 细胞处理及分组 将对数生长期细胞分为对照组、ATR 药物低、中、高浓度组(ATR-L 组、ATR-M 组、ATR-H 组)、ATR+Colivelin 组,ATR-L 组、ATR-M 组、ATR-H 组分别使用10.0、20.0、40.0 μmol/L 的ATR 处理24 h,ATR+Colivelin 组 使 用40.0 μmol/L 的ATR 与0.5 μmol/L 的Colivelin 共同处理24 h,对照组仅加入等量的二甲基亚砜。
1.2.3 细胞划痕实验 取各组细胞稀释为1×105/ml的细胞悬液,取2 ml 加入6 孔板中,待细胞长满培养皿,使用20 μl 移液枪头在细胞层上进行划痕,PBS 洗去不贴壁的细胞,更换无血清培养基培养24 h,显微镜下观察并测量划痕宽度,计算划痕愈合率。
1.2.4 细胞侵袭实验 取各组细胞使用无血清稀释成2×105/ml 的细胞悬液,Transwell 小室铺稀释Matrigel 基质胶,待胶干后,上室加入100 μl 细胞悬液,下室加入含10%FBS的培养液,培养24 h。使用甲醛固定20 min,结晶紫染色,显微镜下随机选取5 个视野,观察侵袭细胞,计算平均每个视野的侵袭细胞数。
1.2.5 EMT 相关蛋白表达的检测 采用Western blot法。收集各组细胞,加入RIPA 裂解液提取总蛋白,检测蛋白浓度,SDS-PAGE 电泳分离蛋白并转膜,5%的脱脂奶粉封闭1 h,分别加入E-cadherin、N-cadherin、Snail1、p-JAK2、JAK2、p-STAT3、STAT3 和βactin 抗体稀释液,4 ℃孵育过夜,洗膜后加入二抗室温孵育2 h,显影并拍照,以β-actin 为内参,Imge J 软件分析蛋白相对表达水平。
2 结果
2.1 不同浓度ATR 处理对细胞存活率的影响 随ATR 浓度升高,细胞存活率呈逐渐降低趋势;培养24 h,HCC827 细胞培养半数抑制浓度为(63.51±1.15)μmol/L。因此选择浓度为10.0、20.0、40.0 μmol/L 的ATR 进行后续实验,见图1。

图1 不同浓度ATR 处理对细胞存活率的影响
2.2 ATR 对细胞迁移与侵袭的影响 与对照组比较,ATR-L 组、ATR-M 组、ATR-H 组细胞划痕愈合率显著降低,侵袭细胞数显著减少,差异均有统计学意义(均P<0.05);随ATR 浓度 升 高,ATR-L 组、ATR-M 组、ATR-H 组细胞划痕愈合率逐渐降低,侵袭细胞数逐渐减少,呈药物浓度依赖性(P<0.05);与ATR-H 组比较,ATR+Colivelin 组细胞划痕愈合率显著升高,侵袭细胞数显著增加,差异均有统计学意义(均P<0.05),见表1。
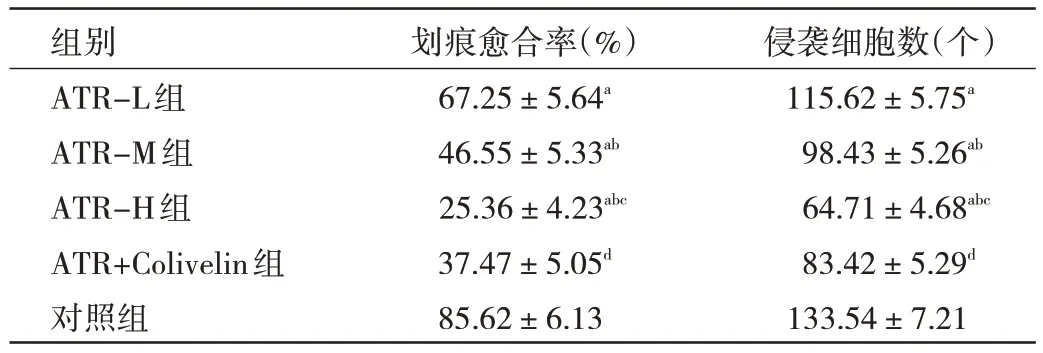
表1 ATR 对细胞迁移及侵袭的影响
2.3 ATR 对细胞EMT 相关蛋白表达的影响 与对照组比较,ATR-L 组、ATR-M 组、ATR-H 组E-cadherin 蛋白相对表达水平均显著升高,N-cadherin、Snail1 蛋白相对表达水平均显著降低,差异均有统计学意义(均P<0.05);随ATR 浓度升 高,ATR-L 组、ATR-M 组、ATR-H 组E-cadherin 蛋白相对表达水平逐渐升高,Ncadherin、Snail1 蛋白相对表达水平逐渐降低,呈药物浓度依赖性(P<0.05);与ATR-H 组比较,ATR+Colivelin 组E-cadherin 蛋白相对表达水平显著降低,Ncadherin、Snail1 蛋白相对表达水平显著升高,差异均有统计学意义(均P<0.05),见图2。
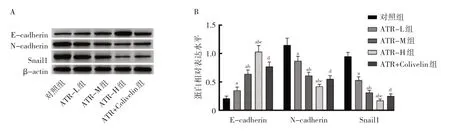
图2 ATR 对细胞EMT 相关蛋白表达的影响(A:电泳图;B:EMT 相关蛋白相对表达水平)
2.4 ATR 对细胞JAK2/STAT3 通路相关蛋白表达的影响 与对照组比较,ATR-L 组、ATR-M 组、ATR-H 组p-JAK2/JAK2、p-STAT3/STAT3 蛋白相对表达水平均显著降低,差异均有统计学意义(均P<0.05);随ATR浓度 升高,ATR-L 组、ATR-M 组、ATR-H 组p-JAK2/JAK2、p-STAT3/STAT3 蛋白相对表达水平逐渐降低,呈药物浓度依赖性(P<0.05);与ATR-H 组比较,ATR+Colivelin 组 细 胞p-JAK2/JAK2、p-STAT3/STAT3蛋白相对表达水平均显著升高,差异均有统计学意义(均P<0.05),见图3。
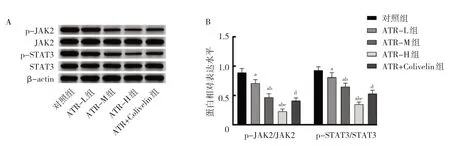
图3 ATR 对细胞JAK2/STAT3 通路相关蛋白表达的影响(A:电泳图;B:JAK2/STAT3 通路相关蛋白相对表达水平)
3 讨论
肺癌表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变阳性率较高[7-8],吉非替尼为治疗EGFR 基因突变肺癌的一线药物,但患者易产生耐药性,从而影响治疗效果[9-10]。耐药已成为NSCLC治疗的主要难题,因此寻找新的治疗药物对于改善NSCLC 患者预后具有重要意义[11-12]。研究显示NSCLC的耐药与细胞EMT 有关,抑制EMT 可逆转NSCLC 耐药性[13-14]。
ATR 具有抗炎、抗菌、抗肿瘤和免疫调节等多种药理活性[15-17]。研究显示,ATR 可通过抑制P13K/Akt/mTOR 通路抑制乳腺癌细胞增殖,诱导氧化应激介导的细胞凋亡和自噬[18]。在肺癌中,ATR 通过调节活性氧介导的信号通路抑制肺癌细胞增殖、迁移,诱导细胞周期停滞与细胞凋亡[19]。以上研究表明ATR 对肺癌有一定抗肿瘤活性。本研究显示,10.0~160.0 μmol/L的ATR 均可显著抑制NSCLC HCC827 细胞增殖,与报道结果类似。NSCLC 细胞迁移和侵袭能力增加是肿瘤转移及病情恶化的重要原因之一[20-21],本研究显示使用10.0、20.0、40.0 μmol/L 的ATR 处理HCC827 可显著抑制细胞迁移与侵袭,且呈药物浓度依赖性,表明ATR 在NSCLC 中表现为抗肿瘤性,与先前报道结果类似。E-cadherin、N-cadherin、Snail1 是EMT 标志物,Ecadherin 可维持细胞间黏附作用,N-cadherin 可促进细胞的迁移,发生EMT 时N-cadherin、Snail1 上调表达,E-cadherin 下调表达[22-23]。抑制NSCLC 细胞EMT 可显著抑制肿瘤恶性进展与耐药性[24]。本研究结果显示,使用ATR 可显著上调E-cadherin 表达,下调N-cadherin、Snail1 蛋白表达,提示ATR 可抑制NSCLC 细胞增殖、迁移、侵袭和EMT。
为进一步阐明ATR 抑制NSCLC 细胞增殖、迁移、侵袭的作用机制,本研究检测JAK2/STAT3 通路相关蛋白磷酸化水平。JAK2/STAT3 信号通路在参与调节细胞增殖、凋亡方面发挥重要作用,与肿瘤发生、发展密切相关,同时该通路还参与免疫调节和炎性反应过程[25-26]。JAK2 的 活 化 可 促 进STAT3 磷 酸 化,JAK2/STAT3 通路的激活可促进肿瘤细胞迁移、侵袭与EMT[27-28]。JAK2/STAT3 通路还与肿瘤耐药性有关,在肺癌中,β-榄香烯可能通过抑制JAK2/STAT3 信号通路激活,抑制肿瘤细胞增殖,诱导凋亡,降低肺癌细胞对紫杉醇的耐药性[29]。Chae 等[30]发现,ATR 可抑制JAK2、STAT3 的磷酸化,降低佛波醇12-肉豆蔻酸酯-13-乙酸酯诱导的人肥大细胞中的IL-6 水平。另有研究显示,在胆管癌细胞系CL-6 中,ATR 以剂量依赖性和时间依赖性方式抑制STAT3 蛋白磷酸化,从而抑制CL-6 细胞的增殖和迁移[31]。本研究结果表明,ATR 可抑制NSCLC 细胞JAK2、STAT3 蛋白磷酸化水平,且呈药物浓度依赖性,提示ATR 具有抑制JAK2/STAT3 通路激活的作用;给予STAT3 激活剂Colivelin 后,ATR 对JAK2、STAT3 蛋白磷酸化水平的抑制作用减弱,同时细胞增殖、迁移和侵袭能力增强,证实ATR 对NSCLC细胞增殖、迁移、侵袭与EMT 的抑制作用可能是通过抑制JAK2/STAT3 通路活化实现的。
综上所述,ATR 通过抑制JAK2/STAT3 通路抑制NSCLC 细胞增殖、迁移与EMT,ATR 在NSCLC 中的抗肿瘤活性仍需结合动物模型进行更深入的研究。
