膀胱癌组织中miR-144、肺癌转移相关转录本1及睾丸蛋白聚糖表达及其诊断价值
2023-06-26梁博何跃刘泓键奉友刚何俊
梁博 何跃 刘泓键 奉友刚 何俊
膀胱癌复发率高,了解膀胱癌发病机制,寻找相关标志物对其早期诊断及治疗有积极意义[1]。膀胱癌病人中多种miRs表达异常,其中miR-144在人体7号染色体中,与肿瘤发生、发展密切相关。有研究显示,膀胱癌病人血清miR-144水平降低,且与病人临床病理特征有关[2-3]。肺癌转移相关转录本1(metasis-associatedlung adenoearcinoma transcript 1,MALA T1)首次发现于非小细胞肺癌中,近年来进一步证实了在多种肿瘤及疾病发生过程中可见MALA T1参与,其与肿瘤的侵袭性、转移等行为紧密相关[4]。睾丸蛋白聚糖(SPOCK1)是与膀胱癌密切相关的癌基因 ,下调SPOCK1的表达能够使膀胱癌细胞的增殖、细胞周期、侵袭均发生停滞[5]。本研究检测膀胱癌组织中miR-144、MALAT1及SPOCK1表达,探讨三者在膀胱癌中的诊断价值。
对象与方法
一、对象
2018年1月~2021年1月本院收治的膀胱癌病人96例,男72例,女24例,年龄39~79岁,平均年龄(48.69±7.54)岁。中高分化69例,低分化27例;淋巴结转移38例;肿瘤TNM分期Ⅰ~Ⅱ期72例,Ⅲ~Ⅳ期24例。手术留取膀胱癌病人新鲜肿瘤组织(肿瘤组)及距离肿瘤边缘>2 cm癌旁正常组织(癌旁组)各5 mg。术后依据自身情况辅助化疗,通过电话和门诊随访等方式进行随访,随访截止2022年1月30日。根据病人预后情况分为预后良好组与预后不良组。复发定义为尿道镜检查提示尿道(前列腺部尿道已切除)存在异常肿物,且病理检查最终证实为尿路上皮癌。纳入标准:(1)临床资料完整;(2)病人术前活检标本或膀胱电切或膀胱根治性切除术术中/后送检,经病理诊断,符合《欧洲肿瘤医学协会膀胱癌诊断、治疗和随访实践指南》中膀胱尿路上皮癌相关诊断及分期标准[6];(3)均签署知情同意书;(4)无其他恶性肿瘤病史;(5)入院前未接受相关治疗;(6)术前活检标本或术中/后送检,经病理诊断证实。排除标准:临床资料缺失;妊娠期或哺乳期妇女;合并间质性膀胱炎、神经源性膀胱;有严重泌尿系统疾病、自身免疫性疾病、精神障碍。
二、方法
1.miR-144、MALAT1及SPOCK1的检测:术中将病灶组织切除,同时保留部分离癌组织>2 cm位置的正常组织,将获得标本做成5 mm×5 mm小块,清洗后放置于甲醛溶液浸泡。miR-144、MALAT1及SPOCK1均采用荧光实时定量聚合酶链式反应(Polymerase chain reaction,PCR)法进行检测,使用TRIzol总RNA试剂盒(北京天根公司)提取样本总RNA,使用反转录仪将总RNA反转录为cDNA。反转录反应结束后,使用PCR分析仪行实时荧光PCR检验,采用Opticon Monitor软件分析PCR反应结果并计算循环阈值(cycle threshold,Ct),2-ΔΔCt法计算目标RNA的相对表达量。中△Ct=Ct目标基因-Ct内参基因,△△Ct=△Ct检测样品-△Ct基准样品。
2.观察指标:比较肿瘤组与癌旁组miR-144、MALAT1及SPOCK1相对表达量;对比miR-144、MALAT1及SPOCK1在不同膀胱癌临床病理特征中表达情况,如临床分期、分化程度、淋巴结转移等,计算miR-144、MALAT1、SPOCK1对膀胱癌诊断效果。
三、统计学方法
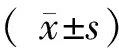
结果
1.肿瘤组与癌旁组miR-144、MALAT1及SPOCK1相对表达量比较:肿瘤组MALAT1及SPOCK1相对表达量高于癌旁组,miR-144相对表达量低于癌旁组,差异有统计学意义(P<0.05)。见表1。
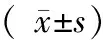
表1 肿瘤组与癌旁组miR-144、MALAT1及SPOCK1相对表达量比较
2.miR-144、MALAT1及SPOCK1在不同膀胱癌临床病理特征中表达情况:Ⅲ~Ⅳ期、有淋巴结转移者miR-144表达明显低于Ⅰ~Ⅱ期、无淋巴结转移者;Ⅲ~Ⅳ期、低分化、有淋巴结转移者MALAT1、SPOCK达明显高于Ⅰ~Ⅱ期、中高分化与无淋巴结转移者(P<0.05),见表2。
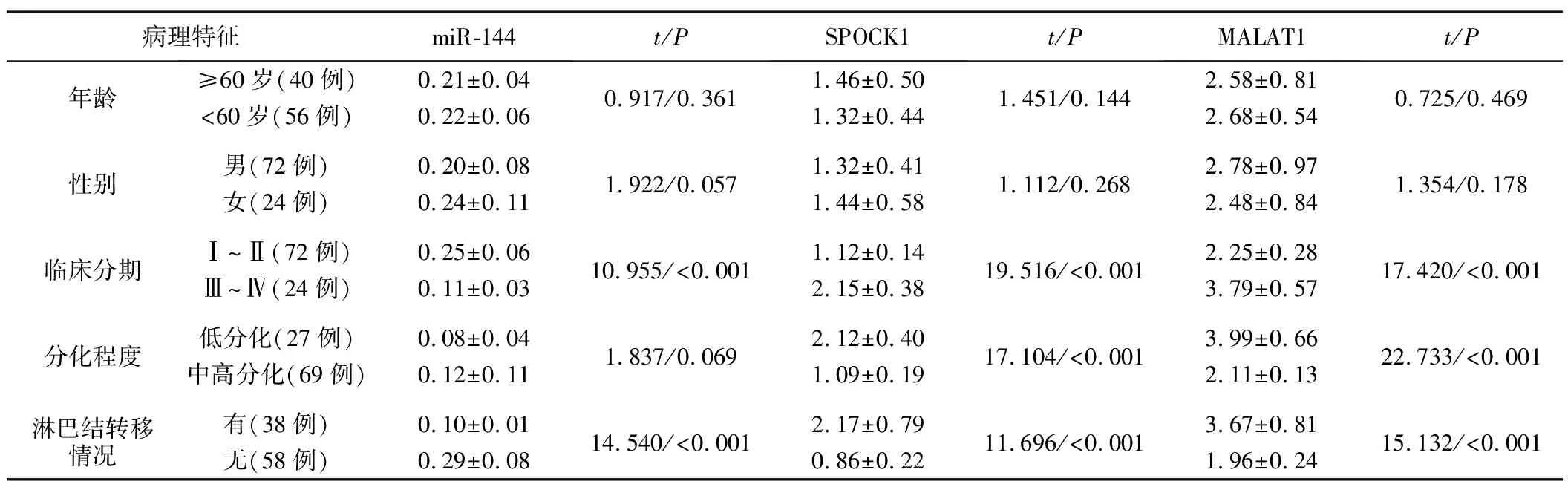
表2 miR-144、MALAT1及SPOCK1在不同膀胱癌临床病理特征中表达情况
3.miR-144、MALAT1及SPOCK1对膀胱癌诊断价值:绘制ROC曲线,计算AUC值。miR-144、MALAT1及SPOCK1对膀胱癌诊断AUC值分别为0.643、0.557,SPOCK1诊断AUC值为0.717(95%Cl:0.688~0.845),以SPOCK1诊断AUC值最高(P<0.05),见表3、图1。
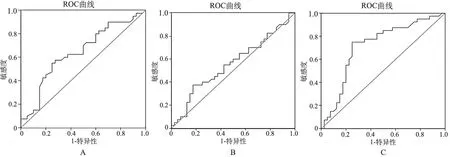
A:miR-144对膀胱癌诊断ROC曲线图;B:MALAT1对膀胱癌诊断ROC曲线图;C:SPOCK1对膀胱癌诊断ROC曲线图

表3 miR-144、MALAT1及SPOCK1对膀胱癌诊断价值
4.不同预后病人miR-144、MALAT1及SPOCK1表达情况比较见表4。96例病人中预后良好85例,预后不良11例。预后不良组miR-144低于预后良好组,MALAT1及SPOCK1高于预后良好组,差异有统计学意义(P<0.05)。

表4 两组病人miR-144、MALAT1及SPOCK1表达情况比较
讨论
miRNAs对机体细胞具有调控作用,miRNAs中有超过50%分布在与肿瘤有关的脆性点位以及基因区域内,参与肿瘤发生及发展。miR-144在胃癌细胞中表达下调,可靶向激活增强结合蛋白4从而抑制胃癌细胞的转移与侵袭[7-8]。本研究结果表明,与癌旁组织相比,癌组织中miR-144表达降低,靶向前B细胞白血病转录因子3作用降低,引起肿瘤发生、发展[9],且与临床分期、淋巴结转移密切相关,miR-144表达越低,其临床临床分期增加,出现淋巴结转移的几率越高,考虑与癌细胞突变后对miR-144调控机制产生影响,进而使其表达降低。通过miR-144抑制剂阻断内源性的miR-144表达后发现,膀胱癌细胞出现增殖速度加快,增强miR-144表达后细胞增殖被抑制,认为其机制与miR-144靶向zeste同源物2抑制了Wnt/β-连环蛋白信号通路有关,达到抑制膀胱癌细胞增殖的目的[10]。
MALAT1已被证实在肺癌、肝癌等恶性肿瘤中表达明显增加,与肿瘤发生、发展有关[11]。有研究显示,MALAT1可作为分子海绵结合并抑制miR-375的功能,从而促进下游癌基因YES相关蛋白1的表达,致使肿瘤细胞出现浸润转移以及无限增殖的情况,在MALAT1高表达者中其预后不良的几率增加[12]。有学者认为,MALAT1或可作为肿瘤诊断及治疗的新靶点。本研究结果显示,膀胱癌组织中MALAT1表达升高。同时本研究结果也显示,Ⅲ~Ⅳ期、低分化、淋巴结转移者及预后不良者中MALAT1均为高表达,表明MALAT1与病情发展存在一定关系。MALAT1可通过和分子海绵结合miR-101-3p,提高促进血管内皮因子的水平,或是促进淋巴结转移、引起预后较差的原因。
SPOCK1作为钙离子结合蛋白多糖家族中的一员,可影响机体内细胞的生长、分化等生物学行为,同时也可参与细胞与基质以及细胞与细胞之间的作用[13]。有研究显示,肝癌、非小细胞肺癌中SPOCK1表达异常升高,高表达的SPOCK1可促进病人癌细胞增殖能力,并促进其发展[14]。本研究发现,在癌组织中SPOCK1表达增加,与miRNA对SPOCK1转录后表达及调控之间存在关系。有学者认为,miR-139可与SPOCK1的3'非编码区之间相互作用,进而使SPOCK1的稳定性被破坏,其表达也会受到明显抑制;肿瘤发生后,miR-139表达减少,导致对SPOCK1抑制程度减少,SPOCK1表达随之升高[15]。同时,SPOCK1表达与临床分期、分化程度及淋巴结转移相关,提示SPOCK1或可为促癌基因,对膀胱癌发展有促进作用。有研究认为,SPOCK1在细胞外基质重塑中有重要作用,对癌细胞上皮间质转化有促进作用,肿瘤细胞在此影响下出现基质分离几率更高,导致肿瘤更易发展转移与侵袭。
通过绘制ROC曲线可知,miR-144、MALAT1及SPOCK1对膀胱癌均具有一定诊断价值,其中以SPOCK1诊断价值较高,三者表达与病人临床分期、淋巴结转移密切相关,提示三者均为可病人临床诊断及病人病情严重程度提供参考。
综上所述,膀胱癌组织中miR-144、MALAT1及SPOCK1异常表达,与肿瘤病理特征存在一定联系,或可作为膀胱癌潜在诊断标志物。本研究不足在于研究纳入样本量较少,并未对病人进行长期随访。
