经头静脉切开输液港置入术32例临床分析
2023-06-26董鸿KUSH李宁邱衍欢李兴睿易继林沈文状
董鸿 KUSH 李宁 邱衍欢 李兴睿 易继林 沈文状
完全置入式输液港(totally implantable venous-access ports,TIVAP)是一种可完全置入皮下及血管内、能够长期留置在体内的输液装置[1]。由Niederhuber等[2]首次报道应用,目前已经广泛应用于临床,很好地避免了高浓度、高刺激性液体在静脉输注时,因为药液外渗所导致的注射部位组织坏死等并发症[3]。输液港由注射座和连接的导管组成,导管可经由浅表静脉置入,末端位于上腔静脉近心1/3段内,目前,临床主要使用的浅表静脉多为颈内静脉、锁骨下静脉、腋静脉和股静脉等,其中尤以右侧颈内静脉和锁骨下静脉更为常用[4]。导管置入的方式主要采用经皮穿刺置入的方法。置入手术的并发症多与穿刺操作有关,如穿刺失败引起的周围组织损伤,误穿动脉导致出血、血肿、气胸,穿刺破坏静脉内膜导致血栓形成等[5-6]。为了尽量避免经皮穿刺置管的并发症,我们参考HelenS教授C臂机引导方式经头静脉切开置入输液港,按照中国病人的体型特点,加以改良,取得较好的良好效果。现报道如下。
对象和方法
一、对象
2019年10月~2020年12月我院接受经头静脉切开置入输液港手术的病人32例,同期同手术组行颈内静脉穿刺途径置入输液港47例。均为女性乳腺癌病人,年龄27~68岁,平均年龄43.5岁,化疗方案为含蒽环、顺铂或紫杉类化疗药物。头静脉切开组19例经左侧头静脉置入,13例经右侧头静脉置入,完成化疗拔除28例。颈内静脉穿刺组20例经由左侧颈内静脉穿刺,27例经由右侧颈内静脉穿刺,完成化疗拔除47例。纳入标准:(1)需长期行高渗、高刺激性液体输注,或多周期化疗;(2)置入侧未行乳腺癌手术;(3)术前彩超提示置入侧腋静脉、锁骨下静脉及颈内静脉无血栓形成;(4)对本研究知情同意并签署知情同意书。排除标准:伴凝血功能障碍;置入部位感染或有外伤史,如锁骨骨折等;合并周围血管疾病。
二、方法
头静脉切开入路手术方法:(1)病人体位:病人取平卧位。患侧上肢外展45度固定(图1)。

图1 头静脉入路体位图
(2)切口的选择和标记:所有病人均按照标准方法选择切口(参照骨外科经三角肌胸大肌入路行肱骨上段骨折的手术切口):取肱骨头内侧1 cm,平行于肱骨(已外展45度固定),上端距离锁骨下缘1 cm,切口长3 cm,标记笔行体表标记(图2)。

图2 头静脉入路体表标记
(3)输液港准备:常规肝素生理盐水预充输液港港体及导管,裁剪导管约30~35 cm,将导丝置入导管,两端均可露出导管外约3~5 cm,导丝置入导管内后,认准导丝头弯曲方向。(4)手术过程:常规消毒铺巾,局部浸润麻醉;切开皮肤、皮下组织至胸大肌及三角肌筋膜表面,乳突撑开器协助显露肌层表面,显露三角肌与胸大肌肌间沟,切开表层筋膜,显露头静脉,游离1 cm长度无属支静脉(图3A),远心端不可吸收线结扎2次,近心端血管下穿可吸收线提起血管(图3B),眼科剪斜行向近心端剪开1/3~1/2管径,血管拉钩向近心端置入,将输液港导管穿入近心端静脉(图3C);导管送入8~10 cm后,将导丝头推出导管约2 cm(导丝头向病人脚端方向弯曲),再同时送入导管和导丝,借助导丝头引导导管向上腔静脉方向走行,置入合适长度(根据乳腺公式计算所得),拔除导丝,注射器连接导管,回抽测试有无回血,并推注肝素生理盐水封管,体外留置合适长度导管,接输液港体(图3D);于切口内下方脂肪层内建立囊袋,置入输液港港体,缝合固定港体,经皮测试输液港通畅性,缝合切口各层,再次测试导管通畅性。

A:显露头静脉;B:远心端结扎、近心端带线提拉;C:剪开头静脉,置入导管;D:置入港座
结果
1.手术及结果:头静脉切开组,前期有2例失败,改为腋静脉第三段超声引导穿刺置入输液港,考虑切口选择不佳,头静脉暴露困难。2例因斜行剪开头静脉壁过多,置导管过程中导致静脉断裂,无法置入导管。余28例均顺利完成手术。颈内静脉穿刺组无置入失败病例,其中3例导管尖端位置欠佳,重新调整导管。后续输液治疗过程均顺利完成并拔除输液港。
2.手术时间:头静脉切开组前13例,三人参与手术,后15例,增加电刀切开和止血,并利用自动撑开器协助暴露,2人参与手术,平均用时25.93分钟。颈内静脉穿刺组2人参与手术,平均用时28.73分钟。
3.并发症:(1)不良事件:头静脉切开组1例切口愈合不良,化疗过程中置管侧上肢活动均无障碍,所测臂围无明显增粗;颈内静脉穿刺组置港相关不良事件3例,分别为导管贴壁回抽无回血、囊袋较薄致港座暴露、导管路径及港座周围感染。(2)血栓发生率:头静脉切开组28例,置管侧腋静脉、锁骨下静脉及颈内静脉未出现附壁血栓;颈内静脉穿刺置管组,化疗过程中或化疗结束时颈内静脉超声评估,发生血栓13例,血栓发生率31.91%。增加相应治疗时间2~5周,增加治疗费用1 000~2 000元。见表1。
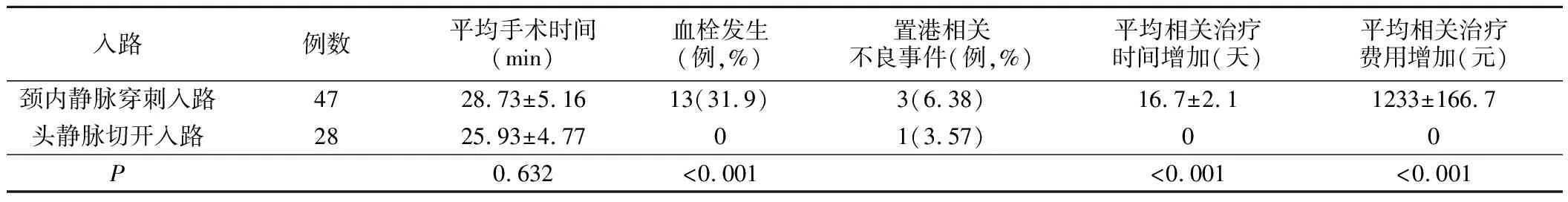
表1 同期不同入路静脉输液港置入比较
讨论
近年来,深静脉置管在乳腺癌等化疗病人中应用广泛,其中经外周静脉穿刺中心静脉置管(peripherally inserted central venous catheters,PICC)和TIVAP较为常见,二者均可促进化疗药物迅速播散,避免化疗药物对血管内膜的损伤刺激,减少了输液治疗本身的相关并发症[7]。近年来,接受TIVAP的肿瘤病人不断增加,2010年德国约有125 790例病人接受了TIVAP置入[8]。与PICC相比,TIVAP的留置时间更长,并发症少,导管相关感染风险更低,病人生活质量更高[9]。通常TIVAP可分为经颈或胸部静脉穿刺置入的胸壁输液港,和通过上臂静脉置入的上臂输液港。前者通常以颈内静脉、锁骨下静脉、腋静脉作为入路,使用Seldinger闭合插管技术置入导管,在前胸壁皮下完全埋入港座;而上臂输液港多经肱静脉、贵要静脉、头静脉入路通过穿刺技术置入导管,将港座完全埋入上臂内侧皮下[10]。这两种手术的成功率都很高,Wildgruber等[11]回顾性分析了1704例TIVAP手术,手术成功率为99.2%。虽无严重并发症发生,但仍常见包括导管扭转或脱位、血栓形成、皮下血肿或伤口感染等多种普通并发症。同时胸壁港也存在包括导管夹闭综合征和气胸或血胸等在内的严重并发症[8,12]。
本研究探索并实践了一种新的胸壁港置入方式,并取得了满意的效果。本研究对32例乳腺癌病人实施了经头静脉切开置入输液港改良手术,该术式结合了前文所述两种输液港置入术的优势,将置入的目标静脉锁定在头静脉的三角肌和胸大肌肌间沟段,导管置入后在切口内下方脂肪层内建立囊袋放置港体,其输液港置入位置更接近于传统胸壁输液港。该术式优点包括:(1)血栓发生率低。有研究表明,使用Seldinger技术经颈内静脉或锁骨下静脉置入胸壁输液港最常见的晚期并发症为纤维蛋白形成,这是血栓形成的前兆[13]。徐海萍等[14]研究发现,与胸壁输液港比较,上臂输液港置入术后血栓发生率更低。本研究47例颈内静脉穿刺置管的胸壁输液港病人,血栓发生率为31.91%,而头静脉切开方式置管的病人无一例出现血管内附壁血栓,无一例出现导管使用异常。(2)只需1个手术切口,无需建立皮下隧道。传统胸壁输液港需使用穿刺针建立一段皮下隧道埋入导管,在前胸壁合适处制造囊袋以容纳并固定港座[15]。而头静脉切开方式切开皮肤及相关组织置入导管后在切口内下方脂肪层内即可建立囊袋,置入输液港港体,仅需一个切口,操作更简便。(3)头静脉切开方式为肉眼直视下操作,避免血胸、气胸、夹闭综合征等血管穿刺相关并发症。传统胸壁输液港置入穿刺定位在颈内静脉、锁骨下静脉较多,易造成气胸或血胸等后果,穿刺颈内静脉时易误穿伴随走行的颈总动脉,而经锁骨下静脉置入导管可能会在锁骨和第一肋之间被压缩,严重时导致导管损伤、撕裂或者断裂,造成夹闭综合征。本研究所采用的经头静脉切开置入输液港改良手术中,切开皮肤并逐层分离组织,切口下即可暴露头静脉,直视下将输液港导管穿入头静脉近心端静脉。本研究28例成功手术中,均未发生误穿动脉、气胸、血胸、夹闭综合征等并发症。(4)病人生活质量及卫生经济学收益更高。颈内静脉输液港置入需在颈侧区到胸壁建立8~10 cm的皮下隧道,有些病人术后会有皮下牵扯感,影响头颈部活动。而上臂输液港置入后可能会影响术侧上臂活动。本研究输液港港座固定在胸壁且无皮下隧道,对病人术后生活质量影响较小,28例成功置管病人化疗过程中置管侧上肢活动均无障碍,所测臂围无明显增粗。并无皮下牵扯感,不影响头颈部及上肢活动,对生活质量影响更小。同时,由于无相关血栓治疗费用及不增加拔管时间,病人的卫生经济学收益更高。
本研究前期由于切口选择不佳,导致暴露头静脉困难,2例后改为在超声引导下经腋静脉第三段穿刺置输液港。另有2例因剪开头静脉壁过多,置导管过程中导致静脉断裂,无法置入导管。由于术中及时调整置入方式,避免了治疗相关时间和费用的增加。故本术式需精确定位切口及精细操作。1例切口愈合不良,考虑为置管侧上肢活动较多引起,所幸尚未达到清创标准,未增加病人治疗时间及费用。为了避免此类情况导致再次清创延迟切口愈合,应尽量避免置管侧上肢过早、过多的活动。
综上所述,经头静脉切开置入输液港改良术安全可靠、简便易行,只要熟练掌握头静脉切开置管所涉及的血管操作技术,可将本术式作为乳腺癌病人输液港置入术的首选。于三角肌-胸大肌肌间沟内离断结扎头静脉,并不增加健侧上肢水肿风险,当然,如果健侧再发生乳腺癌,特别是需要行腋窝淋巴结清扫,是否会因为头静脉肌间沟段结扎导致同侧上肢的肿胀,还有待进一步累积病例。现阶段,对于颈内静脉变异或强烈要求避免颈部切口的病人,该术式可作为一种有效的方案。
