依达拉奉右莰醇通过抑制氧化应激和提高自噬流促进周围神经损伤修复
2023-06-25谌靖豪楼承浩魏圣哲卢颖枫余方正王健
谌靖豪,楼承浩,魏圣哲,卢颖枫,余方正,王健
1.温州医科大学附属第一医院 创面修复科,浙江 温州 325015;2.温州医科大学附属第一医院 手外科·周围神经外科,浙江 温州 325015;3.温州医科大学 药学院,浙江 温州 325035
周围神经是指脑、脊髓以外的所有神经。由于周围神经自身再生修复过程漫长,大多数患者在周围神经损伤(peripheral nerve injury, PNI)后往往遗留有部分运动及感觉功能障碍[1-2]。依达拉奉右莰醇(Edaravone Dexborneol, C-EDA)是由依达拉奉与右莰醇以4:1的配比组成的药物合剂。有研 究[3]发现,依达拉奉可以通过氧化应激传感器核红细胞因子2 相关因子2(nuclear factor erythroid-2-related factor 2, Nrf2)和人铜锌超氧化物歧化酶抑制肌萎缩侧索硬化模型小鼠的氧化应激。右莰醇通过激活核转录因子κB信号通路在皮质神经元氧糖剥夺/再灌注损伤中发挥抗氧化和抗炎症的保护作用[4]。两种成分发挥协同作用,清除自由基与抑制炎症反应,进而发挥更有效地调节内环境稳态的作用[5-6]。然而C-EDA在PNI方面的治疗作用和具体分子机制鲜有学者进行过深入研究。氧化应激是体内氧化与抗氧化平衡作用失调的一种应激状态,是自由基在体内产生的一种负面作用,被认为是导致衰老和机体疾病的一个重要因素[7-8]。在神经损伤后,氧化激活过度激活的过程会产生大量的活性氧(reactive oxygen species, ROS)并积累,从而导致神经元死亡,这阻碍了神经结构及功能的恢复。有研究[9]发现外源性给予褪黑激素可以抑制PNI的氧化应激来增强PNI的恢复。自噬参与多种细胞内细胞器和蛋白质降解,是维持细胞生存环境稳态的重要过程[10]。有研究报道自噬的适度激活可以在顺铂诱导的螺旋神经节神经元损伤中发挥神经保护作用。然而自噬水平的增高并不完全代表自噬效应的增强[11]。自噬是一个动态的循环,这个循环称之为自噬流[12-14]。本研究聚焦于C-EDA对PNI后神经的保护作用,以期探讨C-EDA是否具有促进周围神经修复的作用,并试图探究其潜在的分子机制。
1 材料和方法
1.1 主要试剂与仪器大鼠神经丝蛋白200(neurofilament-200, NF-200)抗体购自美国Abcam公司(货号:ab4680),髓磷脂碱性蛋白(myelin basic protein, MBP)抗体购自美国Abcam公司(货号:b4066),亚铁血红素加氧酶-1(heme oxygenase-1, HO-1)抗体购自美国Proteintech公司(货号:10701-1-AP),Nrf2 抗体购自美国Proteintech公司(货号:16396-1-AP),SQSTM1(p62)抗体购自成都正能生物技术有限责任公司(货号:382862),微管相关蛋白1A/1B-轻链3(LC3II/I)抗体购自武汉ABclonal公司(货号:A5618),Bcl-2抗体购自美国Proteintech公司(货号:26593-1-AP),Bax抗体购自美国Proteintech公司(货号:50599-2-1g),磷酸化AMP活化蛋白激酶(p-AMPK)抗体购自美国Abcam公司(货号:#2535),转录因子E3(transcription factor E3, TFE3)抗体购自美国Proteintech公司(货号:14480-1-AP),哺乳动物雷帕霉素靶蛋白(mechanistic target of rapamycin, mTOR)抗体购自美国Proteintech公司(货号:66888-1-Ig),GAPDH抗体购自成都正能生物技术有限责任公司(货号:10494-1-AP),DAPI购自上海碧云天生物技术研究所(货号:C1006),3-甲基腺嘌呤(3-methyladenine, 3MA)购自美国MCE公司(货号:HY-19312)。
1.2 方法
1.2.1 实验分组及给药:40只SD大鼠按随机数字表法均分为4组:①假手术对照组(Sham组):实施麻醉与切开皮肤,并注射等量0.9%氯化钠溶液;②PNI组:在10%水合氯醛麻醉后,用血管夹造成坐骨神经中度挤压伤,并注射等量0.9%氯化钠溶液;③C-EDA(C-EDA+PNI)组:麻醉后切开皮肤并使用血管夹夹闭坐骨神经,之后的4周每天腹腔注射3.75 mg/kg的C-EDA;④3MA组(PNI+C-EDA+3MA):在制作PNI模型前3 d,以腹腔注射的方式每天给予mTOR抑制剂3MA(2.5 mmol/L)15 mg/kg来抑制自噬,麻醉后切开皮肤并使用血管夹夹闭坐骨神经,之后的4周每天腹腔注射3.75 mg/kg的C-EDA与15 mg/kg的3MA。术后4周处死所有大鼠,取右侧坐骨神经进行病理指标评价。SD大鼠均购自温州医科大学实验动物中心,实验动物许可证号:SYXK(浙)2021-0020。
1.2.2 步态印记分析:在术后第4 周对所有大鼠进行步态印迹分析[15]来评估运动功能的恢复。分别测量正常侧后足(N)和损伤侧后足(E)的3 个数据:足印长度、中间足趾宽度、足趾宽度。计算出的数值即为坐骨神经功能指数(sciatic nerve function index, SFI)[16]。
1.2.3 神经电生理检查:损伤后第4周使用神经电生理监测技术来评估坐骨神经传导功能的恢复。具体操作如下:将神经电生理仪器的刺激电极放置于大鼠坐骨神经损伤部位靠近端1 mm处,接收电极放置于腓肠肌的肌腹。将平衡电极置于大鼠皮下,给予30 mA电流的电刺激,在神经电生理检测仪上会得到相应的肌肉收缩波形。之后刺激电极位置改为神经损伤部位远端1 mm处。同样的刺激可以得到另一种波形。
1.2.4 免疫荧光染色:动物组织切片荧光:石蜡切片用二甲苯浸泡20 min。依次放入无水乙醇、90%乙醇、80%乙醇、70%乙醇,用PBS洗5 min,重复3 遍。用高压锅加热3 min后加入一抗:NF-200 (1:1000),MBP(1:2000),复温1 h,加入二抗(1:1000),37 ℃孵育60 min,然后封片。使用DAPI标记细胞核。所有荧光图像均使用激光共聚焦显微镜拍摄。
1.2.5 蛋白质印迹法(Western blot)检测相关蛋白表达:提取总蛋白,用BCA法测定蛋白浓度。动物蛋白经过凝胶电泳、电转移和封闭后,加入一抗孵育:HO-1(1:2000)、Nrf2(1:200)、p62(1:100)、LC3II/LC3I(1:200)、GAPDH(1:100)、Bcl-2(1:200)、Bax(1:200)、p-AMPK(1:100)、TFE3(1:200)、mTOR(1:200)、GAPDH(1:800)。二抗(1:1000)孵育1 h。使用电化学发光液浸泡膜,置于成像系统内进行图像采集。Sham组的值默认为1进行比较。
1.2.6 脂质氧化物丙二醛(malondialdehyde, MDA)检测:组织使用裂解液进行匀浆,10000~12000 r/min 离心10 min后取上清液用于后续测定。在离心管内加入0.1 mL PBS作为空白对照,加入0.1 mL不同浓度标准品用于制作标准曲线,加入0.1 mL样品用于测定。随后用酶标仪在532 nm波长下测定吸光度。
1.2.7 组织病理学观察:将损伤侧坐骨神经与腓肠肌置于4%多聚甲醛中固定24 h,石蜡包埋,切片,HE染色,显微镜下观察拍摄。
1.3 统计学处理方法采用GraphPad Prism 8.0 统计软件进行分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较用Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠后足足趾畸形程度比较从后爪伸展的足底视图可以看出PNI组大鼠的损伤侧后足与Sham组相比更加挛缩和畸形,C-EDA组大鼠后足的挛缩和畸形程度与PNI组大鼠相比更低,3MA组大鼠 后足的挛缩和畸形程度与C-EDA组大鼠相比更高,见图1A。C-EDA治疗4周后,PNI组的SFI值低于Sham组(P<0.001),C-EDA组的SFI值与PNI组相比增高(P<0.001),3MA组的SFI值较C-EDA组降低(P<0.001),见图1B。
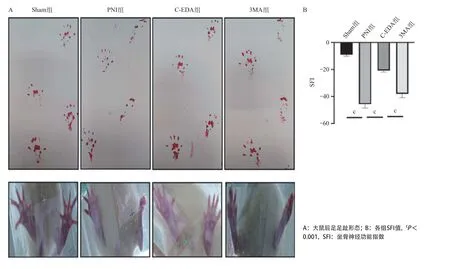
图1 术后4周各组大鼠的后足足趾形态变化及SFI比较
2.2 各组大鼠腓肠肌萎缩程度比较C-EDA治疗4周后,双侧腓肠肌湿重(损伤侧/健侧)之比统计结果显示,PNI组的腓肠肌湿重比值要远低于Sham组(P<0.001),C-EDA组的腓肠肌湿重比值较PNI组增高(P<0.001),3MA组的腓肠肌湿重比值较C-EDA组减低(P<0.001),见图2A。腓肠肌HE染色结果显示,PNI组的腓肠肌肌纤维面积要小于Sham组(P<0.001),C-EDA组的腓肠肌肌纤维面积较PNI组增大(P<0.001),3MA组的腓肠肌肌纤维面积较C-EDA组减少(P<0.001),见图2B。
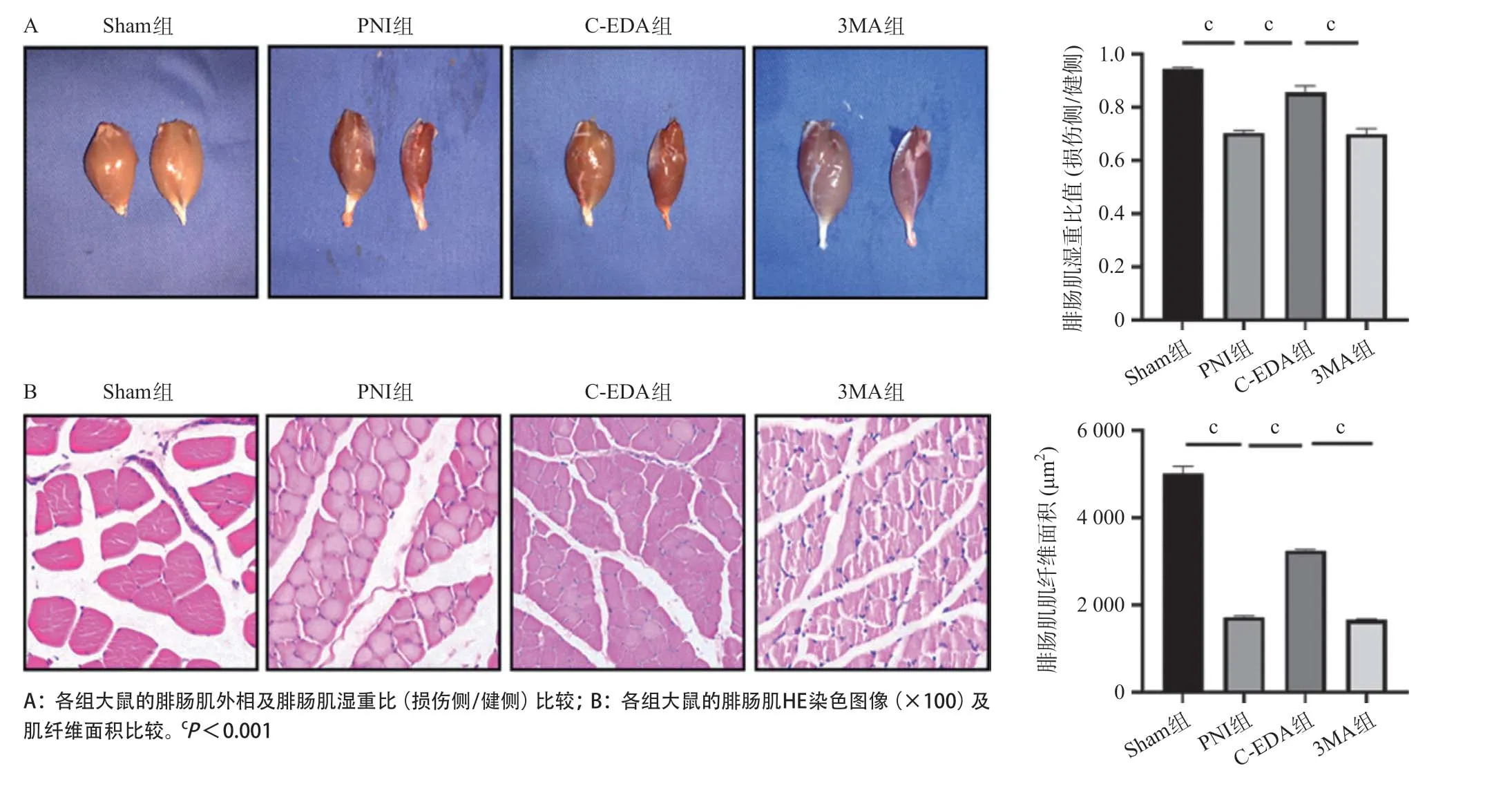
图2 术后4周大鼠腓肠肌萎缩程度比较
2.3 各组大鼠神经传导速度比较神经电生理检测结果显示,PNI组的神经冲动潜伏期较Sham组明显延长(P<0.001),C-EDA组的神经冲动潜伏期与PNI组相比明显缩短(P<0.001),3MA组神经冲动潜伏期较C-EDA组延长(P<0.001),见图3。
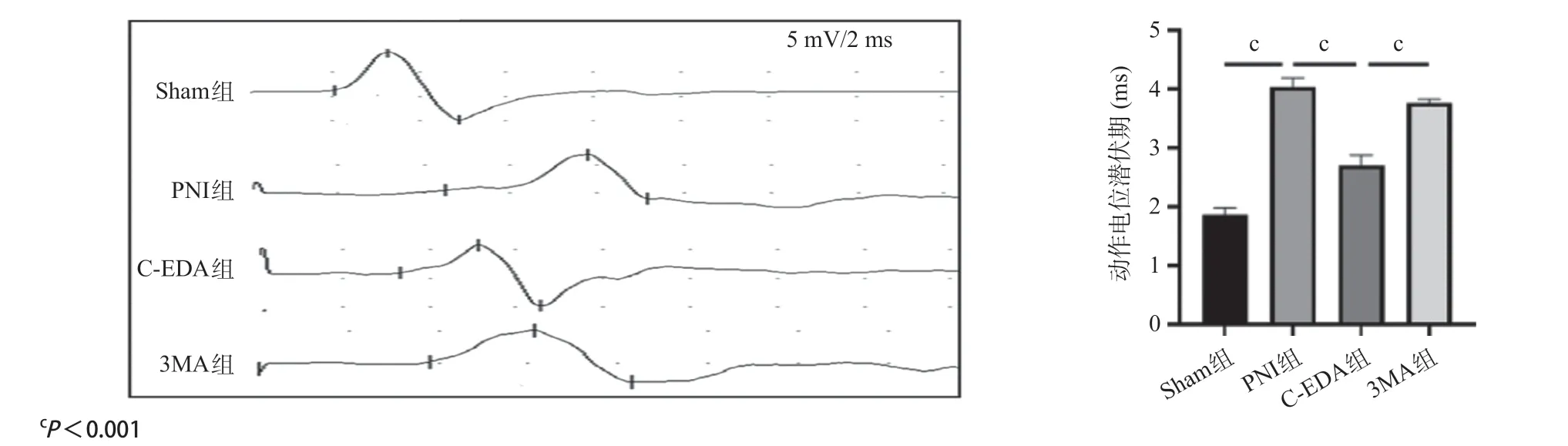
图3 术后4周各组大鼠神经电生理检测结果与神经冲动潜伏期比较
2.4 各组大鼠坐骨神经HE染色结果比较为评价PNI组及C-EDA干预后神经纤维和髓鞘的组织学改变,在损伤后4周对各组神经纵、横切片进行HE染色。纵切面染色显示PNI组的神经纤维结构疏松、无序。C-EDA组神经纤维结构比PNI组更致密、均匀,3MA组的神经纤维结构与C-EDA组相比更加疏松、无序。横切切片染色结果显示,与PNI组相比,C-EDA组髓鞘形态完整,排列规则均匀,而3MA组与C-EDA组相比髓鞘形态破碎,排列紊乱。见图4。

图4 各组大鼠坐骨神经HE染色结果
2.5 各组大鼠坐骨神经免疫荧光染色结果比较坐骨神经横纵切面NF-200和MBP免疫荧光共染色结果显示,PNI组的NF-200的荧光面积明显小于Sham组(P<0.01),C-EDA组的NF-200的荧光面积明显大于PNI组(P<0.01),3MA组的NF-200的荧光面积明显小于C-EDA组(P<0.01)。C-EDA组的MBP的荧光面积明显高于PNI组(P<0.01),3MA组的MBP的荧光面积与C-EDA组相比降低(P<0.01)。见图5A、图5B。

图5 大鼠坐骨神经横纵切面免疫荧光共染色图像(刻度尺长度均为10 μm)
2.6 各组大鼠坐骨神经自噬相关蛋白表达的比较为了探究体内自噬和上述效应之间的关系,采用Western blot法检测大鼠体内自噬相关蛋白LC3II/LC3I和p62的表达水平。结果显示,PNI组的LC3II/LC3I的比值高于Sham组(P<0.01),与C-EDA组相比差异无统计学意义(P>0.05),3MA组的LC3II/LC3I的比值较C-EDA组降低(P<0.01)。PNI组的p62表达水平高于Sham组(P<0.01),C-EDA组的p62表达水平低于PNI组(P<0.001),3MA组的p62表达水平较C-EDA组显著增高(P<0.01),见图6。

图6 Western blot法检测自噬相关蛋白表达情况
2.7 各组大鼠坐骨神经氧化与凋亡相关蛋白表达的比较PNI组氧化应激的激活可能不利于神经纤维和髓鞘再生[17-18]。采用Western blot法检测HO-1、核内Nrf2、Bax和Bcl-2的蛋白表达水平,结果显示,与Sham组相比,PNI后HO-1和Nrf2水平略有升高(P<0.05,P<0.01)。而在使用C-EDA治疗后,这一趋势明显上调(P<0.05,P<0.01),见图7A。PNI组的促凋亡蛋白Bax水平高于Sham组(P<0.001),而C-EDA组的促凋亡蛋白Bax水平较PNI组有所降低(P<0.05)。PNI组抗凋亡蛋白Bcl-2的水平较Sham组降低(P<0.001),使用C-EDA治疗后Bcl-2的水平与PNI组相比有所升高(P<0.01),见图7A。统计分析结果显示,与Sham组相比,PNI组的Bax/Bcl-2 的比值显著升高(P<0.001),使用C-EDA治疗后,Bax/Bcl-2的比值显著降低(P<0.001),见图7B。MDA检测结果显示,PNI组的MDA水平较Sham组显著升高(P<0.001),而在使用C-EDA治疗后,体内MDA的水平显著降低(P<0.001),见图7C。
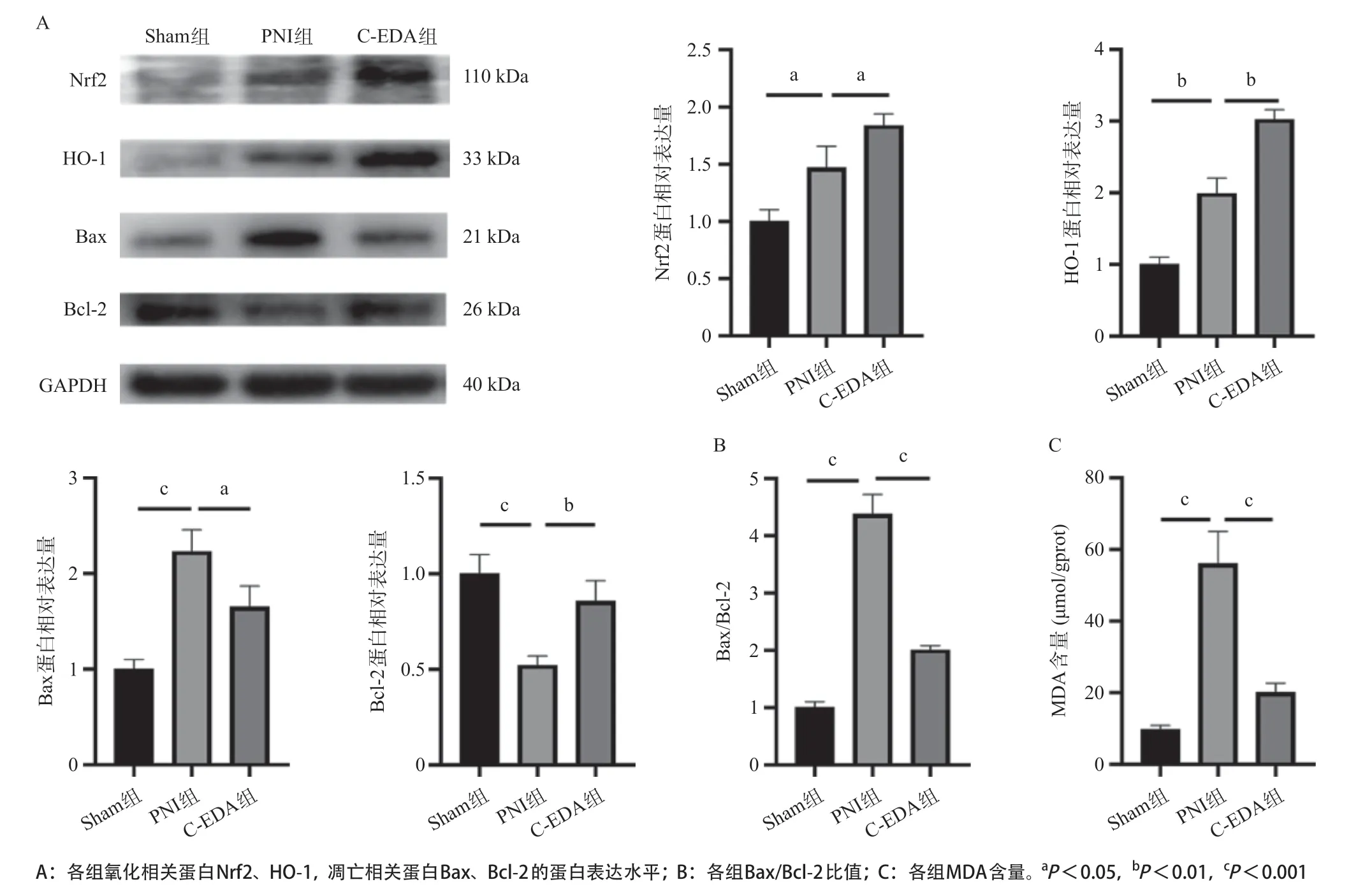
图7 各组氧化相关蛋白和凋亡蛋白表达水平和MDA检测结果
3 讨论
C-EDA是一种已在临床上广泛应用的处方药物,由依达拉奉和右坎醇配比组成,依达拉奉具有抗氧化作用,而右莰醇具有抗炎作用,两种组分协同增效,进而发挥更有效的神经保护作用。目前,大部分学者仍在深入探讨C-EDA对脑缺血再灌注损伤等脑卒中疾病的治疗机制,C-EDA所调控的的分子信号网络逐渐清晰[19]。然而,在周围神经相关疾病 中,鲜有研究报道C-EDA是否具有同样的治疗作用。
在中枢神经系统相关疾病中,已有学者通过研究证实C-EDA具有神经保护作用。ZHANG等[19]研究证实,C-EDA能够通过激动丝裂原活化蛋白激酶磷酸酶1介导的丝裂原活化蛋白激酶抑制和激动Nrf2,抑制氧化应激、炎症反应以维持微环境稳定,促进脑功能修复。目前,已有部分学者发现C-EDA对周围神经也具有保护作用[20]。有研究[21]证实,大鼠周围神经遭受缺血再灌注损伤时,C-EDA能够抑制周围神经缺血再灌注损伤慢性期活性氧的产生以及抑制炎症反应,从而在缺血再灌注损伤后发挥周围神经保护作用。
在本研究中,笔者在大鼠PNI模型中通过腹腔注射C-EDA来探讨C-EDA对PNI修复的影响。研究中发现,C-EDA组的SFI值较PNI组降低,后足形态与PNI组相比也更为舒展。神经电生理检测结果中,C-EDA组的动作电位潜伏期较PNI组有所缩短。C-EDA组的腓肠肌湿重比和HE染色肌纤维面积较PNI组显著增高。表明C-EDA改善了神经支配肌肉的失神经营养状态,从而改善了大鼠后足的挛缩程度以及改善了PNI后的神经传导功能,减轻了PNI后腓肠肌的萎缩。此外,神经的HE染色结果显示,与PNI组相比,C-EDA组的神经纤维结构更加紧密,排列更加有序,髓鞘形态更为完整。神经横纵切片的NF200+MBP免疫荧光共染色结果显示,C-EDA组的NF200以及MBP的荧光面积与PNI组相比增高,表明C-EDA治疗可以促进PNI后髓鞘和神经纤维的修复。
自噬是体内主要的降解系统,它发生在细胞内,细胞内物质和异常细胞器由该系统被递送至溶酶体并在溶酶体中降解[12]。有研究发现海藻糖通过不依赖mTOR的途径增强自噬体募集,增强神经元中的自噬。增强的自噬通过内在的线粒体依赖性途径抑制细胞凋亡,减少病变腔扩张和神经元死亡,并最终改善SCI后的功能恢复[22]。在PNI的早期阶段,受损或功能失调的蛋白质、脂质和细胞器积聚在病变部位,产生局部应激,阻碍施旺细胞(Schwann cell, SCs)刺激神经修复的能力。调节PNI后的自噬,能够清除病变部位积聚的功能失调的蛋白和细胞器等,从而促进SCs修复受损的神 经[23]。在本研究中,通过体内实验发现损伤后明显增强的自噬,在给予C-EDA后没有明显的改变。然而,C-EDA促进PNI后大鼠的后足形态、腓肠肌萎缩程度和神经传导功能等运动功能恢复和神经、髓鞘的再生和修复以及下调体内外的凋亡水平,上述的治疗效果在使用3MA抑制自噬后被逆转。说明该自噬水平的升高可能是有利于神经的再生和修复的。然而相对于PNI组而言,C-EDA组的自噬水平没有明显的变化。有研究[24]发现增加自噬流可能是PNI的潜在治疗靶点。自噬的目的不是简单地消除物质,而是作为一个动态循环系统,这个动态循环称为自噬流[12-14]。ISSA等[25]发现溶酶体膜蛋白可以上调自噬流,抑制帕金森病脑内过度的氧化应激,从而发挥神经保护作用和预防突触核蛋白α诱发的帕金森病样症状。故推测本研究中C-EDA的治疗作用可能不只是来源于自噬活性的升高,更多的可能是因为通畅了自噬流。为了验证这一推测,笔者检测了体内外各组的自噬底物蛋白p62的表达水平。当自噬通畅时,作为自噬底物的p62会被消耗而水平降低。反之,自噬受阻时,p62的水平会升高,可以反映自噬的通畅性。结果显示损伤刺激后p62水平显著增高,在使用C-EDA治疗后p62水平显著降低,使用3MA抑制自噬后,C-EDA对下调p62水平的效应被逆转。以上结果表明损伤刺激会抑制自噬流,而C-EDA治疗能够恢复损伤刺激抑制的自噬流。
氧化应激被认为是损伤后导致神经损伤的主要原因之一,不利于PNI后的神经功能恢复。氧化应激介导的神经元变性可以通过抗氧化防御的耗尽、微管破坏、脱髓鞘、神经炎症、线粒体自噬损伤和细胞凋亡引起的神经元死亡来执行[26-28]。笔者猜?测C-EDA对于PNI后的保护和促恢复作用可能与其抑制过度的氧化应激有关。通过检测抗氧化相关蛋白Nrf2(核内)、抗氧化酶HO-1以及促凋亡蛋白Bax和抗凋亡蛋白Bcl-2的表达水平。结果显示,与PNI组相比,C-EDA组的Nrf2和HO-1表达水平增高,Bax水平降低,Bcl-2水平增高,Bax/Bcl-2比值降低。表明在PNI后,C-EDA能进一步提高体内的抗氧化水平和降低体内的凋亡水平来促进损伤神经的修复。
综上所述,本研究首先证明C-EDA能够促进PNI后神经纤维和髓鞘修复以及运动功能恢复,且C-EDA对于PNI后的治疗作用与其能够恢复损伤后受抑制的自噬流以及对抗过度的氧化应激密切相关。此外,C-EDA作为一种抗氧化活性物质可以抑制过度激活的氧化应激,为PNI的治疗提供了一种新的可能。然而,本研究还未对C-EDA的抗氧化作用与增强自噬通量作用之间的联系进行详细研究,下一步研究重点为讨论C-EDA的抗氧化应激作用与增强自噬通量作用之间的相互作用及其分子机制。
