高脂促进脂肪酸去饱和酶1基因启动子区DNA甲基化并下调其表达*
2023-06-25肖倩倩金元超
肖倩倩, 金元超, 丁 虎△
1华中科技大学同济医学院附属同济医院心血管内科,武汉 430030 2西安市第四医院心血管内科,西安 710005
高三酰甘油血症是动脉粥样硬化性心血管疾病的重要发病因素[1-2]。全基因组关联分析也提供了强有力的证据[3],表明三酰甘油是动脉粥样硬化性心血管疾病的可遗传、可改变的危险因素[4]。然而,许多疾病现象无法通过经典遗传学理论进行解释,存在“遗传度缺失”现象,表观遗传学是其重要补充和近年来的研究热点。
DNA甲基化是参与心血管疾病发生发展的重要表观遗传修饰形式[5],它通过募集参与基因阻遏的蛋白质或抑制转录因子与DNA的结合来调节脂代谢相关基因表达[6]。越来越多的研究表明,DNA甲基化在调节血脂稳态和脂质代谢相关的疾病中发挥重要作用[7]。
有研究表明,脂肪酸去饱和酶1(Fads1)rs174546位点的基因多态性与高三酰甘油血症有高相关性,且Fads1的失活会导致动脉粥样硬化性疾病风险增加[8]。然而,Fads1基因的表观调控机制目前仍不清楚。
因此,我们结合以上研究背景,推测高三酰甘油血症导致Fads1基因启动子区的甲基化修饰异常,继而影响Fads1的表达和高三酰甘油血症的发生发展。
1 材料与方法
1.1 主要仪器及试剂
Trizol(日本TaKaRa公司),RNA逆转录试剂盒及SYBR Green(中国南京诺唯赞生物科技股份有限公司),20%医用脂肪乳(上海百特侨光医疗用品有限公司),基因组DNA提取试剂盒(大连宝生物工程有限公司),三酰甘油(TG)、总胆固醇(TC)测定试剂盒(南京建成科技有限公司),Fads1 ELISA试剂盒(上海钰博生物科技有限公司),BCA蛋白定量试剂盒(武汉博士德生物工程有限公司),油红O染液及苏木精染液(武汉谷歌生物科技有限公司),双荧光素酶报告基因系统(美国Promega公司),重亚硫酸盐转化试剂盒(美国Active Motif公司)。
1.2 细胞培养及诱导细胞脂肪变性
大鼠肝细胞系BRL-3A由中山大学医学院提供。置于37℃、含5% CO2、湿度适宜的细胞培养箱中,使用含10%胎牛血清的DMEM高糖完全培养液进行培养。待细胞生长至对数期时,进行细胞传代。将细胞消化后,同等密度接种于6孔板中,培养24 h后,在高脂刺激组加入2 mL含6%脂肪乳的培养液,对照组加入不含脂肪乳的培养液,继续培养24 h后通过三酰甘油及胆固醇测定试剂盒检测细胞内TG、TC含量。
1.3 实验动物及分组
选取36只8周龄、体重约200 g的SPF级雄性SD大鼠(由华中科技大学同济医学院实验动物中心提供),按照随机数字表法随机分为两组:对照组、高脂饮食组,每组18只。常规适应性喂养1周后,对照组给予基础饲料喂养,高脂饮食组给予高脂饲料(基础饲料中加入1%胆固醇、10%猪油)喂养。大鼠均饲养于SPF级环境中,室温(23±2)℃,自由摄食饮水,分笼饲养。
1.4 大鼠血浆标本采集
分别于喂养的第1、3、4、5周后,采集大鼠血浆标本。采集前禁食16 h,用肝素溶液处理毛细玻璃管以避免凝血,再经大鼠内眦静脉取血2 mL,置于室温离心机中3000×g离心8 min,吸取上层澄清液体,即为血浆样本。收集的样本送华中科技大学附属同济医院检验科,测定血浆脂质含量。
1.5 大鼠肝脏标本制备
于喂养的第5周,检测血脂并确定出现高脂血症后,单侧眼球摘除取血并处死大鼠,剖开腹腔并完整摘取肝脏组织,称重并拍照。切取肝脏中间部分置于4%多聚甲醛中浸泡过夜,而后制作成石蜡切片,进行苏木精-伊红(HE)染色。另切取部分组织放入-80℃冰箱保存,冰冻切片后进行油红O及苏木精染色,观察脂滴沉积情况。
1.6 肝脏组织RNA提取和逆转录
取30 mg大鼠肝脏组织,使用剪刀尽可能剪成碎块,加入1 mL Trizol,置于超声波发生仪进行超声粉碎,并严格按照试剂盒操作说明提取肝脏RNA。再利用RNA逆转录试剂盒,对RNA进行逆转录PCR,得到cDNA。
1.7 实时荧光定量PCR
通过查阅三酰甘油代谢的相关文献,确定10个相关基因,包括Cpt1a、Lpl、Fads1、Apoa5、Apoc3、Apoc2、Gpihbp1、Angptl3、Lmf1、Ces1d。利用Primer Blast网站,针对上述基因CDS区设计特异性引物。使用Applied biosystems实时荧光定量PCR仪对目的片段进行扩增。反应条件:预变性,95℃,30 s;变性,95℃,5 s;PCR反应:60℃,30 s,40个循环。选用大鼠源性GAPDH作为内参。用仪器自带分析软件分析熔解曲线及相对定量数据。
1.8 BSP克隆测序法(bisulfite sequencing PCR)
取30 mg大鼠肝脏组织,用剪刀剪成碎块,利用基因组DNA提取试剂盒提取大鼠肝脏组织总基因组DNA。测定提取得到的DNA浓度,利用试剂盒对DNA进行重亚硫酸盐转化,并对转化后的DNA进行纯化处理,于-20℃冰箱保存。从TRED数据库中获取Fads1基因启动子序列,再导入引物设计软件Meth Primer,预测得到Fads1基因启动子区2000 bp内CpG岛的信息,并针对CpG岛两端设计PCR引物。接下来对重亚硫酸盐转化后的DNA样本进行甲基化PCR扩增,产物回收,酶切、酶连反应,感受态转化克隆,挑选阳性克隆进行测序分析,将测序数据与Fads1原始序列比对,分析甲基化程度。
1.9 统计学方法
所有数据应用SPSS 19.0进行统计分析,连续变量用均数±标准差表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析(ANOVA),组间两两比较用LSD-t检验,采用Pearson相关性检测分析Fads1基因甲基化水平与大鼠血浆三酰甘油含量的相互关系,以P<0.05为差异有统计学意义。
2 结果
2.1 构建大鼠高三酰甘油血症模型
高脂饮食喂养后第3周开始,高脂饮食组大鼠血浆三酰甘油(TG)含量较对照组明显升高(约为2.1倍,P<0.05),且随着饲养时间延长,升高程度越明显,到第5周升高至约3倍(P<0.01);同时,高脂饮食组大鼠血清总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)含量有一定的升高趋势,而高密度脂蛋白胆固醇(HDL-C)含量无明显变化。提示高脂饮食喂养可有效诱导大鼠出现高三酰甘油血症(图1A~1D)。
在喂养的第5周,我们对大鼠肝脏脂质沉积程度进行观察。光学显微镜下,HE染色可见对照组大鼠肝脏肝小叶结构清晰,肝细胞排列紧密,细胞内未见脂滴空泡;而高脂饮食组大鼠肝细胞胞浆出现了明显的脂滴空泡,大小不一,边界清晰,将细胞核挤向一侧,肝细胞间界限不清。油红O及苏木精染色可见,相较于对照组,高脂饮食组大鼠肝脏有明显的脂滴红染(图1E)。上述结果提示在高脂喂养的大鼠肝脏中,已经出现了明显的脂质沉积,肝细胞出现明显的脂肪变性。
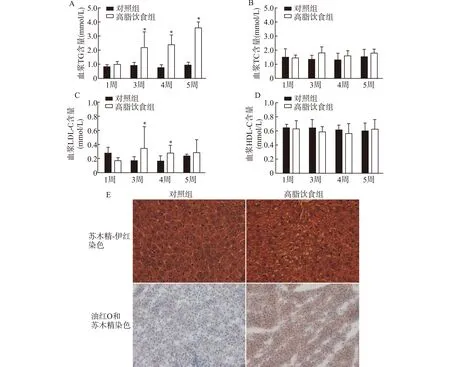
对照组及高脂饮食组大鼠血浆三酰甘油(A)、总胆固醇(B)、低密度脂蛋白胆固醇(C)、高密度脂蛋白胆固醇(D)含量,n=6,与对照组比较,*P<0.05;E:各组大鼠肝脏HE染色(×400)及油红O和苏木精染色(×100)图1 大鼠血脂水平及肝脏组织病理检测Fig.1 Serum lipid level and liver histopathology in each group of rats
2.2 Fads1在高三酰甘油血症大鼠中表达下调
通过查阅文献,筛选出10个与三酰甘油代谢密切相关的基因。实时荧光定量PCR结果显示,相较于对照组,有4个基因在肝脏中的表达水平有明显变化,其中Fads1在高脂饮食组中显著低表达(P<0.01,图2A)。利用ELISA方法分析大鼠血浆Fads1含量,发现在高脂喂养5周后,大鼠血浆Fads1含量降低,较对照组下降了约10%(P<0.05,图2B)。以上结果表明,高三酰甘油血症可以明显抑制大鼠体内Fads1的表达,尤其在转录水平。

A:两组大鼠肝脏中三酰甘油代谢相关基因的mRNA表达情况(每行表示每个基因在不同样本中的表达情况,每列表示每个样品中所有基因的表达情况;红色表示基因表达上调,蓝色表示基因表达下调,颜色越深代表基因表达变化程度越大);B:两组大鼠血浆Fads1水平,n=4,与对照组比较,*P<0.05图2 Fads1在大鼠肝脏和血浆中的表达情况Fig.2 Expression of Fads1 in liver and plasma of rats in each group
2.3 Fads1启动子区甲基化位点的预测与鉴定
为明确高三酰甘油血症抑制Fads1表达的具体机制,我们对Fads1启动子区的甲基化修饰进行研究。首先利用Meth Primer网站(http://www.urogene.org/methprimer2/)进行在线预测,结果显示启动子区-423 bp至-173 bp的区域为CpG岛,其中共包含16个CpG二核苷酸。将其划分为6个甲基化检测位点,再针对CpG岛两端设计特异性引物(图3A)。从高脂饮食组及对照组中分别选取4只大鼠的肝脏样本,提取出完整的基因组DNA,利用特异性引物对CpG岛进行PCR扩增,DNA凝胶电泳提示成功扩增出长度为283 bp的目的片段(图3B)。对该片段进行一代测序,序列与数据库中的吻合,证实了Fads1启动子区中CpG岛的真实性。
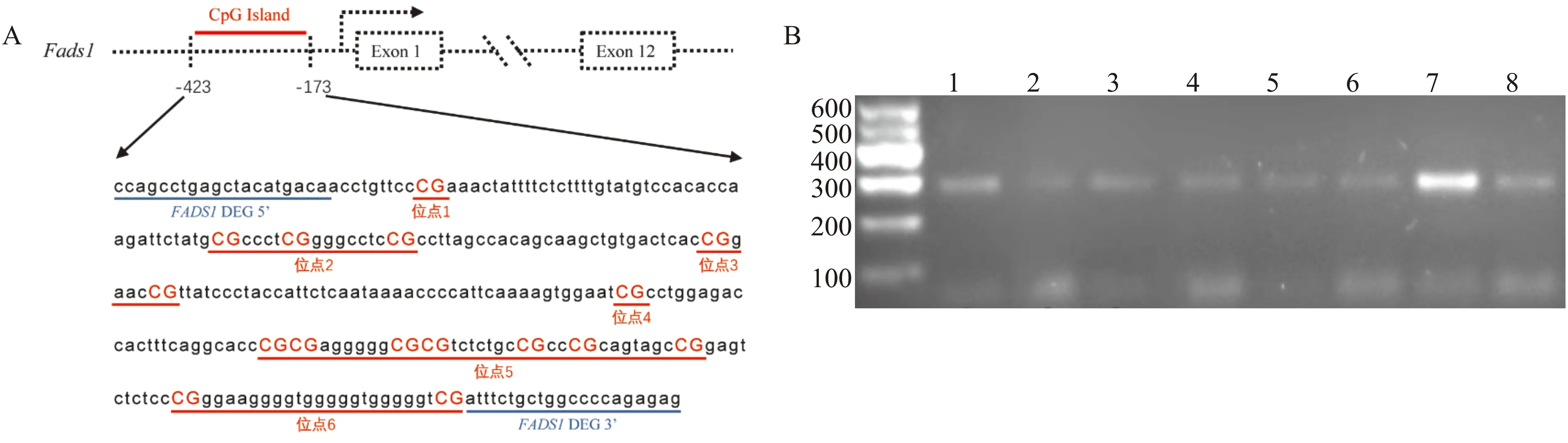
A:Meth Primer预测的Fads1启动子区中的CpG岛区域(红色区域),具体序列中,红色二连序列为CpG二核苷酸,共16个,将其分为6个检测位点,位点1为CpG 1,位点2为CpG 2~4,位点3为CpG 5~6,位点4为CpG 7,位点5为CpG 8~14,位点6为CpG 15~16;B:CpG岛PCR扩增产物凝胶电泳图,在300 bp附近可见目的片段(283 bp),1~4为对照组,5~8为高脂饮食组图3 Fads1启动子区甲基化位点的预测与鉴定Fig.3 Prediction and identification of methylation sites in the promoter region of Fads1
2.4 Fads1启动子区甲基化水平与血浆三酰甘油的相关性分析
为探讨Fads1启动子区甲基化水平的变化,我们对两组大鼠肝脏基因组DNA进行了BSP克隆测序。测序结果表明,高脂饮食组中甲基化胞嘧啶未发生改变,而对照组中未发生甲基化的胞嘧啶则转变为胸腺嘧啶(图4A)。对6个甲基化位点的甲基化率分别进行分析,发现与对照组相比,位点1~5的甲基化率在高脂饮食组大鼠肝脏组织均明显升高,位点6的甲基化水平则显著下降,但是总体甲基化率约为对照组的3.5倍(图4B)。进一步将Fads1基因甲基化水平与大鼠血浆三酰甘油水平进行相关性分析,发现甲基化水平与三酰甘油水平呈正相关(R2=0.8175,P=0.002,图4C)。以上结果说明,大鼠体内Fads1基因甲基化率与血浆三酰甘油水平密切相关。

A:对照组和高脂饮食组大鼠Fads1基因测序图谱,箭头所指为具体发生甲基化的胞嘧啶;B:两组大鼠肝脏Fads1基因启动子区甲基化率,与对照组比较,n=4,*P<0.05;C:Fads1基因甲基化水平与大鼠血浆三酰甘油水平的相关性分析图4 Fads1启动子区甲基化水平与大鼠血浆三酰甘油水平的关系Fig.4 Relationship between methylation in Fads1 promoter region and plasma triglyceride levels in rats
2.5 高脂刺激下调大鼠肝细胞Fads1表达水平
体外培养大鼠肝细胞系BRL-3A,并用6%脂肪乳对细胞进行干预。在此条件下,胞内TG含量明显增多,约为对照组的2.1倍(P=0.0047),出现明显脂质沉积,胞内TC含量也有所上升,说明6%脂肪乳可成功诱导出细胞高脂模型(图5A、5B)。
随后,对细胞内Fads1的mRNA表达水平进行检测。实时荧光定量PCR显示,脂肪乳刺激组细胞Fads1表达水平较对照组显著下调,约为对照组的20%,这与体内实验结果类似。为探究在此过程中甲基化是否直接参与了Fads1的表达调控,选用不同浓度的5-氮杂胞苷(5-Aza,DNA甲基转移酶抑制剂)处理脂肪乳刺激的细胞,并检测Fads1 mRNA表达水平。结果显示,与单纯脂肪乳刺激组比,当5-Aza浓度大于5 μmol/L时,细胞内Fads1表达水平有所回升,约为对照组的40%(图5C)。说明高脂刺激可通过促进Fads1基因启动子区甲基化进而抑制其表达。
2.6 CpG甲基转移酶下调Fads1启动子区转录活性
为探究DNA甲基化对Fads1启动子区转录活性的影响,我们将Fads1基因启动子区片段与pGL3-Basic载体连接,构建荧光素酶报告基因质粒(图6A),同海肾荧光素酶质粒共转染进BRL-3A细胞,并利用M.SssI(CpG甲基转移酶)进行干预(甲基化处理),诱导细胞内甲基化水平升高。结果显示,与对照组相比,甲基化处理组的荧光素酶活性降低了约30%(P<0.05)(图6B)。
上述结果进一步说明,Fads1基因启动子区甲基化修饰水平增高导致其转录活性下降,Fads1表达量下调。

A:细胞内三酰甘油水平;B:细胞内总胆固醇水平;C:细胞内Fads1 mRNA相对表达量;与对照组比较,*P<0.05;与6%脂肪乳刺激组比较,#P<0.05图5 体外培养大鼠肝细胞系BRL-3A脂质沉积情况及Fads1表达量Fig.5 Lipid deposition and Fads1 expression in rat liver cell line BRL-3A cultured in vitro

A:荧光素酶报告基因质粒示意图;B:细胞内荧光素酶活性,pGL3-Fads1-U代表对照组,pGL3-Fads1-M代表M.SssI处理组,与对照组比较,*P<0.05图6 荧光素酶报告基因实验检测Fads1启动子区转录活性Fig.6 Detection of transcriptional activity of Fads1 promoter region by luciferase reporter gene assay
3 讨论
高三酰甘油血症作为最常见的血脂异常之一,与动脉粥样硬化性疾病、胰腺炎、非酒精性脂肪肝等多种疾病相关[9]。本研究在高三酰甘油血症的大鼠模型中,发现Fads1基因启动子区域DNA甲基化修饰增加,且与其血浆三酰甘油水平呈正相关,继而抑制Fads1基因转录,导致Fads1表达水平下降,影响血脂代谢。本研究为高三酰甘油血症所致的基因表达变化提供了新思路。
三酰甘油在体内合成、代谢过程极其复杂,涉及多种基因及多种调控模式[10]。其中,脂肪酸去饱和酶1(Fads1)是多不饱和脂肪酸合成的关键限速酶[11]。多不饱和脂肪酸omega-3主要通过Fads1进行代谢,生成二十二碳六烯酸(DHA)[12]。DHA在后续代谢过程中产生抗炎因子,抑制血小板凝聚。当Fads1失活时,会导致DHA生成减少,抗炎因子减少[13]。
目前,多个全基因组关联分析研究表明,Fads1基因多态性在心血管疾病的发生发展中起关键作用。研究表明Fads1 rs174537变异对拉美裔人群循环三酰甘油含量有较大的影响,会导致多不饱和脂肪酸的失衡及三酰甘油升高,并可能产生较高的心血管疾病风险[14]。在中国汉族人群,冠状动脉疾病和急性冠脉综合征患者中rs174556 T等位基因的频率较对照组显著升高[15]。本研究发现,Fads1表达量在高脂饮食组大鼠中明显降低,提示高脂饮食在升高大鼠血脂水平的同时,也影响着体内Fads1的表达,两者共同参与并影响了高三酰甘油血症的进程。
DNA甲基化修饰是真核生物最常见的表观遗传调控模式之一[16],近几年心血管领域内关于DNA甲基化修饰的研究也越来越多[17]。通过对Fads1基因启动子区序列进行分析,发现包含较多的CpG岛,即易发生DNA甲基化修饰的位点。对Fads1进行甲基化数量性状基因座(MQTL)分析,发现Fads1中3个CpG位点甲基化水平与Fads1的表达呈负相关[18]。在白细胞Fads1区域的关键调控区域,观察到rs174537和DNA甲基化之间的显著关联性,且还与循环中的omega-6和长链不饱和脂肪酸相关[19]。这说明DNA甲基化参与了Fads1的表达调控,继而影响下游的三酰甘油及长链不饱和脂肪酸代谢。
综上,本研究揭示了高脂状态下Fads1表达及其启动子区甲基化水平的基本变化规律。遗憾的是在本研究中未能检测大鼠血浆多不饱和脂肪酸的水平,高血脂状态对基因甲基化水平影响的更深层次作用机制仍有待进一步研究。
