PD-1抑制剂联合XELOX方案在中晚期肝癌中的应用
2023-06-25张剑飞罗佳丽
张剑飞 罗佳丽


【摘要】 目的:探討PD-1抑制剂联合XELOX方案在中晚期肝癌患者中的应用价值。方法:选择2019年7月-2021年7月景德镇市第一人民医院收治的60例中晚期肝癌患者为研究对象,采用随机数字表法分为试验组和对照组,各30例。试验组接受PD-1抑制剂联合XELOX方案化疗,对照组仅采用XELOX方案化疗。对患者进行一年随访,对比两组治疗效果、肿瘤标志物水平[甲胎蛋白(AFP)、糖类抗原199(CA199)]、不良反应及生存期。结果:两组总有效率比较,差异无统计学意义(P>0.05)。治疗后两组AFP、CA199水平均低于治疗前,差异均有统计学意义(P<0.05);治疗后,两组AFP、CA199水平比较,差异均无统计学意义(P>0.05)。试验组各不良反应发生率均低于对照组,差异均有统计学意义(P<0.05)。试验组总生存期(OS)、中位生存期(MST)、疾病进展时间(TTP)及无进展生存期(PFS)均长于对照组,差异均有统计学意义(P<0.05)。结论:PD-1抑制剂联合XELOX方案治疗可延长生存期,有效减少化疗期间不良反应,安全性高,值得推广应用。
【关键词】 肝癌 PD-1抑制剂 化疗 肿瘤标志物
Application of PD-1 Inhibitor Combined with XELOX Regimen in Advanced Liver Cancer/ZHANG Jianfei, LUO Jiali. //Medical Innovation of China, 2023, 20(12): 00-012
[Abstract] Objective: To investigate the application value of PD-1 inhibitor combined with XELOX regimen in patients with advanced liver cancer. Method: A total of 60 patients with advanced liver cancer who were admitted to Jingdezhen NO.1 People's Hospital from July 2019 to July 2021 were selected as research subjects and divided into the experimental group and the control group according to random number table method, with 30 cases in each group. The experimental group received PD-1 inhibitor combined with XELOX regimen chemotherapy, and the control group only received XELOX regimen chemotherapy. The patients were followed up for one year, and the therapeutic effect, tumor markers levels [alpha fetoprotein (AFP), carbohydrate antigen 199 (CA199)], adverse reactions and survival time were compared between the two groups. Result: There was no significant difference in the total effective rate between the two groups (P>0.05). After treatment, the levels of AFP and CA199 in both groups were lower than those before treatment, the differences were statistically significant (P<0.05). After treatment, there were no significant differences in AFP and CA199 levels between the two groups (P>0.05). The incidences of adverse reactions in the experimental group were lower than those in the control group, the differences were statistically significant (P<0.05). The overall survival (OS), median survival time (MST), time to progression (TTP) and progression free survival (PFS) in the experimental group were all longer than those in the control group, the differences were statistically significant (P<0.05). Conclusion: PD-1 inhibitor combined with XELOX regimen therapy can prolong the survival time, effectively reduce the adverse reactions during chemotherapy, and is safe and worthy of popularization and application.
[Key words] Liver cancer PD-1 inhibitor Chemotherapy Tumor markers
First-author's address: Jingdezhen NO.1 People's Hospital, Jiangxi Province, Jingdezhen 333000, China
doi:10.3969/j.issn.1674-4985.2023.12.003
肝脏是人类原发性癌症的第六大常见部位,通常发生在肝硬化和炎症的背景下,肝癌已经成为我国三大致死率最高的肿瘤之一[1-2]。肝癌患者早期往往因为无明显临床症状,发现时病情已进展至中晚期,从而错失最佳手术时机,导致手术病灶切除率较低,加之大部分肝癌患者合并严重的肝硬化,患者往往难以接受介入和各种消融手术,治疗方法相对匮乏[3-4]。近年来,免疫检查点程序性死亡受体1(programmed death-1,PD-1)阻断剂被研究证实在肝癌治疗领域具有良好的效果,然而,PD-1虽然疗效稳定,但起效慢,治疗期间很容易复发转移[5-6]。全身化疗是各种肿瘤手術切除后或不能进行手术治疗的肿瘤晚期患者的首选,但肝癌对常规化疗效果不明显[7-8]。目前,在中晚期肝癌治疗领域,联合用药已经成为一种新的治疗趋势,可避免单药治疗效果差,耐药等缺陷,探索联合治疗方式已经是各大肿瘤中心治疗肝癌的研究热点[9-10]。基于此,本研究探索PD-1联合XELOX方案在中晚期肝癌患者中的治疗效果,以为后续治疗提供新思路,现报道如下。
1 资料与方法
1.1 一般资料 选择2019年7月-2021年7月景德镇市第一人民医院收治的60例中晚期肝癌。纳入标准:甲胎蛋白(AFP)或糖类抗原199(CA199)阳性;不能耐受手术,或不能继续耐受介入治疗。排除标准:严重呼吸系统、心血管、肾脏等疾病;孕妇和哺乳期妇女;对本研究所用药物有过敏反应;精神疾病。采用随机数字表法将患者分为试验组和对照组,各30例。本研究经医院医学伦理委员会批准通过。患者及家属均对本次研究知情同意,签署同意书。
1.2 方法 试验组患者接受PD-1联合XELOX方案化疗,具体方案为:卡培他滨(生产厂家:正大天晴药业集团股份有限公司,批准文号:国药准字H20143044,规格:0.5 g),口服,第1~14天
1 000 mg/m2,早晚餐后服用,每天2次;奥沙利铂注射液(生产厂家:山东新时代药业有限公司,批准文号:国药准字H20133247,规格:50 mg)130 mg/m2静脉滴注,第1天;然后休息一周,即为一个完整的化疗周期。PD-1抑制剂具体用法:信迪利单抗[生产厂家:信达生物制药(苏州)有限公司,批准文号:国药准字S20180016,规格:10 mL︰100 mg]200 mg/次,每3周1次。对照组患者仅采用XELOX方案化疗,XELOX化疗方案与试验组一致。两组均化疗4个疗程。
1.3 观察指标及判定标准 (1)对患者进行一年随访,根据治疗前后的影像学结果评估两组治疗效果。完全缓解(CR):治疗后病灶基本消失;部分缓解(PR):治疗后病灶范围较治疗前缩小并且体积缩小超过一半;疾病稳定(SD):治疗后病灶范围较治疗前缩小但体积减小不超过一半;疾病进展(PD):经治疗,靶病灶最长径之和相比于治疗前增加幅度≥20%,或肝脏其他区域出现新的病灶。总有效=CR+PR。(2)对比两组血清肿瘤标志物水平。化疗前及化疗4个周期后分别取患者外周静脉血5 mL,以3 000 r/min速度,离心10 min后获得上层血清。采用免疫分析仪运用电化学发光法测定以下肿瘤标志物:AFP、CA199。(3)对比两组化疗不良反应。统计化疗期间患者肝肾毒性、胃肠道反应、骨髓抑制及神经毒性情况。(4)生存期分析。对所有患者进行一年随访,分组开始至末次随访或死亡的时间即患者的总生存期(OS),半数患者生存的时间即中位生存期(MST),分组开始至出现疾病进展即疾病进展时间(TTP),化疗开始后至肿瘤第一次发生进展或患者死亡时间即无进展生存期(PFS)。
1.4 统计学处理 采用SPSS 22.0软件处理数据。计量资料以(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料用率(%)表示,采用字2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 试验组男17例,女13例;年龄40~79岁,平均(59.22±5.19)岁;肿瘤直径:≤5 cm 11例,>5 cm 19例;病因:乙肝23例,其他7例;合并肝硬化23例;病理分期:Ⅲ期14例,Ⅳ期16例。对照组男16例,女14例;年龄40~80岁,平均(60.08±5.54)岁;肿瘤直径:≤5 cm 12例,>5 cm 18例;病因:乙肝22例,其他8例;合并肝硬化25例;病理分期:Ⅲ期13例,Ⅳ期17例。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 随访结果 随访一年,试验组共死亡3例,化疗期间死亡1例,死亡率为10.00%(3/30);对照组共死亡5例,化疗期间死亡2例,死亡率为16.67%(5/30)。两组总死亡率对比,差异无统计学意义(字2=0.144,P=0.704)。
2.3 两组治疗效果比较 两组总有效率比较,差异无统计学意义(字2=2.728,P=0.099),见表1。
2.4 两组血清肿瘤标志物水平比较 治疗后两组AFP、CA199水平均低于治疗前,差异均有统计学意义(P<0.05);治疗前及治疗后,两组AFP、CA199水平比较,差异均无统计学意义(P>0.05)。见表2。
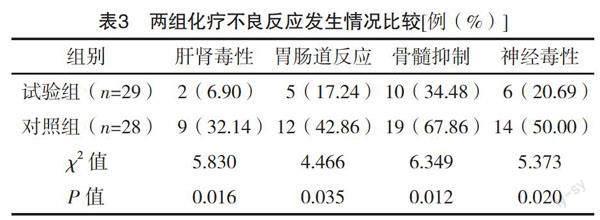
2.5 两组化疗不良反应发生情况比较 试验组各不良反应发生率均低于对照组,差异均有统计学意义(P<0.05),见表3。
2.6 两组患者生存期比较 试验组OS、MST、TTP及PFS均长于对照组,差异均有统计学意义(P<0.05),见表4。
3 讨论
早期肝癌患者的治疗方法主要包括根治性切除、介入治疗、靶向治疗和免疫治疗等,目前我国仅有不足30%的肝癌患者能被早期发现并行根治手术治疗[11]。对于不符合手术切除条件的晚期患者,经导管肝动脉化疗栓塞(TACE)和射频消融(RFA)可能是替代方法[12]。对于不能耐受手术及介入治疗的中晚期难治性肝癌患者的治疗方案选择是一大难题。PD-1受体阻断剂在肝癌治疗中疗效较为稳定,但是起效时间长,在治疗期间肿瘤再次转移播散的可能性大,很多患者失去了进一步治疗机会[13-14]。肝癌对常规细胞毒性化疗并不敏感,这是难治性或复发性肝癌患者的一大障碍,且已成为中晚期肝癌治疗的新趋势[15]。
免疫检查点抑制剂彻底改变了恶性肿瘤的治疗,目前PD-1治疗主要用于不可切除或转移性实体瘤。PD-1治疗可以引发有效的全身免疫,从而消除手术切除原发性肿瘤后残留的微转移[16]。此外,化疗已被证实具有增强肿瘤抗原性、干扰抑制性免疫途径和增加效应因子T细胞反应的特性。因此,PD-1治疗与化疗联合使用可能会导致更强、更广泛的肿瘤特异性T细胞反应。卡培他滨及奥沙利铂是一种新型抗癌药物,其具有广谱体外细胞毒性作用及抗肿瘤活性,肝肾毒性低,无交叉耐药,并且与其他化疗药物疗效相近,研究证实其用于晚期肝癌安全性高,并可控制病情進展[17-20]。AFP是临床早期筛查肿瘤的常用指标,多用于肝癌的诊断及疗效判别,但该指标在诊断中假阳性率较高,可达60%~80%,影响临床诊断;CA199多见于胃肠道肿瘤的相关抗原,将其与AFP联合应用能够在肝肿瘤良恶性诊断中获得较好效果。本研究结果表明,两组总有效率、AFP、CA199水平比较,差异均无统计学意义(P>0.05);试验组不良反应发生率均低于对照组,OS、MST、TTP及PFS均长于对照组,差异均有统计学意义(P<0.05),表明采用PD-1联合XELOX化疗方案在中晚期肝癌治疗中能够有效缓解病情,延长患者生存期,降低不良反应发生率,安全性高。因晚期癌症患者更容易产生肝肾毒性、胃肠道反应、骨髓抑制及神经毒性等不良反应,联合PD-1可有效减少不良反应情况的发生,本研究探索性分析进一步表明,PD-1辅助化疗在高危人群中更有益。
综上所述,PD-1联合XELOX化疗方案能够有效缓解早晚期肝癌患者病情,降低血清肿瘤标志物水平,且不良反应较少,患者生存期较长,安全性高,值得推广应用。
参考文献
[1]中国抗癌协会肝癌专业委员会转化治疗协作组,樊嘉.肝癌转化治疗中国专家共识(2021版)[J].中华消化外科杂志,2021,20(6):600-616.
[2]袁云,徐国辉.XELOX方案治疗晚期原发性肝癌的效果及对血清肿瘤标志物水平的影响[J].解放军医药杂志,2017,29(6):44-47.
[3]孟田田,张桐桐,邓秋,等.血府逐瘀汤辅助XELOX化疗治疗对晚期肝癌患者血清HIF-1α及TSP-1表达的影响[J].中西医结合肝病杂志,2022,32(7):606-609.
[4]黄应杰,莫斌书.贝伐珠单抗联合奥沙利铂、卡培他滨治疗转移性结直肠癌对患者肿瘤标志物和肝肾功能的影响[J/OL].现代医学与健康研究电子杂志,2022,6(9):41-43.https://xueshu.baidu.com/usercenter/paper/show?paperid=1v580e205c3806v04g7a0600yv292579&site=xueshu_se.
[5]张雯雯,胡丙洋,韩骏,等.PD-1抑制剂与多靶点酪氨酸激酶抑制剂联合方案用于进展期肝癌转化治疗研究的初步报告[J].中华肝胆外科杂志,2020,26(12):947-948.
[6]柳利利,张成仁,郝相勇,等.生物标志物预测肝细胞癌患者抗PD-1/PD-L1治疗客观疗效的研究进展[J].中国普通外科杂志,2022,31(7):966-974.
[7]张伟明,覃岭,赵艳.可溶性PD-1和可溶性PD-L1与肝细胞癌预后关系的Meta分析[J].胃肠病学和肝病学杂志,2022,31(7):812-818.
[8]吴君,韩萍,张志勇,等.血清VEGF、AFP水平对晚期肝癌TACE联合PD-1抑制剂疗效的评估价值[J].山东医药,2022,62(19):16-19.
[9]刘碧玉,王琦,臧超然,等.PD-1抑制剂与抗血管生成药在肝癌治疗中的研究进展[J].北京医学,2022,44(4):334-335,340.
[10]张晓赟,朱心睿,彭伟,等.经肝动脉化疗栓塞+仑伐替尼+PD-1单抗在中晚期不可切除肝癌转化切除中的安全性和有效性的前瞻性队列研究:初步报告[J].中国普外基础与临床杂志,2022,29(1):39-45.
[11] WANG J,LI J,TANG G,et al.Clinical outcomes and influencing factors o f PD-1/PD-L1 in hepatocellular carcinoma[J].Oncol Lett,2021,21(4):279.
[12] HAN Y,LIU D,LI L.PD-1/PD-L1 pathway: current researches in cancer[J].Am J Cancer Res,2020,10(3):727-742.
[13]周秀芬,刘英果,孙容花,等.恩替卡韦联合奥沙利铂、卡培他滨治疗对乙型肝炎病毒相关晚期肝细胞癌患者外周血淋巴细胞亚群的影响[J].中国肝脏病杂志,2020,12(3):79-84.
[14]毛靖,严强,沈振华,等.PD-1和PD-L1抑制剂在中晚期肝细胞癌中的应用及展望[J].中华外科杂志,2021,59(10):875-880.
[15]买为丽旦·衣明江,塔来提·吐尔干,陈新华,等.免疫检查点阻断剂PD-1抗体在小鼠肝细胞癌治疗中的应用[J].山西医科大学学报,2021,52(12):1517-1522.
[16] ZHEN L,JIA L C,YONG F,et al.the efficacy and safety of apatinib treatment for patients with unresectable or relapsed liver cancer: a retrospective study[J].J Cancer,2018,9(16):2773-2777.
[17]崔丽敏,赵冀安.PD-1抗体联合治疗对肝切除术后难治性复发肝癌患者生存率及免疫功能的影响[J].解放军医药杂志,2022,34(2):36-39,52.
[18]曹玉娟,赵聪,姚艳红,等.西妥昔单抗联合化疗治疗KRAS基因野生型晚期结直肠癌伴肝转移患者临床效果观察及预后影响因素分析[J].临床军医杂志,2021,49(8):883-886.
[19]朱小长,陶连元,陈周兵.新辅助化疗对结直肠癌肝转移老年患者的效果及安全性[J].肝胆胰外科杂志,2021,33(12):721-724,754.
[20]岳丽,程颖,耿海云,等.卡培他滨节拍治疗肝细胞癌伴脾亢所致血小板低下1例[J].临床肿瘤学杂志,2022,27(5):478-480.
(收稿日期:2022-11-01) (本文编辑:陈韵)
