黄芪甲苷对小胶质细胞NLRP3/Caspase-1通路相关蛋白表达的影响
2023-06-21杨治伦陈小江陈飞飞原茜倩马全瑞
杨治伦, 陈小江, 陈飞飞, 原茜倩, 马全瑞, 秦 毅
(宁夏医科大学基础医学院人体解剖与组织胚胎学系,银川 750004)
小胶质细胞作为中枢神经系统(central nervous system,CNS)中固有的免疫效应细胞,其在许多神经疾病中可介导产生神经炎症[1],造成二次损伤[2],这一过程往往伴随着细胞焦亡的发生[3],其通过介导胞膜穿孔来加剧神经炎性反应[4-5]。因此,寻找可以有效抑制细胞焦亡的药物具有重要的临床意义。研究[6]表明,黄芪提取物黄芪甲苷(astragaloside IV,AS-IV)可以有效抑制缺血性脑损伤大鼠模型中与焦亡发生相关的NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)、含半胱氨酸的天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase 1,Caspase-1)、胞膜穿孔蛋白D(gasdermin D,GSDMD)、白细胞介素(interleukin,IL)-1β 产生。但是,AS-IV 对于小胶质细胞是否有相似的抑制作用尚未可知。为了进一步探究其是否存在抑制作用,本研究以AS-IV 干预小胶质细胞系(BV2),探讨不同浓度AS-IV 对凝血酶激活的小胶质细胞表达焦亡相关因子的影响,并对相关机制进行分析,以期为AS-IV 应用于临床治疗神经炎性反应提供理论依据。
1 材料与方法
1.1 主要试剂
小鼠小胶质细胞BV2 细胞系购于广州赛库生物技术有限公司;AS-IV 标准品(20 mg,纯度≥98%)购于北京索莱宝科技有限公司;凝血酶(T4648-1KU)购于美国Sigma 公司;ECL 化学发光底物试剂盒购于江苏凯基生物技术有限公司;凋亡相关斑点样蛋白(apoptosis-associated specklike protein containing CARD,ASC)、Caspase-1、GSDMD 多克隆抗体、Cy3 荧光Rabbit 二抗、HRP标记Mouse 二抗、HRP 标记Rabbit 二抗均购于武汉爱博泰克生物科技有限公司;NLRP3 多克隆抗体购于北京博奥森生物技术有限公司;β-actin单克隆抗体购于英国Abcam 公司;北美胎牛血清(fetal bovine serum,FBS)购于美国Gibco 公司;小鼠IL-1β 及IL-18 ELISA 试剂盒均购于上海酶联生物科技有限公司。
1.2 细胞培养
将BV2 细胞培养在DMEM 高葡萄糖全培养基[含有10%热灭活FBS、1%青链霉素混合液(100×),青霉素10 kU·mL-1,链霉素10 mg·mL-1]中,并置于37 °C、5%CO2培养箱中进行培养,每24 h 按照1∶3 比例传一代。凝血酶药物浓度参照Ye 等[7]测定的药物实验浓度,选定适宜的凝血酶浓度范围,加药观察BV2 细胞状态,最终确定以20 U·mL-1凝血酶作为制备模型浓度;AS-IV 药物浓度参照Yu 等[8]作用BV2 细胞的药物实验浓度,并利用CCK-8 法检测药物浓度范围内的细胞活力,最终确定以1、5、10 μmol·L-1作为AS-IV 干预浓度。
观察所培养细胞的状态,待其稳定后,将BV2 细胞随机分为5 组:Control 组(正常对照组)、凝血酶组(20 U·mL-1)、1 μmol·L-1AS-IV 组(20 U·mL-1凝血酶+1 μmol·L-1AS-IV)、5 μmol·L-1AS-IV 组(20 U·mL-1凝血酶+5 μmol·L-1AS-IV)、10 μmol·L-1AS-IV 组(20 U·mL-1凝 血 酶+10 μmol·L-1AS-IV)。其中AS-IV 组的AS-IV 与凝血酶同时加入培养液中,培养24 h。
1.3 免疫印迹检测BV2 细胞ASC、NLRP3、Caspase-1、gasdermin D-N 端(GSDMD-N)的表达
将BV2 细胞按照1.2 所述分组后,在25 cm2培养瓶中培养24 h 后,消化并离心,取出细胞沉淀,加入裂解液裂解细胞以获得胞内蛋白,低温离心(12 000 r·min-1,4 °C,10 min)后吸出上清,利用BCA 法测得总蛋白浓度,加入适量上样缓冲液后95 ℃加热10 min 使其变性,电泳、转膜后,5%牛奶4 °C 封闭过夜,加入ASC、NLRP3、Caspase-1、GSDMD-N、β-actin(稀释比例均为1∶1 000)抗体4 °C 过夜,回收一抗,用TBST 溶液洗涤5 次,加入HRP 二抗(1∶4 000)摇床孵育1 h后滴加ECL 发光液行化学发光显色,以β-actin为内参蛋白。利用Image J 软件进行灰度值分析,目的蛋白相对表达量=目的蛋白灰度值/β-actin灰度值。
1.4 免疫荧光染色检测BV2 细胞ASC、NLRP3、Caspase-1、GSDMD-N 的表达
将BV2 细胞以1×105个/孔接种至已含有玻片的24 孔板中进行细胞爬片并培养24 h,再按照1.2 所述分组加药培养24 h,对细胞进行固定(4%多聚甲醛,15 min),以0.25% 曲拉通X-100的PBS 溶液通透20 min,PBS 浸洗3 次,以封闭用正常羊血清室温封闭30 min;分别滴加ASC、NLRP3、Caspase-1、GSDMD-N 抗体(1∶200),4 °C孵育过夜,PBS 浸洗5 次;加入Cy3 红色荧光标记二抗(1∶300),37 °C 避光孵育1 h,PBS 浸洗5次;最后用抗荧光淬灭封片剂封片。在荧光显微镜下(×100)随机选取每组3 个视野摄片,并用Image J 软件进行区域平均荧光强度测定,最终结果与Control 组相比,获得相对荧光强度比值。
1.5 ELISA 法测定细胞培养液中IL-1β 及IL-18 的含量
将BV2 细胞按1×105个/孔密度接种至24孔板培养24 h,随后按照1.2 所述分组加药培养24 h,培养完成后,将不同组细胞培养液取出,以1 000×g离心15 min。将含有抗体的酶标板分别设置空白孔、标准孔及待测样品孔。随后按试剂盒说明书进行操作,直至加完终止液后,在20 min 内测量波长在450 nm 处的OD 值,并以标准曲线求得各待测样品孔内的实际浓度。
1.6 统计学方法
采用OriginPro 2021 软件进行数据分析及绘图。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 免疫印迹法检测AS-IV 对BV2 细胞焦亡相关因子表达的影响
免疫印迹检测显示,凝血酶组ASC、NLRP3、Caspase-1、GSDMD-N 与Control 组相比,各蛋白表达水平均升高(P均<0.05);与凝血酶组相比,1、5、10 μmol·L-1AS-IV 组中ASC、NLRP3、Caspase-1、GSDMD-N 各蛋白表达水平均有不同程度下降(P均<0.05);与1 μmol·L-1AS-IV 组比较,5、10 μmol·L-1AS-IV 组ASC、NLRP3 表达均降低(P均<0.05),而5、10 μmol·L-1AS-IV 两组间差异均无统计学意义(P均>0.05);此外,Caspase-1、GSDMD-N 在1、5、10 μmol·L-1AS-IV 实验组间差异均无统计学意义(P均>0.05),见图1。
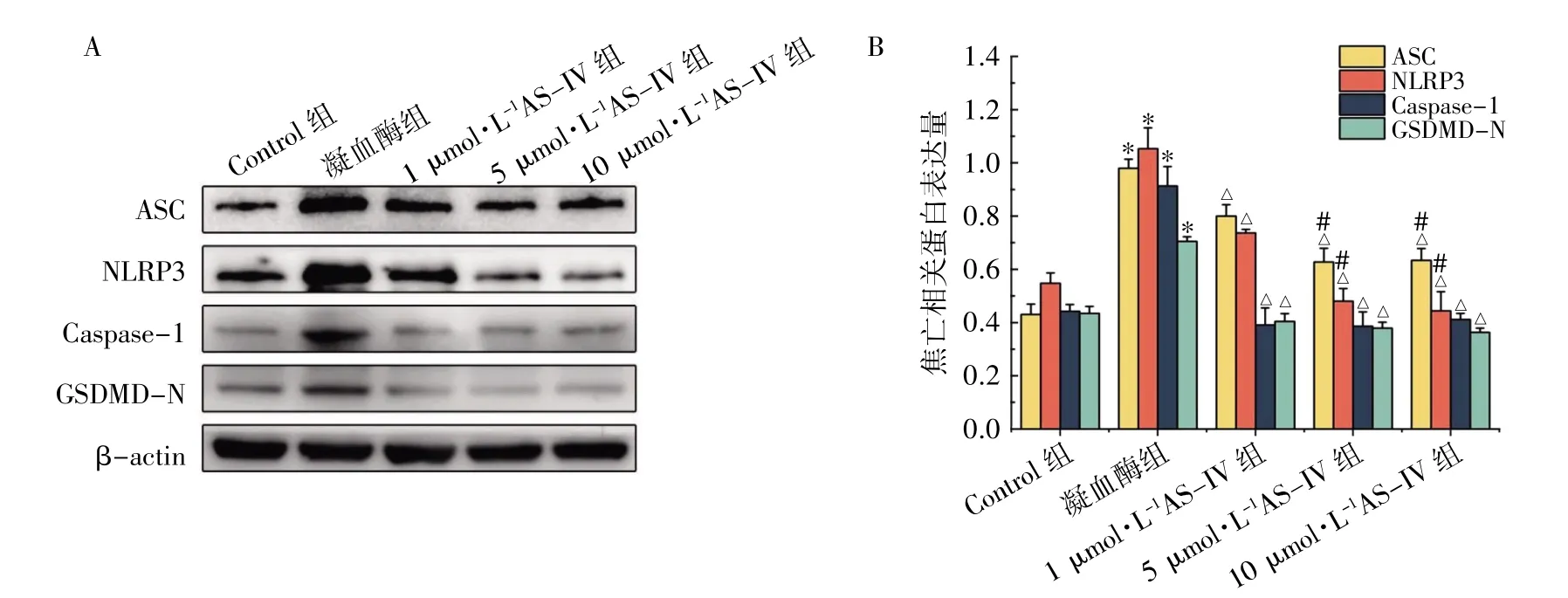
图1 免疫印迹法检测AS-IV 对BV2 细胞焦亡相关因子表达的影响(n=3)
2.2 免疫荧光染色法检测AS-IV 对BV2 细胞焦亡相关因子表达的影响
免疫荧光染色显示,Control 组ASC、NLRP3、Caspase-1、GSDMD-N 的荧光Cy3 红色荧光染料着色细胞少,荧光强度低;与Control 组相比,凝血酶组ASC、NLRP3、Caspase-1、GSDMD-N 的着色细胞明显增多,荧光强度增高(P均<0.05);与凝血酶组比较,1、5、10 μmol·L-1AS-IV 组ASC、NLRP3、Caspase-1、GSDMD-N 的着色细胞均减少,荧光强度均降低(P均<0.05);其中,ASC、NLRP3、GSDMD-N 在5、10 μmol·L-1AS-IV 组中的荧光强度较1 μmol·L-1AS-IV 组均降低(P均<0.05),而5、10 μmol·L-1AS-IV 两组间差异均无统计学意义(P均>0.05);此外,Caspase-1 在1、5、10 μmol·L-1AS-IV 组中差异均无统计学意义(P均>0.05),见图2。
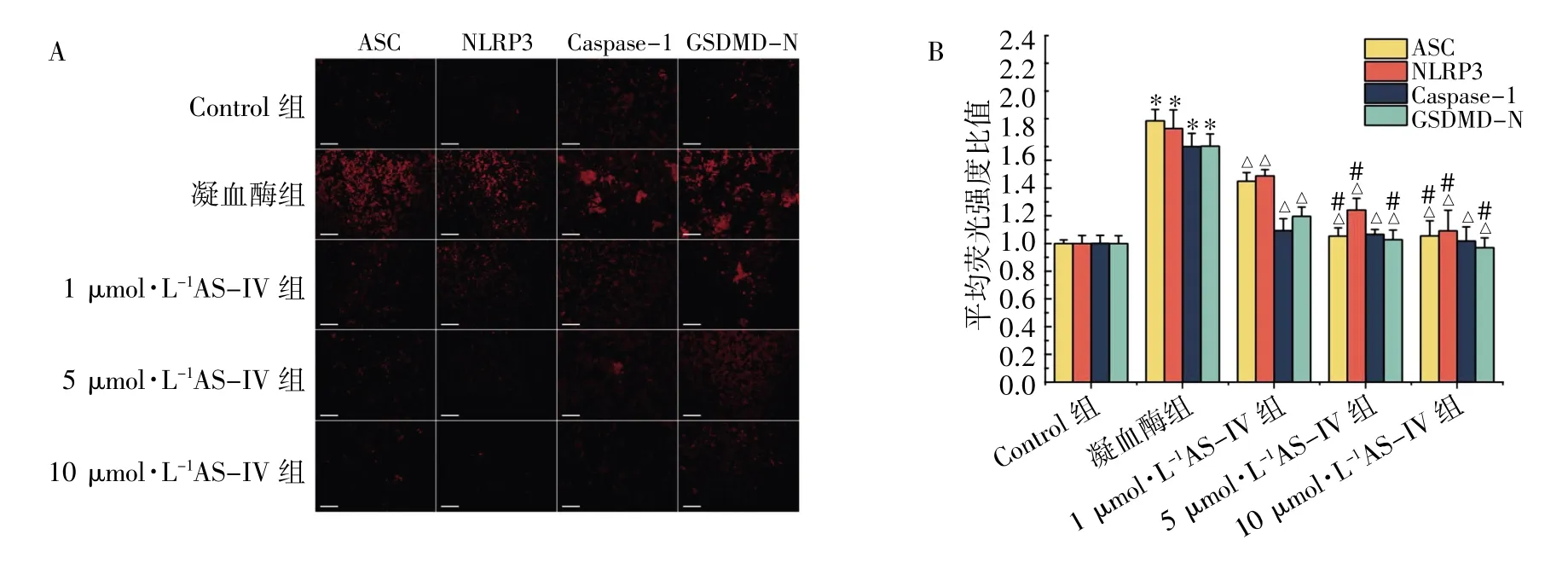
图2 免疫荧光染色法检测AS-IV 对BV2 细胞焦亡相关因子表达的影响
2.3 ELISA 法检测AS-IV 对BV2 细胞培养液中IL-1β 与IL-18 含量的影响
ELISA 结果显示,与Control 组比较,凝血酶组的培养液中IL-1β、IL-18 的含量均上升(P均<0.05);1、5、10 μmol·L-1AS-IV 组培养液中IL-1β、IL-18 含量均低于凝血酶组(P均<0.05),其中,5、10 μmol·L-1AS-IV 组的培养液中IL-1β、IL-18 含量均低于1 μmol·L-1AS-IV 组(P均<0.05),而5、10 μmol·L-1AS-IV 组比较,差异均无统计学意义(P均>0.05),见图3。
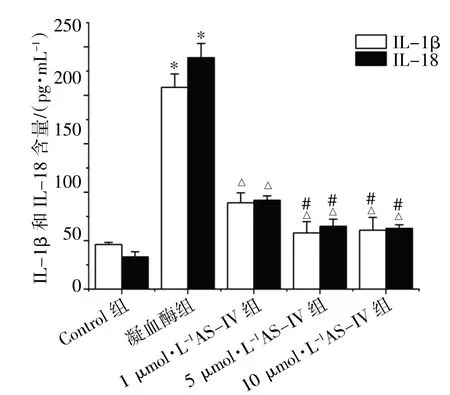
图3 ELISA 检测AS-IV 对BV2 细胞培养液中IL-1β与IL-18 含量的影响(n=5)
3 讨论
由于目前对神经炎症所产生的不良后果尚无有效的方式或药物进行治疗[9],故如何有效减少神经退行性疾病所伴随的神经炎性反应受到越来越多学者的关注。作为CNS 中炎性因子的主要释放来源,小胶质细胞在过去的研究中被证实可调控神经炎性反应的强弱[2]。因此,很多研究试图通过干预小胶质细胞的反应,从源头减少炎性因子的分泌。在小胶质细胞产生炎性反应并释放炎性因子的过程中,需要借助多条炎性信号通路来实现,其中细胞焦亡通路是近年来新发现的一条炎性反应通路[10]。该通路由核转录因子-κB调控促使ASC、NLRP3、pro-Caspase-1 组成的三聚体(NLRP3 炎性小体)切割产生Caspase-1,随后Caspase-1 切割GSDMD 致使胞膜穿孔[5],使细胞将内容物释放到周围环境中产生强烈的炎性反应。因此,若能有效抑制小胶质细胞发生细胞焦亡,便可以减少其所导致的神经炎性反应,为临床治疗神经炎症提供新思路。
黄芪在以往的炎性模型研究中表现出较强的抗炎能力,如高糖诱导的血管内皮炎性模型[11],寡聚Aβ 诱导的阿尔茨海默病模型[12]等。利用AS-IV 干预由脂多糖(LPS)激活的小胶质细胞,结果显示,AS-IV 可以减少小胶质细胞分泌炎性因子,并促使其由M1 型向M2 型转化[8]。另外,郑心甜等[13]在脑缺血大鼠模型上也验证了这一结果。上述研究表明,AS-IV 可以抑制小胶质细胞产生的炎性反应,但其对于焦亡通路是否起到了抑制作用尚未可知。为此,本研究利用凝血酶来激活小胶质细胞并使用AS-IV 进行干预,观察其焦亡通路相关因子的表达是否有所下降,来验证AS-IV 对小胶质细胞发生焦亡是否有抑制作用,以期将来对AS-IV 的抗炎机制做进一步阐释。
本研究免疫印迹结果显示,与Control 组比较,凝血酶组传导焦亡信号的主要蛋白因子(ASC、NLRP3、Caspase-1)的表达量升高,与Ye 等[7]所测结果相似,这说明凝血酶可以刺激小胶质细胞产生焦亡相关因子。但处在焦亡通路下游的GSDMD 蛋白是近年来新发现的蛋白[5],目前在凝血酶模型中未见对此类蛋白的测定。通常,此蛋白被剪切后的N 端(GSDMD-N)充当着细胞焦亡执行者的角色,这是直接导致焦亡发生的蛋白,因此测定其表达量的变化,便可以证明细胞焦亡的发生。本研究测定GSDMD-N 在凝血酶模型中也有同样的上升趋势,说明凝血酶模型中小胶质细胞会发生由GSDMD-N 介导的胞膜穿孔。在经过AS-IV 干预后,小胶质细胞体内焦亡相关因子(ASC、NLRP3、Caspase-1、GSDMD-N)的表达量与凝血酶组相比均有下降,并且相较于1 μmol·L-1AS-IV组,5、10 μmol·L-1AS-IV 组中ASC、NLRP3 的下降程度更加明显。与免疫印迹结果相似的是,在免疫荧光结果中,凝血酶组的小胶质细胞着色较多、荧光强度高,并且荧光强度较高的细胞有明显的聚集性,推测当小胶质细胞发生焦亡后,其释放的炎性因子会刺激周围未发生焦亡的细胞活化,促使其相互聚集,继而进一步产生级联放大反应。而使用AS-IV 干预后,荧光强度降低,着色细胞减少,原本在凝血酶组中的聚集现象也明显减少,并且5、10 μmol·L-1AS-IV 组中的ASC、NLRP3、GSDMD-N 荧光强度较1 μmol·L-1AS-IV组更低,说明5、10 μmol·L-1AS-IV 可有效抑制小胶质细胞中焦亡相关因子的上升,推测这类蛋白表达量的总体下降可能与AS-IV 调控核转录因子-κB 的表达有关。以上实验结果说明,AS-IV可有效抑制小胶质细胞发生细胞焦亡及与焦亡相关的炎性反应,并且较高浓度的AS-IV 可以起到更强的抗焦亡作用。此外,在细胞焦亡通路的下游,Caspase-1 除诱导GSDMD 蛋白发生切割致使胞膜穿孔外,其另一个主要作用是剪切pro-IL-1β 与pro-IL-18 形成IL-1β 与IL-18 并释放到胞外[14]。IL-1β 与IL-18 作为关键的促炎因子,参与多种炎性反应的发生。对此,本研究利用ASIV 干预凝血酶活化的小胶质细胞后,测定其培养液中IL-1β 与IL-18 分泌量的变化发现,其分泌量均低于凝血酶组,并且与1 μmol·L-1AS-IV组比较,5、10 μmol·L-1AS-IV 组培养液中IL-1β与IL-18 的含量更低。说明AS-IV 在抑制小胶质细胞发生焦亡的过程中,可有效地减少其向培养液中分泌炎性因子,特别是Caspase-1 的减少会使被剪切后产生的IL-1β 与IL-18 更少,因此其分泌量下降。
综上所述,AS-IV 能够有效抑制凝血酶激活的小胶质细胞表达焦亡相关蛋白,同时也降低其下游相关炎性因子的分泌,表明AS-IV 抑制活化的小胶质细胞发生焦亡可能是其抑制小胶质细胞炎性反应的机制之一。
