白消安诱导雄性高促性腺激素性性腺功能减退症小鼠模型的构建
2023-06-21许红秀王苗苗陈耀平
许红秀, 王苗苗, 陈耀平
(1. 宁夏医科大学,银川 750004; 2. 宁夏医科大学总医院,银川 750004)
雄性高促性腺激素性性腺功能减退症指因睾丸本身发育不良或受到各种损伤,导致睾丸分泌睾酮和产生精子能力下降,伴有垂体卵泡刺激素(follicle stimulating hormone,FSH)和黄体生成素(luteinizing hormone,LH)水平升高[1]。FSH 在诱导和维持精子发生中起着至关重要的作用,主要通过与支持细胞上的卵泡刺激素受体(FSHR)特异性结合发挥其功能,FSHR 介导的信号传导是睾丸对FSH 的正常反应所必需的[2]。在睾丸功能异常的男性中,抑制素B 随着FSH 血浆水平的升高而下降[3]。因此,不育患者中FSH 浓度高被认为是生精异常的标志。LH 与FSH 同属于促性腺激素,两者协同促进精子成熟。LH 通过控制睾酮的分泌,进而调控精子的产生,与FSH 相同,LH 也需要与睾丸间质细胞膜上存在的特异性受体黄体生成素受体(LHR)结合,才能促进睾丸间质细胞分泌雄性激素[4]。高促性腺激素性性腺功能减退症的具体发病机制尚未明确。目前针对无精子症发病机制研究的动物模型比较多见,但对于雄性高促性腺激素性性腺功能减退症的动物模型鲜有报道。无精子症动物模型的建立有电离辐射法[5]、化疗药物注射法和激素注射法[6]等,但无精子症动物模型的建立不注重性激素水平的变化,同样的化疗法造模。有研究[7]显示,无精子症动物模型表现出高促性腺激素水平,也有研究[8]报道,无精子症动物模型促性腺激素水平正常甚至表现为低促性腺激素水平[9],因此缺乏稳定的雄性高促性腺激素性性腺功能减退症小鼠模型。化疗药物诱导无精子症模型制备时,给药方法多为大剂量单次腹腔注射,容易造成动物死亡率高、模型不稳定等。本研究选择小剂量持续刺激法腹腔注射,已有研究[10]显示,该方法可降低小鼠死亡率,且模型稳定。同时,常见的无精子症动物模型制备成功与否的评判标准几乎均为精子数量、睾丸质量[11]、睾丸病理染色等,缺乏系统的评判方法。因此,本研究选择ICR 小鼠作为实验对象,通过腹腔注射白消安的方法建立雄性高促性腺激素性性腺功能减退症模型,采用睾丸系数、睾丸病理评分、精子数量及活力、曲细精管直径、生精上皮厚度、血清性激素水平、睾丸HE染色等方法评判造模效果,建立稳定性好、重复性高的性腺功能低下、促性腺激素水平高的小鼠模型。
1 材料与方法
1.1 研究对象与材料
1.1.1 实验动物 20 只SPF 级雄性ICR 小鼠,体质量40~55 g,由宁夏医科大学实验动物中心提供[许可证号:SCXK(宁)2020-0001],饲养环境温度为22~25 ℃,相对湿度为50%~60%,光照12 h亮/12 h 暗。实验过程严格按照动物伦理学标准操作,经宁夏医科大学伦理委员会批准(IACUCNYLAC-2021-028)。
1.1.2 实验主要试剂 白消安(Sigma-Aldrich,美国);二甲基亚砜(DMSO,Sigma-Aldrich,美国);生理盐水(湖南科伦制药有限公司,中国);小鼠睾酮ELISA 检测试剂盒(上海江莱生物科技有限公司,中国);小鼠FSH ELISA 检测试剂盒(上海江莱生物科技有限公司,中国);小鼠LH ELISA检测试剂盒(上海江莱生物科技有限公司,中国);无水乙醇(国药集团化学试剂有限公司,中国);二甲苯(国药集团化学试剂有限公司,中国);HE染液套装(武汉赛维尔生物科技有限公司,中国);中性树胶(国药集团化学试剂有限公司,中国)。1.1.3 实验主要仪器 多功能微孔板检测仪(BioTek,美国);电热恒温培养箱(上海力申科学仪器有限公司,中国);脱水机(Diapath,意大利);包埋机(武汉俊杰电子有限公司,中国);病理切片机(上海徕卡仪器有限公司,中国);冻台(武汉俊杰电子有限公司,中国);组织摊片机(浙江省金华市科迪仪器设备有限公司,中国);染色机(Diapath,意大利);烤箱(天津市莱玻特瑞仪器设备有限公司,中国);载玻片(武汉赛维尔生物科技有限公司,中国);正置光学显微镜(尼康,日本);成像系统(尼康,日本)。
1.2 实验分组
选取健康SPF 级雄性ICR 小鼠20 只,按照随机数表法分为3 组:对照组(6 只),实验组分3 mg·kg-1×10 d 组(7 只)、4 mg·kg-1×10 d 组(7 只)。对照组给予DMSO 与生理盐水等量混合后腹腔注射,实验组给予白消安溶于DMSO 与生理盐水等量混合液后腹腔注射,连续注射10 d。各组实验动物实验过程中均无脱失,全部进入结果分析。
1.3 雄性高促性腺激素性性腺功能减退症小鼠模型制备
参考文献[12-13],结合预实验结果进行。1.3.1 药物配制 1)对照组药物配制:1 mL DMSO 与1 mL 生理盐水混合制成混合液。2)实验组药物配制:先将3 mL DMSO 与3 mL 生理盐水混合制成混合液,之后向此混合液内加入0.003 g白消安,摇匀后制成白消安注射液,使其终浓度为0.5 mg·mL-1。
1.3.2 腹腔注射 对小鼠下腹用酒精棉球擦拭消毒,用1 mL 一次性注射器吸取造模药物,待小鼠下腹部晾干后进针回抽确认,无其他液体及杂质吸出时进行腹腔注射。连续腹腔注射10 d,1次/d,每次在同时间(上午9 点左右)注射。对照组每日给药剂量为0.2 mL。3 mg·kg-1×10 d组每日给药剂量为3 mg·kg-1,注射总剂量为30 mg·kg-1;4 mg·kg-1×10 d 组每日给药剂量为4 mg·kg-1,注射总剂量为40 mg·kg-1。
1.4 主要观察指标
给药40 d 后,乙醚麻醉处死小鼠,摘眼球取血,手术剥取双侧睾丸及附睾,右侧睾丸及附睾用于观察精子数量及活力,左侧睾丸用于HE 染色。
1.4.1 小鼠体质量变化 将电子秤除皮调零,将小鼠放置于电子秤中称重记录。给药当天第1 次称重,此后每4 d 称重1 次,直至取材当天。
1.4.2 睾丸系数 小鼠乙醚吸入麻醉后,剪开腹腔,分离睾丸,电子秤调零后称重并记录睾丸湿重,睾丸系数(%)=睾丸湿重/小鼠体质量×100%。
1.4.3 小鼠睾丸Johnson 评分 将小鼠睾丸组织切片在光学显微镜下观察,对生精小管进行Johnson 评分[14]。
1.4.4 精子数量及活力 取右侧附睾于1 mL 37 ℃生理盐水中剪碎,继续37 ℃水浴5 min,吸管吹打30 次制成精子悬液,用擦镜纸过滤组织碎片后取适量滤液滴入血球计数板进行计数[15]。每个样本观察3 个视野,评估每只小鼠附睾的精子活力。参照文献[16]的方法将精子活动力分为4 级:Ⅰ级快速直线向前运动,精子活动能力极好;Ⅱ级直线向前运动,精子活动能力较好;Ⅲ级向前曲线运动,精子活动能力一般;Ⅳ级原地蠕动,精子活动能力差。
1.4.5 曲细精管直径及生精上皮厚度 将HE染色的睾丸组织切片用扫描仪扫描后,用Case-Viewer 软件统计视野下曲细精管直径及生精上皮厚度,每张组织切片至少选取50 个曲细精管进行统计。
1.4.6 小鼠血清性激素水平 小鼠所采血液样本于3 000 r·min-1离心20 min,离心后取血清置于新的离心管中,于-80 ℃冰箱中低温保存。检测时取出,于冰上缓慢溶解,按照ELISA 试剂盒说明书操作,检测血清FSH、LH 及睾酮水平。
1.4.7 小鼠睾丸HE 染色:取左侧睾丸组织固定于动物睾丸组织固定液内。之后将组织目的部位修切平整,脱水,包埋,切片。苏木精-伊红染色,显微镜镜检,分别采集200×(50 μm)、400×(20 μm)视野图像分析。
1.5 统计学方法
采用SPSS 26.0 统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 小鼠体质量变化
前10 d 为给药期间体质量,实验组小鼠开始给药后体质量略有下降,随着时间的推移,3组小鼠体质量均呈上升趋势,各组小鼠体质量比较,差异无统计学意义(P>0.05),见图1。
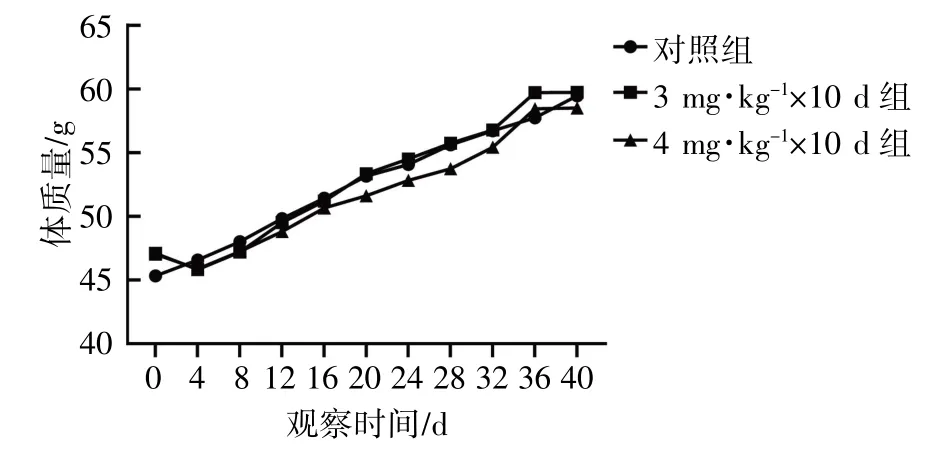
图1 小鼠体质量变化
2.2 小鼠睾丸系数比较
与对照组比较,实验组小鼠的睾丸系数随着给药剂量增加呈下降趋势,差异均有统计学意义(P均<0.05),见图2。
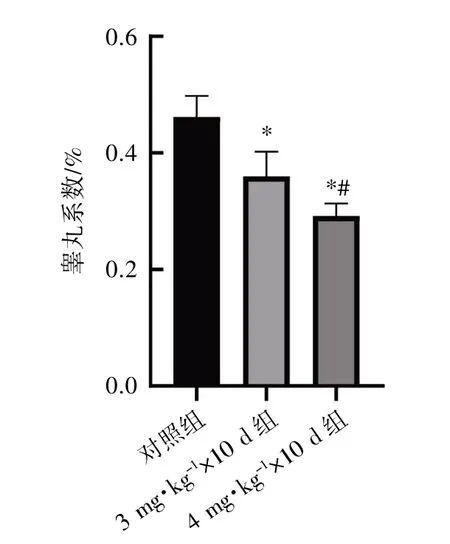
图2 小鼠睾丸系数比较
2.3 小鼠睾丸Johnson 评分比较
结果表明,3 mg·kg-1×10 d 组小鼠睾丸Johnson 评分低于对照组,4 mg·kg-1×10 d 组小鼠睾丸Johnson 评分低于对照组和3 mg·kg-1×10 d 组(P均<0.05),见图3。
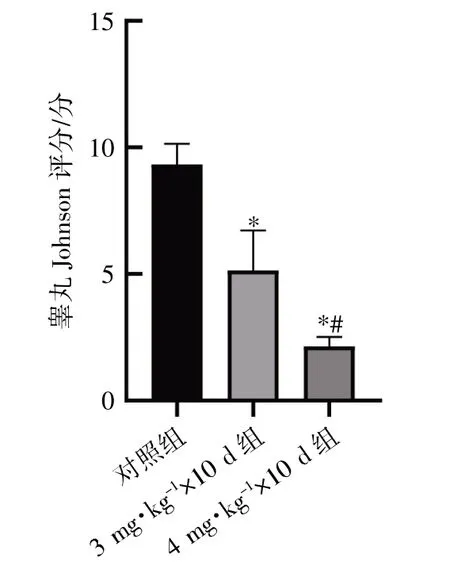
图3 小鼠睾丸Johnson 评分比较
2.4 小鼠精子数量及活力等级比较
给药后,3 组小鼠精子数量比较,差异有统计学意义(F=882.5,P<0.001)。3 mg·kg-1×10 d 组和4 mg·kg-1×10 d 组精子数量均低于对照组,且4 mg·kg-1×10 d 组低于3 mg·kg-1×10 d 组(P均<0.05)。3 mg·kg-1×10 d 组精子多为直线向前运动精子,而4 mg·kg-1×10 d 组多为Ⅳ级精子,活动能力极差,见表1。

表1 小鼠精子数量及活力等级比较
2.5 小鼠曲细精管直径比较
给药后,3 组小鼠曲细精管直径比较,差异有统计学意义(F=412.50,P<0.001)。与对照组比较,3 mg·kg-1×10 d 组和4 mg·kg-1×10 d 组小鼠的曲细精管直径均变细,且4 mg·kg-1×10 d 组小于3 mg·kg-1×10 d 组(P均<0.05),见表2。
表2 小鼠曲细精管直径比较( ±s,μm)

表2 小鼠曲细精管直径比较( ±s,μm)
与对照组比较*P<0.05;与3 mg·kg-1×10 d 组比较#P<0.05。
组别 n 曲细精管直径对照组 6 227.98±9.80 3 mg·kg-1×10 d 组 7 136.39±7.88*4 mg·kg-1×10 d 组 7 104.33±6.28*#F 值 412.50 P 值 <0.001
2.6 小鼠生精上皮厚度比较
给药后,3 组小鼠生精上皮厚度比较,差异有统计学意义(F=781.50,P<0.001)。对照组小鼠生精上皮较厚,主要有完整生精细胞、精子细胞和精子;3 mg·kg-1×10 d 组小鼠生精上皮较薄,存在各级完整的生精细胞;4 mg·kg-1×10 d 组小鼠生精上皮处于完全损伤状态,生精上皮厚度低于对照组和3 mg·kg-1×10 d 组(P均<0.05),见表3。
表3 小鼠生精上皮厚度比较( ±s,μm)

表3 小鼠生精上皮厚度比较( ±s,μm)
与对照组比较*P<0.05;与3 mg·kg-1×10 d 组比较#P<0.05。
组别 n 生精上皮厚度对照组 6 66.27±2.66 3 mg·kg-1×10 d 组 7 41.96±2.34*4 mg·kg-1×10 d 组 7 13.79±2.21*#F 值 781.50 P 值 <0.001
2.7 小鼠血清激素水平比较
4 mg·kg-1×10 d 组小鼠血清FSH 水平高于对照组(P<0.05);4 mg·kg-1×10 d 组小鼠血清LH水平高于对照组和3 mg·kg-1×10 d 组(P均<0.05),4 mg·kg-1×10 d 组和3 mg·kg-1×10 d 组血清睾酮水平均低于对照组(P均<0.05)。说明在激素水平上此模型构建成功,见图4。
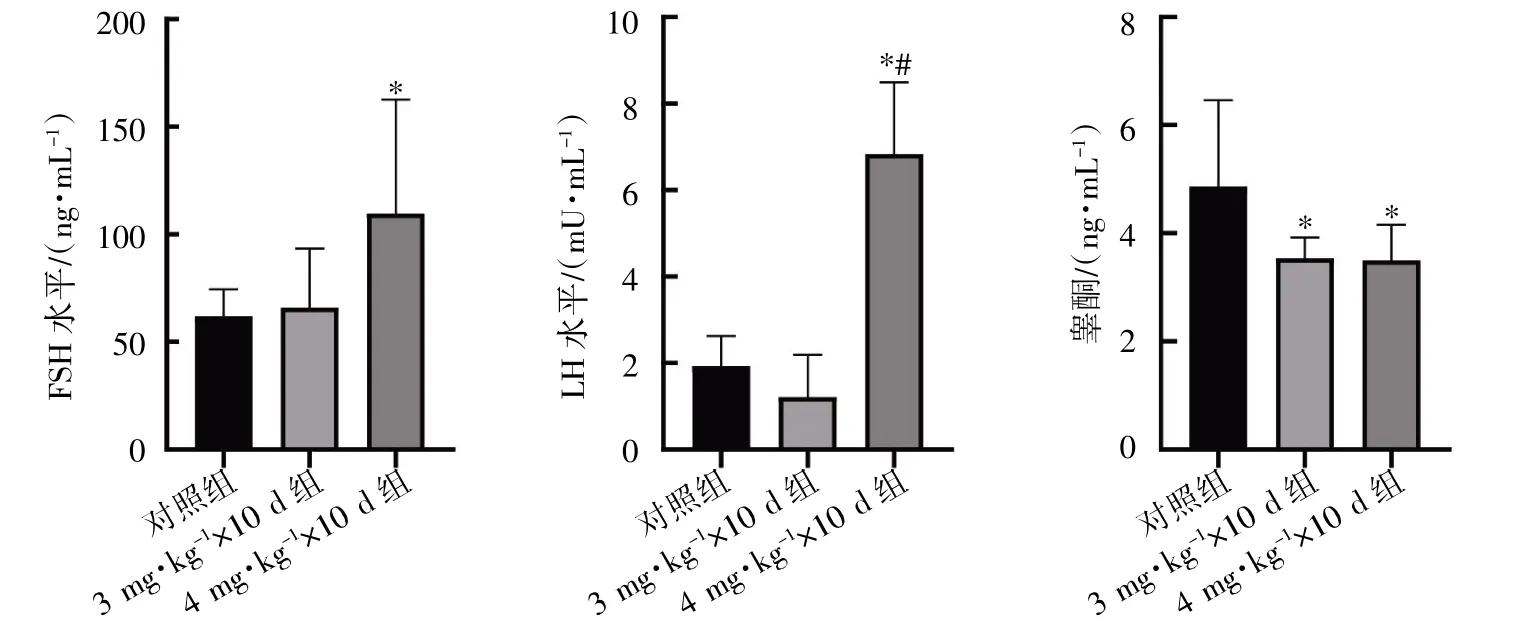
图4 小鼠血清激素水平比较
2.8 小鼠睾丸HE 染色结果
对照组小鼠生精功能正常,睾丸生精小管间隙正常,管腔内生精细胞排列紧密、层次分明,从基底膜向管腔内依次为精原细胞、初级精母细胞、次级精母细胞、精子细胞、精子,管腔内可见大量成熟精子。3 mg·kg-1×10 d 组小鼠生精功能障碍,睾丸生精小管间隙较大,管腔内可见精原细胞、精母细胞,精子细胞较少,管腔内精子极少。4 mg·kg-1×10 d 组小鼠生精功能严重障碍,生精小管散在分布于间质中,生精小管上皮内细胞层数较少,各级生精细胞数量较少,管腔空洞,无成熟精子,见图5。
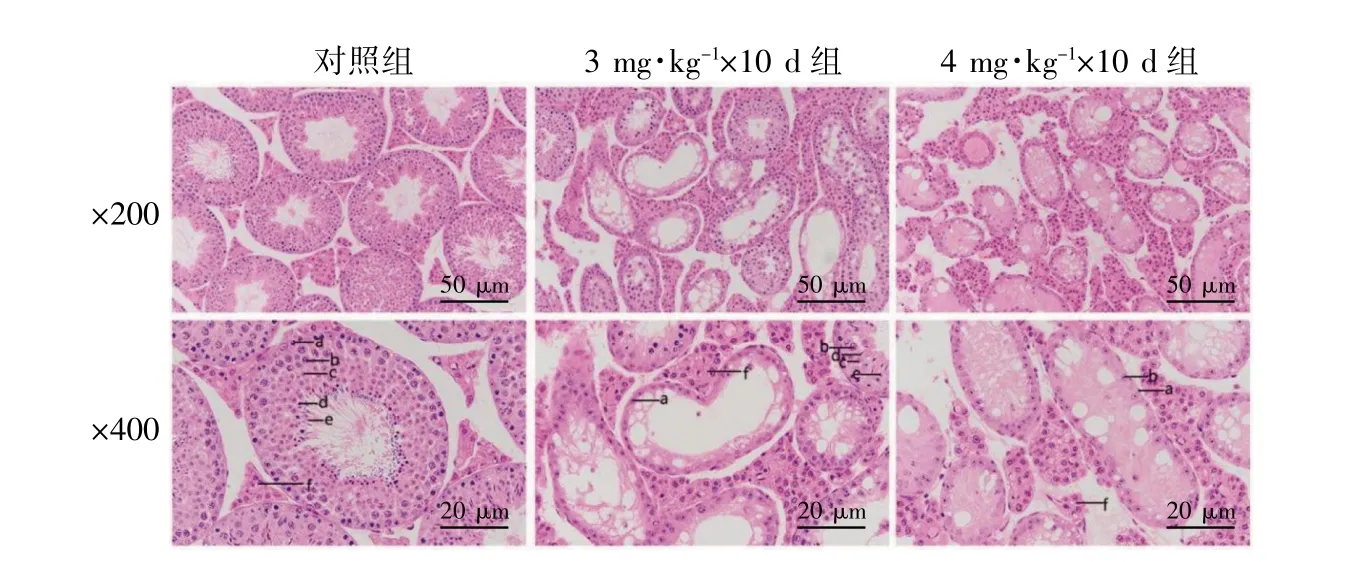
图5 小鼠睾丸HE 染色结果
3 讨论
雄性高促性腺激素性性腺功能减退状态,一方面是由于睾丸功能异常,FSHR、LHR 的消耗下降,使得FSH、LH 水平升高,另一方面是缺乏来自睾丸的雌二醇、睾酮、抑制素B 的负反馈,促性腺激素分泌升高,主要由睾丸先天发育不良或后天损伤所致[1]。Foresta 等[17]在使用促性腺激素释放素激素类似物(GnRHa)降低高FSH 血浆浓度后,睾丸内严重损伤的支持细胞功能有所改善。在高促性腺激素条件下,后续给予人绒毛膜促性腺激素可以刺激间质细胞,也能恢复其功能[18-19]。由此可见,雄性高促性腺激素性性腺功能减退状态是可逆的,因此,模型构建所选用的造模剂或造模方法不可对睾丸造成永久性损害。
白消安为细胞周期非特异性药物,主要与细胞DNA 内的鸟嘌呤起烷化作用而破坏DNA 的结构与功能[20-21]。白消安能有效减轻粒细胞总负荷,缓解症状,从而改善患者状态[22-23]。白消安腹腔注射会引起睾丸炎性因子肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)等增加[24],小剂量持续刺激会导致长时间的炎性反应,可能对睾丸的生精功能、支持细胞、间质细胞等造成损伤,进而导致性腺功能减退、促性腺激素水平升高。褪黑素和维生素通过抗氧化作用能够有效降低白消安作用后产生的活性氧分子,改善受损的生精功能[25-26]。白消安在损伤生精细胞的同时也会导致骨髓抑制[27],使患者出现营养不良、体质量下降、乏力、反应迟钝等症状[10]。但是采用本研究预实验探索出的小剂量持续刺激法注射白消安后,小鼠并无上述表现,各组小鼠体质量比较,差异均无统计学意义,证明此造模方法不会影响小鼠的正常发育,同时实验组小鼠睾丸系数下降,说明此雄性高促性腺激素性性腺功能减退症小鼠模型不是通过全身消耗作用而来,而是白消安作用于睾丸周围所得,符合临床高促性腺激素性性腺功能减退症的病因,证明了此造模方法的有效性。
临床上无精子症患者通常依靠睾丸活检确诊,病理结果通常使用国际通用的Johnson 评分判断,评分从高到低代表着生精功能从好到差[14]。睾丸Johnson 评分是根据生精小管中精子的发生及精子发生障碍程度做出定量判断的评分表。共分为10 级,积分越高,表明精子发生越好,反之,精子发生障碍越严重。本研究结果表明,给药剂量越大,小鼠精子发生障碍越严重。白消安作用于睾丸后,不仅使睾丸体积减小,也使精子数量降低、精子活力受损;睾丸健康状况、大小、曲细精管直径和生精上皮厚度与精子发生过程中精子的数量和活力密切相关[28]。通过睾丸病理切片HE 染色后使用Case-Viewer 软件测量发现,随着给药剂量的增加,睾丸质量降低,体积减小,曲细精管变细,生精上皮厚度变薄,管腔增大,生精能力减弱。
睾丸在受到白消安的刺激后发生损伤,睾酮水平降低,通过下丘脑-垂体-睾丸轴的负反馈作用,导致血清FSH 和LH 水平升高。在高促性腺激素状态加速睾丸早衰的理论中,一种认为是受体脱敏,当受体长时间暴露于配体时,大多数受体会失去反应性,即产生脱敏现象。另一种是受体下调,当体内配体持续升高时,配体-受体复合物可被细胞内化,内化后配体及部分受体被降解,部分受体返回细胞膜重新利用,可导致受体数量减少,称为受体下调。支持细胞长期暴露于FSH 可诱导FSH 信号的脱敏和下调,从而防止这些性腺细胞的过度刺激[29]。因此白消安可能会直接作用于FSH 和LH 受体,使其受损,进而导致促性腺激素水平升高,此机制有待进一步研究。睾丸HE 染色可见小鼠睾丸损伤严重,但全身未受较大影响,表明白消安小剂量持续刺激是一种较为可靠的性腺功能减退造模方法。
因此,建立雄性小鼠睾丸功能低下、高促性腺激素水平模型,对于探索其发病机制,揭示相关细胞因子表达、信号通路、治疗靶点等仍具有重要作用。进一步研究高促性腺激素状态下睾丸早衰的分子机制可为临床治疗提供理论依据,也为睾丸功能低下的少精子症和无精子症患者的临床治疗方案的设计,及早期识别睾丸早衰、防止生精功能衰竭和预防男性不育提供重要的理论证据。
