金黄色葡萄球菌对万古霉素的耐药性及耐药基因检测分析
2023-06-20李伦张丽娜王兵刘彩林
李伦,张丽娜,王兵,刘彩林
金黄色葡萄球菌(SA)是临床常见的致病菌,随着1961 年英国首次发现耐甲氧西林金黄色葡萄球菌(MRSA)至今,MRSA 检出率急剧上升,已成为临床抗感染治疗的一大难题[1]。万古霉素是治疗MRSA 感染最常用的药物和最后防线[2],然而随着MRSA 感染率上升和万古霉素的大量广泛使用,万古霉素敏感性降低的MRSA及万古霉素治疗失败不断被报道[3]。尽管按照美国临床实验室标准化研究协会的判读折点,MRSA 对万古霉素仍处于敏感范围,但国内外均有大量研究报道万古霉素异质性耐药金黄色葡萄球菌(hVISA)和万古霉素中介耐药金黄色葡萄球菌(VISA),且近年来其检出率呈上升趋势,需引起临床高度重视[4-5]。目前关于SA 对万古霉素的具体耐药机制尚不清楚,有研究发现菌种会通过基因调控方式来获得适应力[6],也有研究发现hVISA 和VISA 细胞壁相关代谢基因表达存在改变[7]。故本研究针对临床送检标本分离的SA 进行万古霉素耐药性检测及基因检测分析,以期为临床合理治疗控制感染提供参考依据,详情如下。
1 材料与方法
1.1 菌株来源选取平顶山市第一人民医院2020年4月至2022年3月临床送检样本1 592例,分离出288株SA菌株(均为首次分离),检出率18.09%。SA样本来源:脓液173 份(60.07%)、血液34 份(11.80%)、胸腹水32 份(11.11%)、引流液26 份(9.03%)、痰液23份(7.99%),去除重复菌株。
1.2 抗菌药物及培养基万古霉素抗菌药物、Etest 实验条、血平板均购自郑州安图生物工程股份有限公司,脑心浸液琼脂基础和MH 琼脂基础由英国Oxoid 公司提供,脱纤维羊血购自郑州农达生物制品有限公司。
1.3 SA 鉴定及抗菌药物敏感性检测试验SA 菌株经MH 琼脂培养后挑选单个菌落,经革兰染色和触酶试验证实后用传统划线法接种于琼脂培养基上进行分离纯化,用法国生物梅里埃公司Vitek 2 Compact 全自动细菌鉴定和药敏仪器及纸片扩散法进行菌株鉴定与药物敏感性试验,SA 质控菌株为ATCC29213 和ATCC25923。采用E-test 法检测万古霉素最小抑菌浓度(MIC),按照美国临床实验室标准化委员会(2021 年CLSI M100-S31)推荐的方法进行操作,按CLSI规定的临界值对药物敏感性试验结果进行判读。
1.4 hVISA 的检测方法用0.85%氯化钠溶液将SA 菌株制备成浊度为0.5 麦氏的菌悬液,经胰蛋白胨大豆肉汤过夜培养后用无菌L棒将原液、1×10-3稀释悬液、1×10-6稀释悬液涂于万古霉素浓度为0.5 mg/L、1.0 mg/L、2.0 mg/L、2.5 mg/L、4.0 mg/L、8.0 mg/L 的脑心浸液琼脂平板上,35 ℃培养48 h,选取生长最好菌落的平板进行计数,并计算实际菌落数,实际菌落数=菌落计数×相应稀释倍数。将Mu3 作为阳性对照,采用Graphpad Prism8.0 软件绘制菌落数对数值对万古霉素浓度的曲线,并计算曲线下面积,并与Mu3 比较,结果判读:比值<0.9 判定为万古霉素敏感金黄色葡萄球菌(VSSA),比值≥0.9 且<1.3判定为hVISA,比值≥1.3判读为VISA[8]。
1.5 基因检测将SA 菌株接种在血平板上,采用德国QIAGEN 公司生产的Puregene Yeast/Bact 试剂盒提取RNA,采用QuantiTect Reverse Transcriptase试剂盒进行逆转录合成cDNA,严格按照试剂盒说明书进行操作;采用实时定量聚合酶链反应检测pbp4、mgrA、agr、vraS、vraR、icaA、icaR 基因的表达,以16S RNA 作为内参,以2-ΔΔCt表示目的基因相对表达量,其中引物序列见表1。

表1 PCR引物序列
1.6 统计学方法采用SPSS 23.0 统计学工具处理数据,计量资料行正态性检验和方差齐性检验,均符合正态分布且方差齐,以±s形式描述,不同菌株耐药基因相对表达量比较采用独立样本t检验;计数资料以频数、百分比形式描述,P<0.05 为差异有统计学意义。
2 结果
2.1 MRSA 检测结果及其对常用抗菌药物敏感性检测结果288 株SA 筛选出MRSA 菌株116 株(40.28%),甲氧西林敏感金黄色葡萄球菌(MSSA)菌株172 株(59.72%)。MRSA 菌株和MSSA 菌株对利奈唑胺、替加环素、万古霉素均敏感,见表2。

表2 MRSA和MSSA对常用抗菌药物敏感性检测结果/例(%)
2.2 hVISA 检测结果288 株SA 共筛选出25 株hVISA菌株,hVISA阳性率为8.68%,其余263株SA均对万古霉素敏感,未检测到VISA菌株和万古霉素耐药金黄色葡萄球菌(VRSA)菌株。E-test法检测万古霉素MIC,结果显示VSSA菌株万古霉素MIC主要分布在0.50 mg/L 和0.75 mg/L,占比为41.83% 和28.90%;hVISA 菌株万古霉素MIC 主要分布在1.50 mg/L和2.00 mg/L,占比为56.00%和28.00%,见表3。
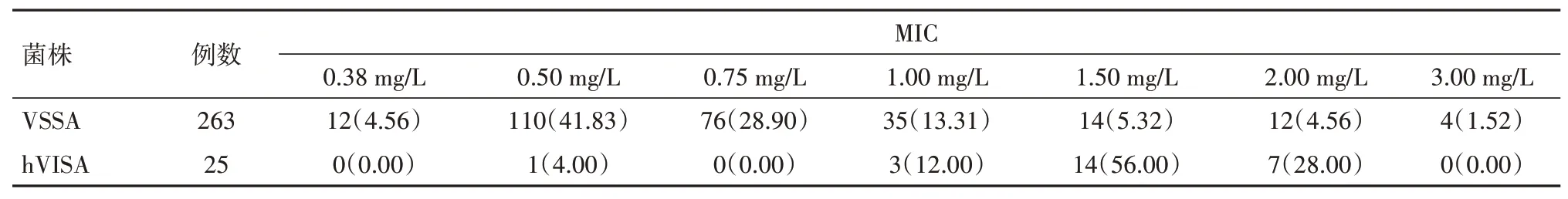
表3 VSSA菌株与hVISA菌株万古霉素MIC分布/例(%)
2.3 耐药基因检测结果VSSA菌株pbp4、agr、icaR基因相对表达量均明显高于hVISA(均P<0.05);VS‑SA 菌株mgrA、vraS、vraR、icaA 基因相对表达量均明显低于hVISA(均P<0.05),见表4。
表4 VSSA菌株与hVISA菌株耐药基因相对表达量/± s

表4 VSSA菌株与hVISA菌株耐药基因相对表达量/± s
注:VSSA 为万古霉素敏感金黄色葡萄球菌,hVISA 为万古霉素异质性耐药金黄色葡萄球菌。
?
3 讨论
自20 世纪80 年代起,万古霉素逐渐成为治疗MRSA 引起的重度感染的一线药物,成为治疗重症SA 感染的重要保障。但随着耐万古霉素的肠球菌的出现,有学者认为SA很有可能从耐万古霉素肠球菌中获得vanA 耐药基因进而对万古霉素产生耐药[9],虽然至今尚未在SA 中检测到vanA 耐药基因,但随着hVISA 和VISA 的出现,国内外陆续有关于万古霉素治疗SA的敏感性下降问题的相关报道出现。因此,检测分析SA 对万古霉素的耐药基因的意义重大。
本研究对近两年来临床送检样本分离的288株SA 菌株进行耐药性检测,其中MRSA 菌株占40.28%,由此可见SA 对甲氧西林抗菌药物的耐药情况较为严重,分析其原因:MRSA 具有广谱耐药性,临床检出率较高可能与治疗时不规范使用抗生素有关,且MRSA以定植或接触传播,消毒隔离不到位及免疫力低下、不注重手卫生病人均易引起MRSA 感染传播,需引起临床高度重视。hVISA 被认为是VISA 的前体,可能会进化为VISA,本研究通过药物敏感性检测发现:288 株SA 菌株检出25 株hVISA 菌株,hVISA 阳性率为8.68%,表明SA 对万古霉素存在一定的耐药趋向。另外,本研究发现VS‑SA 菌株万古霉素MIC 主要分布在0.50 mg/L 和0.75 mg/L,而hVISA 菌株万古霉素MIC 主要分布在1.50 mg/L 和2.00 mg/L,提示在万古霉素高MIC 可能是发生SA 耐万古霉素的征兆。近年来不断有研究发现MRSA 分离株中万古霉素MIC升高,均值从1.3 mg/L增加1.5 mg/L,并与治疗失败可能相关[10],故临床需高度重视。
目前,有学者认为SA对万古霉素的耐药性主要是由细菌的细胞壁增厚引起的[11]。既往研究在VI‑SA 菌株中发现,walk 等基因发生部分突变会导致细胞壁代谢相关基因发生改变,使细菌的细胞壁增厚,药物的敏感度被削弱[12]。刘明涛等[13]发现在大部分的hVISA 菌株中出现了walk 基因突变,且均为点突变,而walk 属于walkR 二元信号系统,该系统可调控细胞壁代谢的上游基因atlA、ssaA、isaA、lytM,使其表达下调,从而减缓细胞壁的代谢,使细胞壁的厚度明显增加,从而使细菌对万古霉素的敏感度削弱,耐药性上升。此外,SA 对万古霉素的耐药性增强还与ropB(编码DNA 依赖的RNA 聚合酶亚单位)、graSR(编码双组分调节系统)等多处基因位点突变相关[5,14-15]。本研究据此通过筛选可能参与SA 发生万古霉素耐药的基因,并对比其在VSSA菌株和hVISA 菌株中的表达差异,发现VSSA 菌株pbp4、agr、icaR 的相对表达量均明显高于hVISA 菌株,而mgrA、vraS、vraR、icaA 的相对表达量均明显低于hVISA 菌株,提示上述基因可能介导hVISA 的转化,并可能参与SA 耐万古霉素的机制。pbp4 具有羧肽酶活性,参与了SA 细胞壁肽聚糖的二级交联,pbp4 水平下降使肽聚糖交联减少,致使万古霉素易被D-丙胺酰-D-丙氨酸侧链结合而被阻于细胞膜外,难以发挥抗菌活性,因而表现出对万古霉素耐药性[16]。agr 是存在于SA 的数量感应基因簇,其水平下调可促进菌体表面膜蛋白的表达,促进生物膜形成,有利于提升耐药性。Chen 等[17]研究发现VSSA 向hVISA 转换过程中,菌株会出现agr 基因C位点丢失,agr 水平下调,且既往也有研究报道hVI‑SA 菌株中agr 功能缺失株的比例显著高于VS‑SA[18],本研究与上述结果一致,均证实了hVISA 菌株中agr 的低表达,可能与万古霉素耐药有关。icaR 与生物膜的形成相关,且其水平与生物膜形成呈负相关[19],在hVISA 中低表达利于SA 菌的细胞壁的形成,导致耐药性强。刘彩林等[18]发现mgrA是一个与生物膜的形成呈正相关多效调节器,可激动8 型荚膜多糖,抑制蛋白a-毒素、凝固酶和蛋白酶等的活性,在hVISA菌株中的表达水平明显升高,本研究与其结果均证实高表达的mgrA 对hVISA 菌株的耐药性发挥促进作用。vraS 与vraR 共同组成vraSR磷酸转移酶介导的信号调节系统,其可感应各种因素引起的细胞壁破坏,并快速应答,正向调节细胞壁的生物合成,增加细胞壁厚度保证细胞壁完整,两者的表达水平上调均与hVISA菌株的细胞壁增厚密切相关[20]。icaA 是ica 操纵子第1 个基因,具有编码N-乙酰葡糖胺转移酶,促生物膜生成的作用,icaA 高表达会导致细胞壁厚度增加[21],故猜测hVI‑SA菌株中icaA表达量高会增厚菌株细胞壁,导致其对万古霉素的耐药性增强。
综上所述,SA中hVISA阳性率为8.68%,SA对万古霉素已存在异质性中介耐药性,pbp4、agr、icaR 低表达与mgrA、vraS、vraR、icaA高表达均可能与hVISA株流行和万古霉素耐药性增强有关。本研究探讨了SA 对万古霉素的耐药性及可能参与耐药的基因作用,为进一步深入探讨SA对万古霉素耐药的机制提供了重要的参考依据,具有重要的临床意义。
