柴胡疏肝散对糖尿病周围神经病变大鼠瞬时受体电位香草酸亚型1/降钙素基因相关肽通路及坐骨神经电生理变化的影响
2023-06-20王阳阳黄霄云冯茂胜
王阳阳,黄霄云,冯茂胜
糖尿病(diabetes mellitus,DM)是一组代谢性疾病,与胰岛素分泌受损或细胞对该激素作用的抵抗有关[1]。糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是DM 最复杂的病理改变之一,据估计,大约一半的DM病人存在这种情况[2-3]。因此,探究DPN 的致病机理及影响因素,对于预防严重的DPN 并发症至关重要[4]。柴胡疏肝散近年来被广泛用于治疗多种病症,可疏肝理气、活血止痛,如2 型糖尿病(type 2 diabetes,T2DM)合并高脂血症等[5]。瞬时受体电位香草酸亚型1(transient receptor poten‑tial vanlloid 1,TRPV1)可在多种物理、化学因素刺激下参与痛觉整合、抗炎、调节胃肠等生理和病理过程[6]。降钙素基因相关肽(calcitonin gene-related peptide,CGRP)是由感觉神经元释放的一种肽类物质,可将感觉信息传递给中枢系统以调节神经活动[7]。研究证实,过表达CGRP 能够促进神经血管扩张,增加血流,改善DPN[8]。同时,TRPV1 激活后可促进CGRP 等神经递质的释放,具有扩张血管和利尿的作用[9]。因此本研究通过建立DPN 大鼠模型,检测应用柴胡疏肝散治疗DPN 大鼠后对TRPV1/CGRP 通路的影响,以期发现柴胡疏肝散在DPN中的作用途径。
1 材料与方法
1.1 材料
1.1.1动物 2019年12月至2020年9月,从北京生命科学研究所动物实验中心[合格证号为SYXK(京)2015-0002]购入40只SPF级SD雄性大鼠,体质量范围为150~180g,饲养在适宜的温度和湿度下。本研究符合一般动物实验伦理学原则。
1.1.2药品 柴胡疏肝散:柴胡、陈皮各6 g,白芍、枳壳、川芎、香附各4.5 g,炙甘草1.5 g,由广州致信药业有限公司提供,药材经冷水浸泡2 h,常规两煎,混合煎液并过滤,经水浴蒸发浓缩成含生药1.26 g/mL 的浓缩药,高压灭菌后冷藏备用。弥可保(江苏卫材药业有限公司,批号20190318);链脲佐菌素(strep‑tozotocin,STZ;美国Sigma 公司,批号20190607);兔抗鼠TRPV1、CGRP、肿瘤坏死因子-α(tumor necro‑sis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)一抗(英国Abcam 公司,货号ab120099、ab272713、ab215188、ab197447);HE 染色试剂盒(德国默克公司,批号G1120);二喹啉甲酸(bicinchonin‑ic acid,BCA)试剂盒(美国赛默飞公司,货号A53225);考马斯亮蓝试剂盒(上海康朗生物科技有限公司,货号KL-D3297)。
1.1.3实验设备 GIS-500 凝胶成像仪(上海艾研生物科技有限公司,货号1708195);肌电图仪(丹麦丹迪医疗公司,型号Keypoint-4);血糖仪(拜耳医药保健有限公司,型号拜安捷2);CX43 光学显微镜(济南欧莱博电子商务有限公司,货号CX43)。
1.2 方法
1.2.1模型建立 随机选取5 只大鼠为对照组(给予普通饲料喂养),其余大鼠用于造模。造模大鼠采用高脂饲喂4 周,以诱发胰岛素抵抗。随后大鼠禁食14 h,再给予小剂量STZ(25 mg/kg,溶于0.1 mol/L、pH 4.5 的柠檬酸-柠檬酸钠缓冲液,将STZ 配置为1%的溶液,经0.22 µm 的微孔滤膜过滤除菌)。对照组给予等量的柠檬酸-柠檬酸钠缓冲液。3 d后从尾静脉采血,用血糖仪测定空腹血糖(fasting blood sugar,FBG),FBG≥13.8 mmol/L,确定为DM 大鼠,用于实验。DM 大鼠再继续高糖高脂饲喂8 周,使用肌电图仪对大鼠下肢坐骨神经的感觉和运动传导速度进行检测,若大鼠感觉或运动传导速度减慢超过11%,则表示成功建立DPN 模型[10]。在实验过程中有5 只大鼠死亡或造模失败,成功建立DPN模型30只。
1.2.2分组与给药 将DPN 模型大鼠随机分为模型组(n=5)、弥可保组(n=5)、低中高剂量柴胡疏肝散组(每组n=5)。参考文献[11]弥可保组按1 次/天,175 µg/kg 剂量灌胃给药,参考文献[12]柴胡疏肝散低中高剂量分别按照1 次/天,3.15 g/kg、6.30 g/kg、12.60 g/kg灌胃给药,连续给药8周。
1.2.3各组大鼠摆尾温度阈值检测 给药8周后,将大鼠放置于宽松的笼内,露出尾部,用恒温加热仪(每分钟加热2 ℃),加热水温,水温从20 ℃开始将鼠尾浸入水中约2 cm,鼠尾因水温过高而摆动并露出水面时记录水温,此时水温即为摆尾温度阈值。
1.2.4各组大鼠运动神经传导速度(MNCV)的测定 第8周末采用1%戊巴比妥钠0.4 mL/100 g腹腔内注射麻醉,使用肌电图仪检测大鼠下肢MNCV,观察MNCV 及其支配肌复合运动动作电位的波幅(AMP)、潜伏期(LAT)的变化。在腘窝下1~2 cm 处经皮插入2 个针电极(电极间距1 cm)用方波(10~15 mA,0.1 ms 脉波宽,频率1 Hz)刺激神经,在距刺激电极2~3 cm 处的同侧胫前肌记录肌肉动作电位。两个刺激部位间的距离用弯脚规测量,运动神经在两个刺激部位间的传导时间为潜伏期差,计算MNCV(距离/潜伏期差值),记录AMP、LAT变幅。
1.2.5qRT-PCR 法检测大鼠血清TRPV1、CGRP、TNF-α、IL-1β mRNA 水平 采用腹主动脉取血,离心分离血清,-80 ℃保存备用。Trizol 法提取总RNA,将RNA 逆转录合成cDNA 行qRT-PCR 扩增。反应体系(20 µL):10 µL 2×SYBR Mix,1 µL cDNA模板,0.5 µL正向引物和0.5 µL反向引物,8 µL双蒸水。反应条件:95 ℃、5 min,95 ℃、10 s,60 ℃、30 s,72 ℃、2 min 的40 个循环,72 ℃、10 min。2-∆∆Ct方法对mRNA 表达水平进行定量,并标准化为甘油醛-3-磷酸脱氢酶(GAPDH)。见表1。

表1 qRT-PCR引物序列
1.2.6HE 染色观察大鼠坐骨神经病理学变化 解剖后取坐骨神经组织于4%多聚甲醛中固定,制备石蜡切片,切片经脱蜡、水化后,用苏木素染色10min,滴加伊红染液复染5 min 后,梯度乙醇脱水、二甲苯透明,中性树脂封片,光学显微镜下观察坐骨神经组织病理变化。另切除约50 mg 大鼠坐骨神经组织,用于蛋白质印迹法检测。
1.2.7蛋白质印迹法检测大鼠坐骨神经中TRPV1、CGRP、TNF-α、IL-1β 蛋白表达水平 取坐骨神经组织,加入蛋白裂解液提取总蛋白。10%聚丙烯酰胺凝胶电泳分离等量蛋白质样品,并转移至PVDF膜。5%脱脂奶将膜封闭2 h 后,与一抗TRPV1(1∶1 000)、CGRP(1∶1 000)、TNF-α(1∶5 000)、IL-1β(1∶2 500)单克隆抗体,4 ℃孵育过夜,TBST 清洗5 min×3次。加入二抗(1∶15 000)在室温下反应2 h,ECL 显色,凝胶成像仪观察蛋白条带。Image J软件分析条带灰度值,并以β-actin 为内参计算目的蛋白的相对表达量。
1.3 统计学方法SPSS 22.0软件进行统计分析,计量资料均符合正态分布表示为±s,单因素方差分析和SNK-q检验用于三组及以上的组间比较。P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠一般状态对照组大鼠精力充沛,活动灵活,饮食正常;模型组大鼠活动减少,毛发枯黄无光泽,呈多饮、多食、多尿症状;弥可保组大鼠饮食及排泄均正常,活动较多,与对照组相似;柴胡疏肝散组大鼠较模型组“三多”症状减轻,饮食逐渐恢复,剂量越高状态越好。
2.2 各组大鼠摆尾温度阈值及MNCV 的比较与对照组相比,模型组大鼠摆尾温度阈值、LAT 升高,MNCV、AMP 降低(P<0.05);与模型组相比,弥可保组、低中高剂量柴胡疏肝散组大鼠摆尾温度阈值、LAT 降低,MNCV、AMP 升高(P<0.05)。与弥可保组相比,低、中剂量柴胡疏肝散组大鼠摆尾温度阈值、LAT升高,MNCV、AMP降低(P<0.05)。见表2。
表2 各组大鼠摆尾温度阈值、MNCV、AMP、LAT的比较/± s

表2 各组大鼠摆尾温度阈值、MNCV、AMP、LAT的比较/± s
注:MNCV为运动神经传导速度,AMP为肌复合运动动作电位的波幅,LAT为潜伏期。①与对照组比,P<0.05。②与模型组比,P<0.05。③与弥可保组比,P<0.05。④与低剂量柴胡疏肝散组比,P<0.05。⑤与中剂量柴胡疏肝散组比,P<0.05。
?
2.3 各组大鼠坐骨神经病理变化正常组大鼠坐骨神经纤维及髓鞘排列紧密,厚度均匀,形态结构完整。模型组大鼠神经细胞周围观察到大量浸润性巨噬细胞和单核细胞,并伴有广泛的轴突脱髓鞘。弥可保组大鼠神经内膜和髓鞘的广泛轴突肿胀和水肿较少,中性粒细胞浸润较少,并且没有可观察到的脱髓鞘。低剂量柴胡疏肝散组髓鞘肿胀,巨噬细胞周围有单核细胞浸润以及程度较轻的脱髓鞘。中剂量柴胡疏肝散组神经外膜周围轻度水肿,血管周围浸润性中性粒细胞减少以及神经纤维仅轻微肿胀。高剂量柴胡疏肝散组神经纤维形态恢复正常,但周围伴有少量中性粒细胞浸润。见图1。
2.4 各组大鼠坐骨神经组织中TRPV1、CGRP、TNF-α、IL-1βmRNA 水平的检测与对照组相比,模型组TRPV1、CGRP、TNF-α、IL-1β mRNA 水平均升高(P<0.05)。与模型组相比,弥可保组及低中高剂量柴胡疏肝散组TRPV1、CGRP、TNF-α、IL-1β mRNA 水平均降低(P<0.05)。与弥可保组相比,低、中剂量柴胡疏肝散组TRPV1、CGRP、TNF-α、IL-1β mRNA水平均升高(P<0.05)。见表3。
表3 各组大鼠坐骨神经组织中TRPV1、CGRP、TNF-α、IL-1β mRNA水平的检测/± s
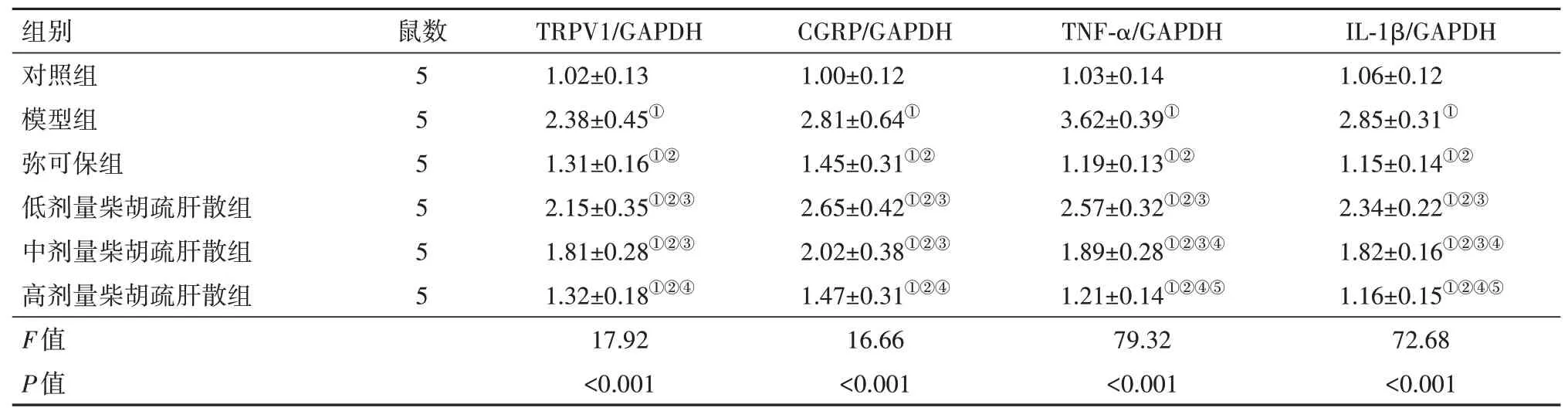
表3 各组大鼠坐骨神经组织中TRPV1、CGRP、TNF-α、IL-1β mRNA水平的检测/± s
注:TRPV1为瞬时受体电位香草酸亚型1,CGRP为降钙素基因相关肽,TNF-α为肿瘤坏死因子-α,IL-1β为白细胞介素-1β,GAPDH 为甘油醛-3-磷酸脱氢酶。①与对照组比,P<0.05。②与模型组比,P<0.05。③与弥可保组比,P<0.05。④与低剂量柴胡疏肝散组比,P<0.05。⑤与中剂量柴胡疏肝散组比,P<0.05。
?
2.5 各组大鼠坐骨神经组织TRPV1、CGRP、TNFα及IL-1β蛋白表达水平与对照组相比,模型组TRPV1、CGRP、TNF-α 及IL-1β 蛋白水平均升高(P<0.05)。与模型组相比,弥可保组及低中高剂量柴胡疏肝散组上述蛋白水平均降低(P<0.05)。与弥可保组相比,低、中剂量柴胡疏肝散组上述蛋白水平均升高(P<0.05)。见表4,图2。

图2 大鼠坐骨神经组织TRPV1、CGRP、TNF-α及IL-1β蛋白表达水平
表4 各组大鼠坐骨神经组织TRPV1、CGRP、TNF-α及IL-1β蛋白表达水平/± s

表4 各组大鼠坐骨神经组织TRPV1、CGRP、TNF-α及IL-1β蛋白表达水平/± s
注:TRPV1为瞬时受体电位香草酸亚型1,CGRP为降钙素基因相关肽,TNF-α为肿瘤坏死因子-α,IL-1β为白细胞介素-1β。①与对照组比,P<0.05。②与模型组比,P<0.05。③与弥可保组比,P<0.05。④与低剂量柴胡疏肝散组比,P<0.05。⑤与中剂量柴胡疏肝散组比,P<0.05。
?
3 讨论
DM已成为全球公共卫生危机,国际糖尿病联合会估计,2017 年全球DM 病人为4.51 亿(18~99岁)[13]。随着经济的快速发展和工业化进程的加快,生活方式的改变和人口老龄化,我国DM的患病率持续上升。据世界卫生组织统计,2005—2015年,中国因DM及相关心血管疾病造成的经济损失达5 577亿美元[14]。DPN是DM常见的慢性并发症,最常见的表现是伴有感觉丧失的远端退行性多发性神经病变,约20%~30%的病人可能会出现神经性疼痛,由于疼痛、感觉丧失、步态不稳、足部溃疡甚至截肢,很多DPN 病人生活质量严重下降[15]。此外,这些并发症的发生和发展会导致视力和神经功能丧失,活动和认知能力受损,生活质量下降,如果不进行控制或治疗,可能会造成不可逆的损害甚至死亡。
中医将DPN 归属于“消渴”继发的痹症、麻木、痛症、痿症等范畴,是病久失治、饮食不节、情志失调、劳欲过度所致,参照《糖尿病中医防治指南》中对DPN 的描述,可将很多DPN 病人归于肝肾亏虚型,这类病人伴有肢体麻木、疼痛,肌肉萎缩、腰膝酸软、头晕耳鸣等症状。柴胡疏肝散包含多种中药材,其中柴胡善疏泄肝气而解郁,具有抗炎和镇痛的作用。此外,香附有疏肝理气止痛的功效;陈皮性辛、苦,可理气健脾、燥湿化痰;川芎具有镇痛、抗血栓、扩血管等作用[16]。张鹏翔等[17]发现柴胡疏肝散能改善DPN 病人血液流变学,抑制氧化应激反应,清除氧自由基,提高感觉和运动神经传导速度,降低血糖。研究发现,STZ诱导的DM大鼠坐骨神经髓鞘损伤明显,MNCV 降低[18]。本研究发现,造模后大鼠活动减少,毛发枯黄无光泽,呈多饮、多食、多尿的“三多”症状;与对照组相比,低中高剂量柴胡疏肝散组大鼠摆尾温度阈值、LAT 升高,MNCV、AMP 降低。提示DM 大鼠造模成功,用药后大鼠对热敏度及运动神经功能均有所提高,且改善效果呈剂量依赖性。
神经肽是近年来发现的具有广泛生物活性的神经递质,其中CGRP 备受关注,CGRP 具有很强的生物活性,是中枢神经系统和外周神经系统的重要神经递质。CGRP 通过偶联G 蛋白将信号通过第二信使环磷酸腺苷传递到细胞中,是许多生理效应的关键,使其成为DM、疼痛、炎症和其他疾病或疾病相关症状的发展和进展的积极参与者,但目前对CGRP 在DPN 中的作用及其机制的研究却很少。CGRP 的释放依赖于神经元感觉神经末梢或膜上TRPV 的存在。TRPV1是TRPV 家族的重要成员,也是与神经源性炎症相关的重要伤害感受器[19]。另有研究发现,TRPV1 还可通过降低细胞内钙离子浓度,下调TNF-α、IL-1β水平,从而抑制小胶质细胞炎症反应[20]。研究显示,小胶质细胞的炎症反应导致坐骨神经损伤,而坐骨神经损伤则导致坐骨神经功能下降和电生理的改变,这也被视为慢性神经性疼痛的主要原因[21]。本研究发现,模型组大鼠较低中高剂量柴胡疏肝散组TRPV1、CGRP、TNF-α、IL-1β mRNA 及蛋白水平均降低。提示DPN 与TRPV1、CGRP 信号通路的异常表达及炎症水平有关,猜测在病理状态下,由于柴胡疏肝散抑制了TRPV1 表达,引起CGRP 及TNF-α、IL-1β 等炎性因子表达水平降低,从而减轻大鼠坐骨神经的炎症反应,最终改善DPN症状。
综上所述,柴胡疏肝散可能通过抑制TRPV1,降低CGRP 及TNF-α、IL-1β 等炎性因子表达水平,提高大鼠坐骨神经功能,达到改善DPN 的作用。但本研究也存在未检测神经细胞凋亡相关因子等试验,有待后续深入研究。
(本文图1见插图7-1)
