胡杨超氧化物歧化酶基因家族耐逆境的分子机理研究
2023-06-20鲁松松白丽霞姚耀源张晓玮
鲁松松 白丽霞 姚耀源 张晓玮
(甘肃农业大学林学院,甘肃 兰州 730070)
逆境胁迫条件下,植物体主要依赖抗氧化系统的协同调节来清除体内产生的过量活性氧(ROS)自由基,使细胞和组织免受氧化损伤[1-4]。植物体内含有广泛的酶和非酶的抗氧化系统,它们具有特殊的能力来避免ROS 的潜在负面影响,同时也能抑制其在多种情况下的信号转导作用[5]。目前,模式植物抗氧化系统的组成及其功能的研究已有大量报道,该系统的干扰或改变成为研究植物耐胁迫中ROS 信号通路的热点之一。
超氧化物歧化酶(SOD)作为生物体抗氧化系统的第一道防线,在维持细胞稳态和植物抗氧化反应中起着重要的作用。SOD 催化超氧自由基(O2-)生成氧气(O2)和H2O2。SOD 属金属酶家族,根据其活性部位金属类型的不同可将植物SOD 分为Cu, Zn-SOD(CSD)、Mn-SOD(MSD)、Fe-SOD(FSD)3 个亚家族[6]。植物体内超氧自由基主要来源于质膜NADPH 氧化酶,以及叶绿体、线粒体和过氧化物酶体中的氧化和电子传递反应[7-8]。亚细胞定位研究结果表明,SOD 主要在上述产生超氧自由基的细胞器中表达[9]。SOD 在产生超氧化物的细胞器中特异性表达和其被诱导表达的能力对植物抵抗非生物胁迫引起的氧化应激和细胞信号传导过程至关重要[10-11]。大量研究结果表明,非生物胁迫处理后植物耐逆性的升高均与SOD 活性的升高有关[10-11]。在NaCl胁迫条件下,与NaCl 敏感品种相比,豌豆(Pisum sativum)和番茄(Lycopersicon pennellii)NaCl 耐受品种的线粒体中MSD 活性均显著升高[12-13]。此外长时间NaCl 胁迫条件下,NaCl 耐受品种叶绿体中CSD 和FSD 活性显著升高[14]。分子实验结果表明,NaCl 胁迫条件下,NaCl 耐受品种线粒体MSD,叶绿体CSD和FSD等抗氧化酶基因表达均显著升高,而NaCl 敏感品种无显著改变。
胡 杨(Populus euphratica) 隶 属 于 柳 科(Salicaceae)杨属,主要分布于我国西北干旱盐碱的荒漠和戈壁地带,是这些地区森林生态系统中的主要高大乔木树种[15]。经过长期的自然选择,胡杨具有较其他杨属树种更高的抗逆能力(抗盐碱、抗高温和抗干旱等),是研究植物耐逆性分子机制极好的天然材料[16]。关于SOD 酶活性对盐胁迫的反应已有大量报道[6,17-22],但截至目前,研究内容大多仅涉及盐胁迫条件下SOD 酶活性的改变,随着测序技术的发展和应用,尤其是在基因组及其转录物组学尺度的应用为植物抗逆分子机理的研究提供了极大便利。本研究选择已有基因组测序数据的胡杨(P. euphratica)为对象,毛果杨(P. trichocarpa)、灰杨(P. pruinosa)、银白杨(P. alba)、小叶杨(P. simonii)、美洲黑杨(P. deltoides)和红皮柳(Salix purpurea)6 个杨柳科树种为对照物种,结合基因组、转录物组、蛋白质物理化学性质及同源建模等方法的比较分析,探索了胡杨SOD基因家族及蛋白质对盐胁迫条件响应的分子生物学特征,以期为植物耐逆境的研究提供参考依据。
1 材料与方法
1.1 SOD基因鉴定和DNA 序列获取
从NCBI、Phytozome 和GigaScience 等数据库下载胡杨(PopEup_1.0,NCBI)、毛果杨(Pop_tri_v3,NCBI)、灰杨(01.Ppr_genome,GigaScience)、银白杨(ASM523922v1,NCBI)、小叶杨(Populus_simonii_2.0,NCBI)、美洲黑杨(Pde_NFU_2_2,NCBI)和红皮柳(v1.0,Phytozome)全基因组组装和注解文件,并构建本地Blast 索引[23]。直接下载已注解基因组(胡杨、毛果杨、银白杨和红皮柳)中SOD基因DNA 序列及其预测的编码区序列(CDS)和蛋白质序列。利用NCBI 在线服务(Blastn 和Blastp)将CDS 和蛋白质序列分别比对到非冗余核酸(NT)和蛋白质库(NR)以评估注解文件中对SOD基因注解的准确性,Blast 参数evalue 设置为10-5。对于尚未注解基因组(小叶杨、美洲黑杨和灰杨),使用Blast 软件将上述准确注解的CDS 序列分别比对到基因组序列以确定各树种包含SOD基因的基因组片段,提取基因片段然后使用GENSCAN 在线服务(http://hollywood.mit.edu/GEN SCAN.html)进行基因预测(设置拟南芥基因为参数文件)和注解[24]。当比对文件中CDS 序列对齐的基因区域内出现提前终止密码子时,认定该基因为假基因。本研究还选用拟南芥(Arabidopsis thaliana)SOD基因作为进化分析的外类群。
1.2 转录物组数据获取和基因表达量分析
为了分析SOD基因在耐盐和非耐盐杨属树种组织中的表达及对盐胁迫响应的差别,本研究从NCBI 数据库中下载了胡杨(耐盐树种,根组织:SRR5984052、SRR5984065 和SRR5984066;叶组织:SRR5983971、SRR5983972 和SRR5983973;愈伤组织:0 h SRR952753、6 h SRR952754、12 h SRR952725、24 h SRR952700~SRR952709 和48 h SRR952726)和对照树种毛果杨(非耐盐树种,根组织:ERR1864412、ERR1864413 和ERR1864439;叶组织:ERR1864440、ERX1925298 和ERX1925 325;愈伤组织200 mmol/L NaCl 处理:0 h SRR 2029745、6 h SRR2029746、12 h SRR2029776、24 h SRR2029777 和48 h SRR2029778)转录物组测序原始数据。使用自编Perl 语言脚本对原始数据中测序质量值不高的Reads 进行剔除,条件如下:未知碱基(N)超过总读长5%;低质量碱基(<7)超过总读长65%。
过滤后的数据使用Tophat 软件(2.1.1 版本)比对到基因组序列,并用Samtools 软件(1.10 版本)对输出结果进行排序,参数默认设置[25-26]。使用Cufflinks 软件(2.2.1 版本)分别组装各样本的转录本后,用Cuffmerge 套件将各样品的转录本融合为单一转录组。最后使用Cuffdiff 套件计算每个基因的表达量并分析不同组织/处理组间基因表达量的差异[27]。基因表达量表示为每千个碱基的转录每百万映射读取的fragments(FPKM)。在根和叶组织的比较分析中,本研究使用FDR 方法矫正后的P值作为评估差异显著的依据,但由于愈伤组织盐胁迫处理样品没有生物学重复,因此本研究所使用软件是基于泊松分布简单模型给出的原始P值作为评估差异显著的依据,当P<0.05 且样本间FPKM 差异倍数大于2 时,认为差异显著。此外,FPKM <1 时,则认为是不表达基因。
1.3 SOD基因系统发生关系重建和结构分析
SOD基因的系统发生关系构建选用CDS 序列,序列对齐使用Mega 软件(7.0)完成[28],其中因CDS 区出现提前终止密码子导致的假基因,使用与其他树种CDS 序列对齐的基因区域。系统发生关系推断使用MrBayes 软件(3.2.7a)完成[29];基因结构绘制使用GSDS2.0 在线服务完成(http://gsds.cbi.pku.edu.cn/),其 中Output(Phylogenetic Tree/Order)选项中选择Tree 文件为上述贝叶斯法构建的基因树。
1.4 SOD 蛋白质物理化学性质和结构分析
蛋白质序列物理化学性质使用Expasy 在线服务(https://www.expasy.org)完成,主要包括分子质量(MW)、等电点(pI)、总平均亲水性(GRAVY)、氨 基酸 亲水性(Hphob. / Kyte &Doolittle)和 极 性(Polarity / Grantham)。MSD蛋白质序列结构预测使用ESPript3.0 在线服务完成(http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)。MSD 蛋白质同源建模使用Modeller 软件(9.24 版本)完成,模板选择拟南芥MSD1 的X 射线晶体衍射结构(Protein Data Bank 数据库:4C7U)。设置a. ending model = 100,对每个蛋白质构建100个同源模型,采用GA341 和DOPE 方法对同源模型进行评估并选择最优模型。蛋白质同源模型结构比较分析和可视化使用VMD 软件(1.9.4a43版本)完成[30]。
2 结果与分析
2.1 杨柳科树种SOD基因家族成员基因结构及系统发生关系
基因鉴定结果表明(表1),杨柳科树种SOD家族包含CSD、MSD和FSD3 个亚家族,但在不同谱系中各亚家族成员经历不同的基因复制、删除和假基因化事件。拟南芥基因组中包含9 个SOD基因,包括3 个CSD、4 个FSD和2 个MSD基因,分布于1~5 号染色体的不同区域。杨柳科7 个树种基因组中至少包含12 个SOD基因,其中胡杨、毛果杨、灰杨、银白杨和红皮柳基因组中均包含12 个SOD基因,小叶杨和美洲黑杨基因组中均包含15 个SOD基因。为了便于描述,本研究将3 个亚家族成员用阿拉伯数字和大写英文字母进行了依次编号。
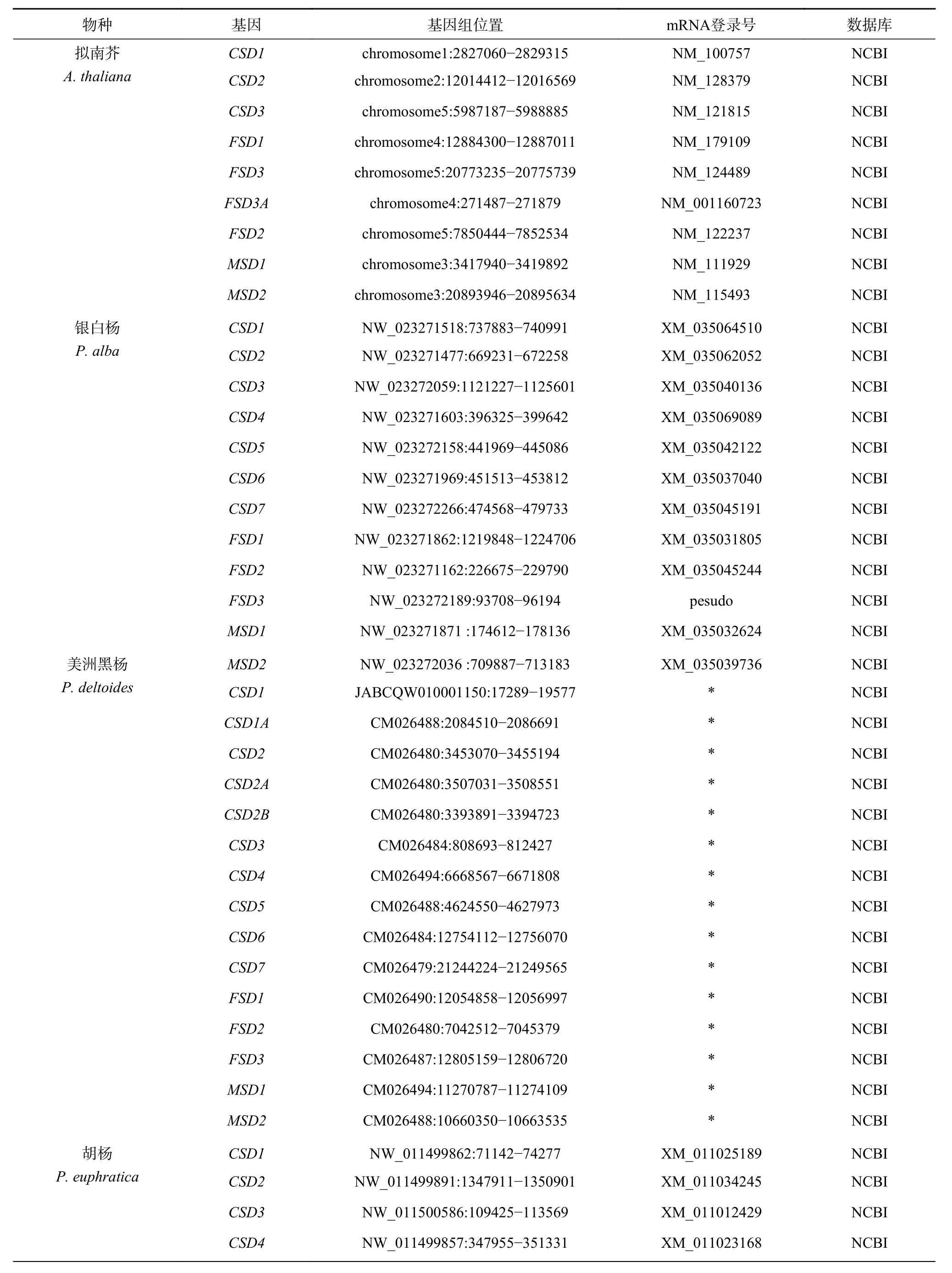
表 1 8 种植物的SOD 基因信息Table 1 Sources of SODgenes from 8 plant species
系统发生关系重建结果如图1 所示,CSD、FSD和MSD3 个亚家族成员分别聚为基因树的3 个主要分支,Bootstrap 支持率分别为1.00、0.84 和0.99。在CSD基因分支中,杨柳科树种CSD1/2、CSD3/6/7和CSD4/5基因分别与拟南芥CSD1、CSD2和CSD3基因聚为一支,表明在拟南芥和杨柳科树种共同祖先中至少存在3 种类型的原CSD基因。杨属树种CSD3/4/5/6/7分支中均只包含单拷贝基因分支,为1∶1 的直系同源基因。杨柳科树种CSD1和CSD22 个分支,在特定谱系中均出现较高频率的旁系同源分支,说明这2 个基因在杨柳科树种中较高频率地发生过谱系特异性基因复制事件。在FSD基因分支中,杨柳科树种FSD1/3和FSD2基因分别与拟南芥FSD1/3/3A和FSD2基 因 聚 为2 个 主 要 分 支(Bootstrap 值分别为0.92 和0.99),为1∶1 直系同源关系。杨柳科树种FSD1基因分支中,小叶杨双拷贝的FSD1基因(FSD1和FSD1A)聚为一支后,与其他科树种的单拷贝FSD1基因呈现出姊妹分支关系,说明小叶杨2 个旁系同源FSD1基因是一次近期基因复制事件的产物。杨属FSD3分支呈现出1∶1 直系同源关系,但红皮柳FSD3基因分支丢失,丢失可能源于一次谱系特异性基因删除事件,因为杨属树种FSD3基因分支起源早于红皮柳FSD1基因。基于基因组注解文件结果,杨柳科树种FSD3基因产生后在后代谱系中迅速被无功能化,甚至被彻底删除,这符合复制基因的假基因化进化命运假说[31]。在MSD基因分支中,杨柳科树种明显聚为MSD1和MSD2基因2 个分支,但Bootstrap 值都较低分别为0.47 和0.40。其中,杨柳科树种MSD1基因分支中各基因为1∶1 直系同源关系,该分支与拟南芥MSD1/2形成姊妹分支关系。在杨柳科树种MSD2基因分支中,除小叶杨MSD2基因出现双拷贝外,其他杨柳科树种的MSD2基因均为1∶1 直系同源关系。
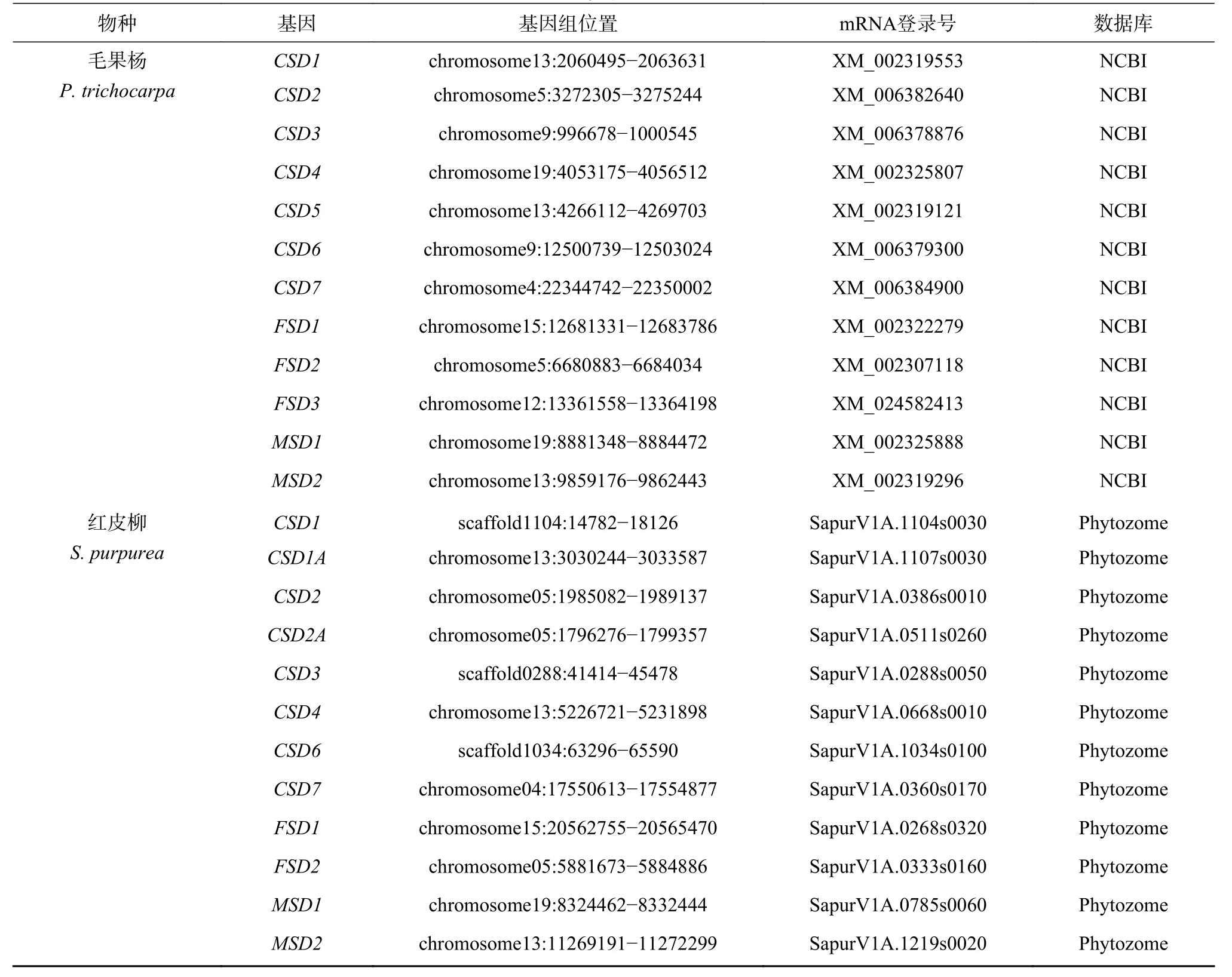
续表 1
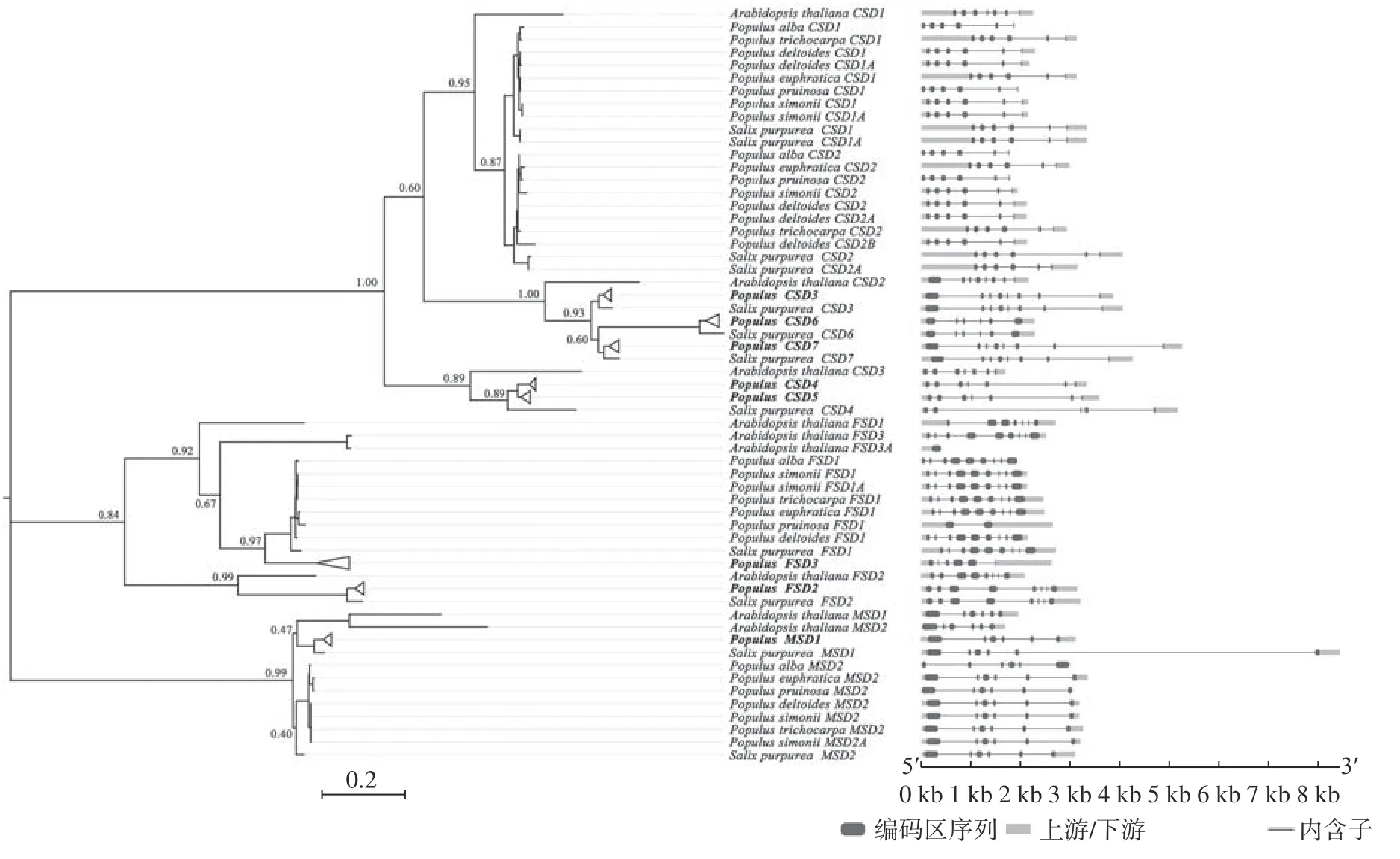
图 1 杨柳科植物SOD基因结构和系统发育关系Fig. 1 Gene structure and phylogenetic relationship reconstruction of SODgenes in Salicaceae trees
2.2 胡杨和毛果杨根和叶组织中SOD基因的表达量
从NCBI 数据库下载并分析胡杨和毛果杨(SOD家族基因个数均为12 个,且为1∶1 直系同源基因)根和叶组织的转录物组原始数据,以验证胡杨SOD基因的组织表达特征和推测的假基因化事件。表达量分析结果如表2 所示,SOD 家族各基因在胡杨和毛果杨根和叶组织中展现出不同的表达模式。在胡杨中,有7 个基因(CSD3、CSD4、CSD5、CSD6、CSD7、FSD1和FSD2)在根和叶组织中的表达差异显著(log2leaf/root > 1或 <-1 且P<0.05),且与根组织相比,叶组织中的表达水平均被显著下调。根和叶组织表达量处于前4 位的SOD 家族基因均为MSD2、MSD1、CSD7和CSD3(根组织中的FPKM 分别为178.94、105.67、29.87 和11.01;叶组织中的FPKM 分别为156.39、192.17、67.09 和51.33)。
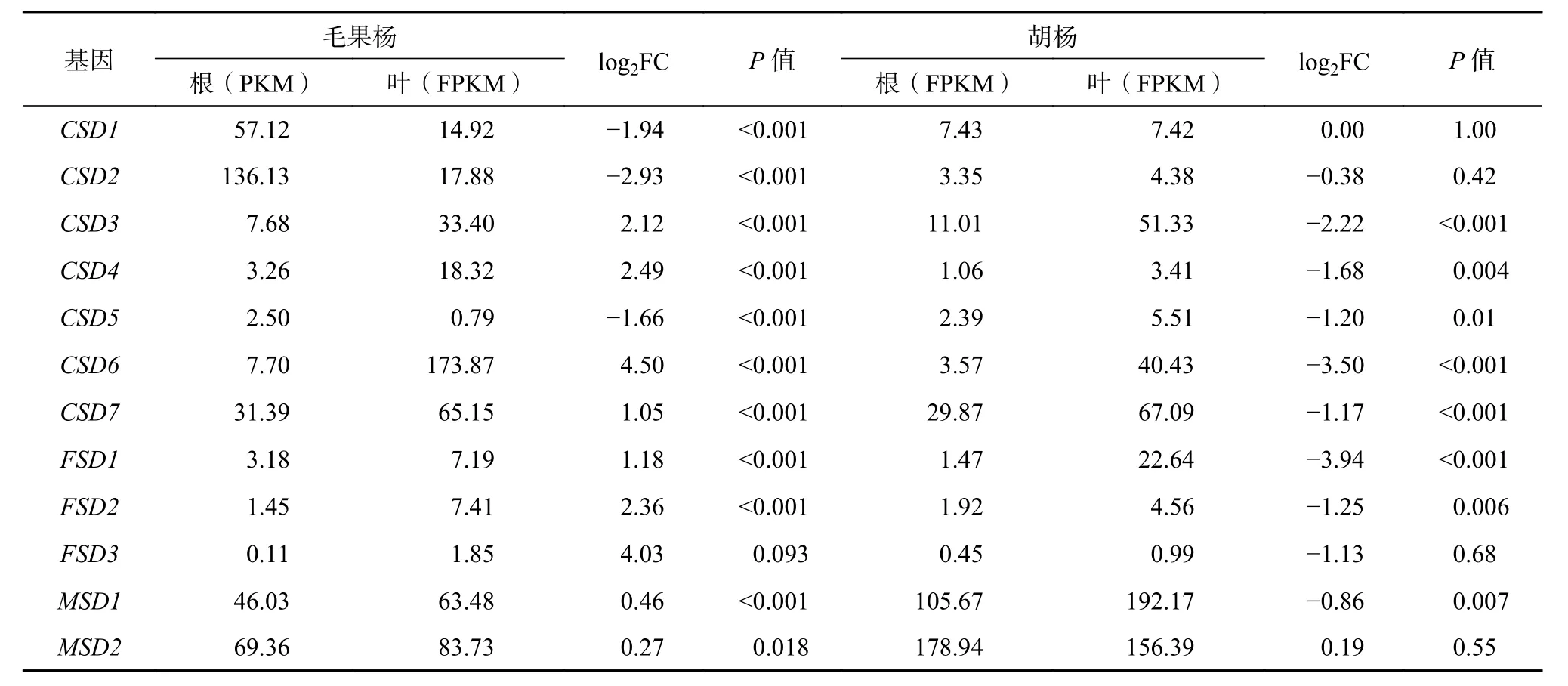
表 2 SOD基因家族在胡杨和毛果杨根、叶组织的表达量差异分析Table 2 Expression level of SODgenes in root and leaf tissues of P. trichocarpaand P. euphratica
2.3 胡杨和毛果杨愈伤组织中SOD基因对NaCl胁迫的响应
为探索NaCl 胁迫对耐逆和不耐逆境杨属树种SOD基因表达的影响,本研究使用实验条件一致(愈伤组织,NaCl(200 mmol/L)处理48 h,采样时间为0 、6 、12、24、48 h)的胡杨和毛果杨转录组基础数据进行了基因表达量分析,结果见图2。在0 h(对照组)时,与上述根和叶组织中的表达量分析结果相符,MSD1和MSD2基因仍是胡杨和毛果杨愈伤组织中SOD家族的高表达基因(图2c,毛果杨FPKM 分别为122.23 和77.28;图2f,胡杨FPKM 分别为178.35 和51.35),而CSD和FSD两个亚家族的主要表达基因与相应树种的根和叶组织相比明显不同,胡杨CSD1和CSD2基因、毛果杨CSD2和FSD1基因的表达量处于前4 位,FPKM 分别为130.11、85.56、24.37和17.91(图2a、d)。与根和叶组织相似,FSD亚家族基因在毛果杨和胡杨愈伤组织中的表达水平均相对较低(仅毛果杨FSD1基因的FPKM 超过10,图2b),该结果表明FSD亚家族在杨属树种抗氧化酶系统中的功能可能处于次要地位。另外,在胡杨和毛果杨的根和叶组织中FSD3甚至不表达(表2,FPKM 值极低,范围为0.11~1.85),该结果进一步证实胡杨FSD3基因已被假基因化。
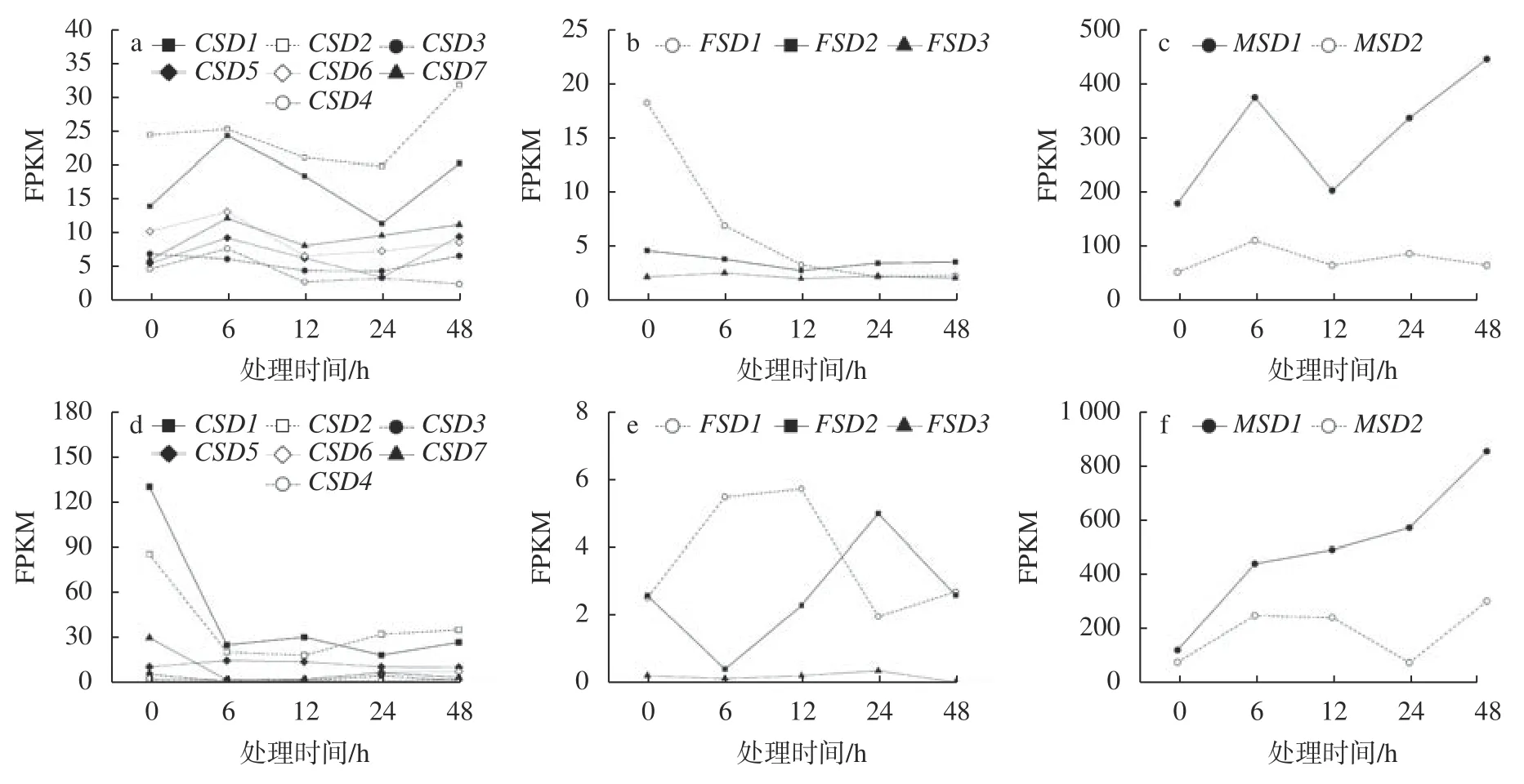
图 2 毛果杨(a、b、c)和胡杨(d、e、f)愈伤组织中SOD基因表达对短期NaCl 胁迫的响应Fig. 2 The expression of SODgenes in response to short-term NaCl stress from callus ofP. trichocarpa(a, b, c) and P. euphratica(d, e, f)
胡杨和毛果杨愈伤组织中SOD基因在短期盐胁迫条件下的转录动力学差异较为明显。在CSD亚家族中,毛果杨(图2a)多数基因均展现出上调(0~6 h)、下调(6~12 h,12~24 h)和再上调(24~48 h)的模式,而胡杨(图2d)多数基因则展现出较为单一的调节模式,经急性下调(0~6 h)后保持稳定(6~48 h)。种内各采样时间点的两两比较结果显示(表3),毛果杨各基因的表达差异均不显著,胡杨CSD1(0 h vs. 6/24/48 h)、CSD2(0 h vs. 12 h)和CSD7(0 h vs. 12 h)3 个基因被显著下调,P<0.05 且 log2FC >1 或 <-1(FC 为 差 异 倍 数)。在MSD亚 家 族中,毛果杨(图2c)MSD1基因与CSD亚家族基因的表达模式一致,展现出上调(0~6 h)、下调(6~12 h)和再上调(12~48 h)的模式(两两比较差异不显著),而胡杨(图2f)MSD1基因则表现出连续上调的模式(0 h vs. 48 h 差异显著)。此外,2 个树种MSD2基因对盐胁迫条件响应的敏感度均明显低于MSD1基因。在FSD亚家族中,毛果杨FSD1基因的表达被连续抑制,两两比较结果显示,0 h vs. 12/24/48 h 时差异均显著(图2b 和表3)。
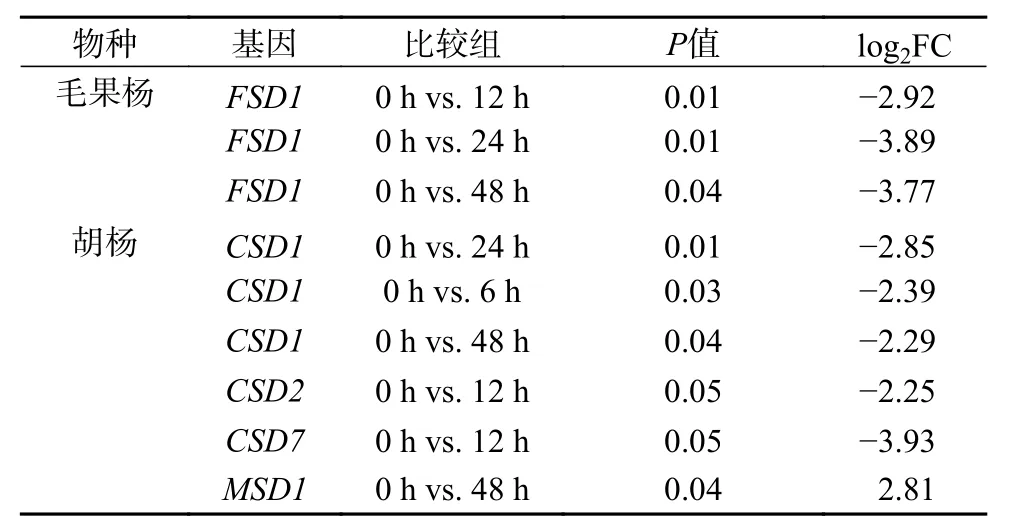
表 3 NaCl 胁迫处理不同时间下胡杨和毛果杨SOD基因表达的种内差异分析Table 3 Pairwise comparison analysis of SODgene expression levels in different periods of NaCl stress within species
2.4 MSD 蛋白质的结构和理化性质
截至目前,高等植物中仅拟南芥MSD 已有蛋白质X 射线晶体衍射结构(4C7U)。结构文件显示,拟南芥MSD 蛋白质为同源四聚体结构,每条多肽链活性中心有一个Mn2+。序列比对结果显示(图3),基因预测多肽序列N 端的21~22个氨基酸残基在结构文件中丢失。与其他类群MSD 蛋白质结构文件比较分析发现,人类(1N0J)和秀丽隐杆线虫(3DC6)等也存在相似的现象,说明MSD 在体内组装成成熟蛋白质的过程中存在加工修饰。杨属树种MSD2 与MSD1预测多肽序列的差异主要是N 端前12~15 4 个氨基酸残基的缺失,因此2 种类型的MSD 蛋白质结构可能差别不大。如果2 种MSD 蛋白质在生物学功能上存在差异,那么功能的差异可能主要来自20 位以后氨基酸残基的突变。

图 3 杨属6 种植物的MSD1 和MSD2 氨基酸序列分析Fig. 3 Amino acid sequence alignment of MSD1 and MSD2 from 6 Populusspecies
胡杨和毛果杨MSD 蛋白质理化性质分析结果表明(表4),2 个树种的2 种MSD(MSD1 和MSD2)均为稳定蛋白质,但稳定性较差(不稳定系数略小于40),其中胡杨2 种MSD(MSD1和MSD2 的不稳定系数分别为36.12 和38.98)蛋白质的稳定性均高于毛果杨(MSD1 和MSD2 的不稳定系数分别为37.86 和39.39)。与MSD2 相比,2 个树种的MSD1 蛋白质理论pI 均明显降低(胡杨MSD1 和MSD2 分别为5.97 和5.77;毛果杨MSD1 和MSD2 分别为6.17 和5.91),蛋白质碱性增强;GRAVY 数值均明显降低(胡杨MSD1 和MSD2 分别为-0.465 和-0.514;毛果杨MSD1 和MSD2 分别为-0.476 和-0.519),蛋白质亲水性增强。蛋白质氨基酸序列极性和亲水性分析结果表明(图4),2 个树种MSD2 蛋白理论pI 和GRAVY 的降低与极性氨基酸(碱性)突变密切相关。
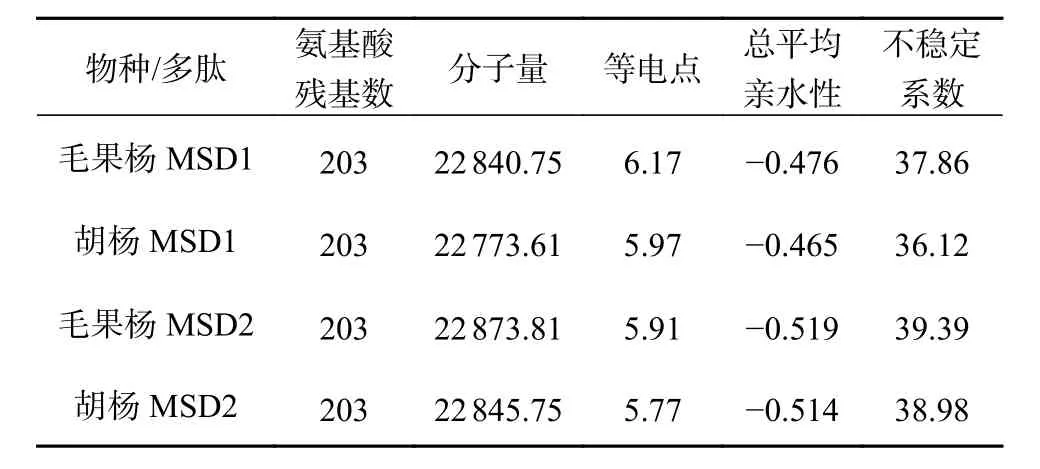
表 4 胡杨、毛果杨MSD1 和MSD2 的物理化学性质比较Table 4 The physicochemical properties of MSD1 and MSD2 in P. trichocarpaand P. euphratica
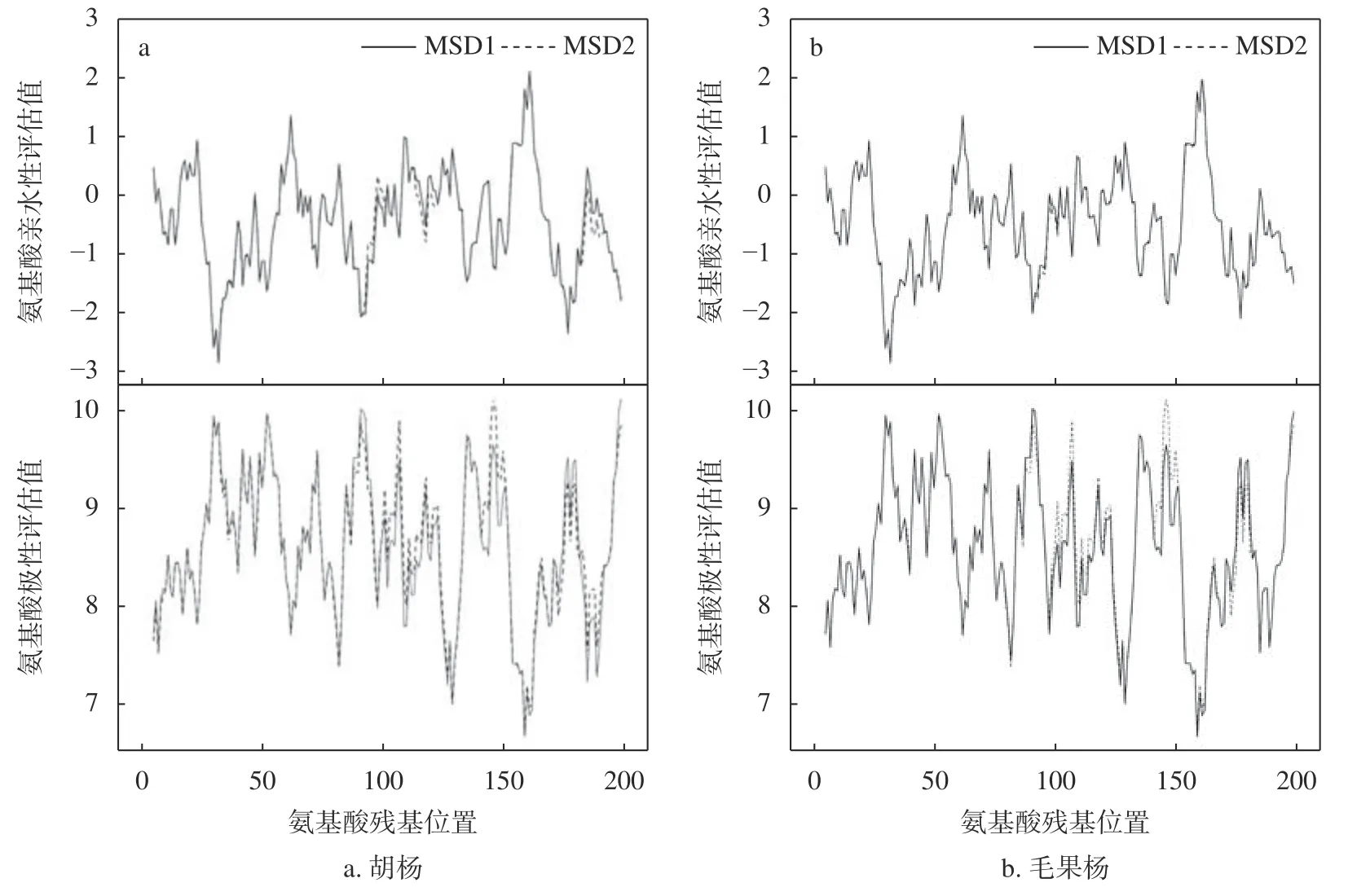
图 4 胡杨、毛果杨MSD1 和MSD2 多肽氨基酸残基的亲水性和极性分析Fig. 4 The hydrophilicity and polarity of amino acid residues in MSD1 and MSD2 polypeptides ofP. trichocarpaand P. euphratica
与毛果杨相比,胡杨MSD1 和MSD2 氨基酸序列分别有5 个(37I-V、97S-N、118T-A、187K-T和202H-N)和2 个(5S-T 和97R-N)位点突变,其中MSD1 的118T-A 为亲水氨基酸到疏水氨基酸的突变,MSD1 的187K-T 和202H-N 以及MSD2 的97R-N 为碱性氨基酸到中性氨基酸的突变。蛋白同源模型比较分析结果(图5)显示,上述所有突变均位于蛋白质亚基单体的表面,且远离蛋白质活性中心(Mn2+附近区域),推测胡杨2 种MSD 蛋白质的氨基酸突变对酶活性的影响较小。值得注意的是,MSD1 靠近C 末端的187 和202 位以及MSD2 的97 位3 个突变位于四聚体的接触面。其中MSD1(187K-T)和MSD2(97R-N)突变分别在AB/CD 和BD 亚基接触面区域引入了1 个额外的氧原子,该氧原子可能通过与相邻亚基区域形成额外的氢键稳固亚基间的相互作用,但对亚基间的距离影响不大(毛果杨MSD1 的AB、CD 亚基中187Lys:Cα 和30Gln:Cα 的距离分别为7.54 和7.26 Å,MSD2 的BD 亚基97Arg:Cα 和2Gln:Cα 的距离分别为7.28和6.29 Å;胡杨MSD1 的AB、CD 亚基187Thr:Cα和30Gln:Cα的距离分别为7.55 和7.30Å,MSD2的BD 亚基97Asn:Cα 和2Gln:Cα 的距离分别为7.64 和6.31 Å)。MSD2 的202H-N 突变在BD 亚基接触面引入了2 个额外的氧原子,额外的与氧原子可能在该区域至少形成2 个额外的氢键,使该区域内亚基相互作用增强。这种区域内相互作用的增强最终拉近了B 和D 亚基间的距离(毛果杨BD 亚基202位2 个His:Cα 的距离为6.30,胡杨BD 亚基202位2 个Asn:Cα 的距离为5.54)使得BD 亚基间的刚性增强。
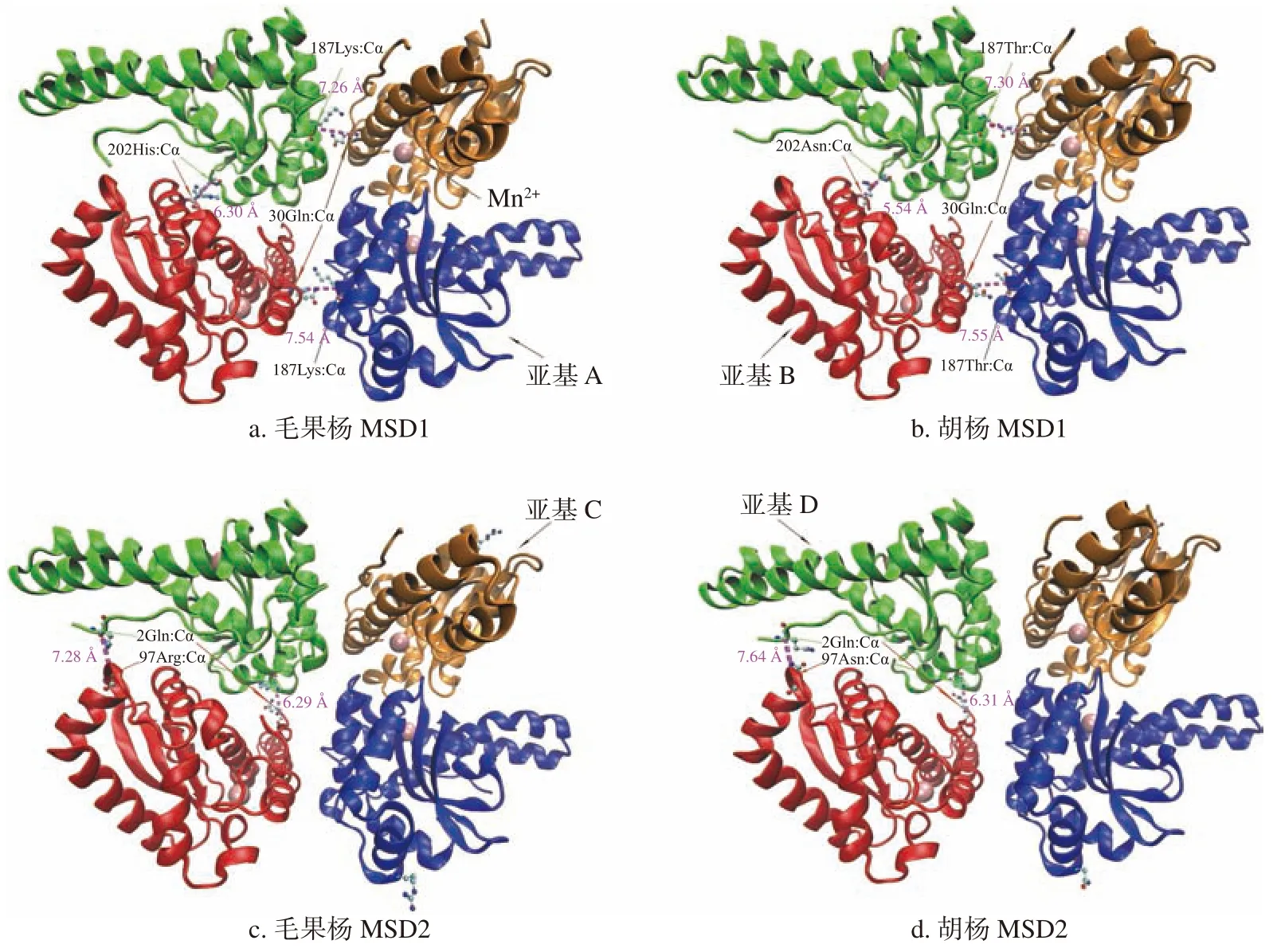
图 5 胡杨和毛果杨MSD1 和MSD2 同源模型比较分析Fig. 5 Comparative analysis of MSD1 and MSD2 homology modeling from P. trichocarpaand P. euphratica
3 结论与讨论
Scioli 等[32]对豌豆SOD基因cDNA 的成功克隆和鉴定标志着植物SOD家族的研究进入到基因水平。随着测序技术发展和应用,逐步加深了人们对SOD在分子水平的认识。在植物基因组中,尽管SOD基因家族均由CSD、FSD和MSD3 个基因亚家族组成,但各亚家族成员的数量存在较大差别,如番茄、高粱(Sorghum bicolor)、香蕉(Musa acuminata)和葡萄(Vitis vinifera)基因组中3 个亚家族成员组成模式分别为4-4-1、5-2-1、6-2-4和6-2-2[32-36]。与Molina-Rueda等[37]的研究结果相符,本研究在胡杨基因组中鉴定到12 个SOD基因家族成员,由7 个CSD、3 个FSD和2 个MSD基因组成,其中FSD3基因已假基因化。在另外5 种杨属树种中,毛果杨、灰杨和银白杨3 个树种基因组中SOD基因家族的数量与胡杨一致,灰杨和银白杨(分别为CSD3和FSD3基因)中也有1 个基因被假基因化;小叶杨(CSD1和FSD1基因)和美洲黑杨(CSD1和CSD2基因)基因组中均有2 个基因发生过至少1 次基因复制事件。在基因树中,杨柳科CSD1与CSD2、CSD3与CSD6/7、FSD1与FSD2、MSD1与MSD2分支互为旁系同源关系,这可能与杨柳科树种在进化历史上发生过1 次全基因组复制事件密切相关[38]。基因组复制事件后,绝大多数SOD基因的旁系同源基因在后代谱系中保留(除FSD2和CSD4/5分支外)。值得注意的是,拟南芥在进化历史上发生过2 次全基因组复制事件(α 和β),理论上SOD基因家族应成4 拷贝形式出现,但现存物种基因组中多数基因却仅保留1~2 个拷贝。杨属树种中SOD这种优先保留模式和通过单基因复制的扩张模式可能暗示了它们在多年生木本植物中对氧化胁迫响应的重要性。
亚细胞定位研究结果显示,拟南芥MSD主要在线粒体中表达,FSD主要在叶绿体中表达,CSD主要表达部位为细胞质(CSD1)和叶绿体(CSD2和CSD3)[39]。线粒体是机体有氧代谢的活性中心,为产生活性氧的主要细胞结构之一,MSD在线粒体中的高表达对维持线粒体内氧自由基平衡起到关键作用。与实时定量PCR 的研究结果相符[37],MSD亚家族的2 个基因在胡杨根和叶组织中的表达均占优势,说明MSD可能作为胡杨SOD家族的组成型表达基因在各组织线粒体中均起到抗氧化的主导作用。在CSD基因亚家族中,毛果杨CSD2和CSD6基因在根和叶组织中的表达量远高于胡杨(40.59 倍和4.30 倍)。该结果与对豌豆[14]的研究结果相符,长期逆境胁迫引起CSD2酶活性的升高。毛果杨作为生长最迅速的杨属树种,在适宜条件下根、叶组织中的营养物质主动运输和光合速率可能远高于胡杨[40],由此推测CSD2和CSD6可能在速生杨品种的主动运输和合成代谢活跃的特定组织中长期发挥功能,这符合CSD基因功能的进化起源假说[41]。在FSD基因亚家族中,FSD1基因在胡杨叶组织中的表达量较高(FPKM 为22.64),约为毛果杨的3.14 倍;大量的研究结果证实,FSD高表达可以有效保护叶绿体免受逆境胁迫引起的氧化损伤[42],说明胡杨FSD1基因的高表达是其适应逆境环境的特征之一。此外,在NaCl 短期胁迫条件下,胡杨愈伤组织中大部分基因呈现出波动或下调表达的趋势,仅MSD1基因的表达被持续上调,说明在胡杨SOD基因家族中MSD1可能响应盐胁迫最敏感,是胡杨具有较强耐盐胁迫能力的主要因素之一。上述结果与对盐敏感和耐受的番茄和豌豆品种的比较分析结果高度相符[12-14],说明MSD 酶活性的升高可能是盐耐受品种普遍的适应策略。
在胡杨和毛果杨中,MSD1 蛋白质的稳定性明显高于MSD2,且胡杨的2 种MSD 蛋白质稳定性均高于毛果杨。2 种MSD 蛋白质稳定性升高具有相似的分子机制,均是通过发生在亚基间接触位置的氨基酸突变引发的(不同的突变,相似的结果)。与毛果杨相比,胡杨MSD1(187K-T和202H-N)和MSD2(97R-N)3 个氨基酸突变均在亚基间接触位置引入了额外的氧原子,这些额外的氧原子可能通过氢键相互作用使四聚体蛋白质变得更稳定。稳定的蛋白质结构有利于2 种MSD 在有氧代谢活跃的线粒体中积累到更高的浓度,从而增加其在逆境条件下清除过量自由基的能力。因此,本研究推测胡杨MSD1 对逆境环境的适应涉及基因表达的调节与蛋白质结构的共同进化,上述推测以及氨基酸突变对蛋白质功能的影响尚需实验进一步验证。
