DNA甲基化参与LPS对奶牛乳腺上皮细胞泌乳功能的影响
2023-06-19魏祥飞冉耀祥姜毓君王春梅
张 莉,魏祥飞,冉耀祥,姜毓君,曲 波,王春梅
(东北农业大学生命科学学院,乳品科学教育部重点实验室,哈尔滨 150030)
乳腺炎是奶牛饲养过程中较为常见的炎症性疾病,对世界范围内乳制品行业造成巨大影响[1]。病原体侵入乳腺组织,繁殖并产生毒素,导致乳房损伤[2]。革兰氏阴性菌,如大肠杆菌、克雷伯氏菌等是引发奶牛乳腺炎的主要病原微生物[3]。脂多糖(Lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁上主要成分,也是主要致病毒素,进入机体后可激活细胞相关信号通路,促进多种细胞因子特别是炎性因子表达和释放,引起机体一系列炎症反应[4]。
乳脂肪、乳糖和乳蛋白是牛奶中重要营养物质,是决定牛奶营养品质的重要指标[5-8]。DNA 甲基化作为主要表观遗传修饰机制之一,可在不改变DNA序列情况下调控基因表达[9]。近年来,研究表明DNA 甲基化参与炎症反应,在奶牛乳腺发育与泌乳调控等方面扮演重要角色[10-12]。AKT作为一种丝氨酸/苏氨酸蛋白激酶,在细胞生长、增殖、凋亡、代谢等方面发挥重要作用。在哺乳动物细胞中,AKT共有3种亚型,分别为AKT1、AKT2和AKT3,其中仅AKT1 在妊娠期奶牛乳腺中表达上调,且在调节乳汁合成的代谢过程中发挥重要作用[13]。为探究LPS 对奶牛乳腺上皮细胞(Bovine mammary epithelial cells,BMECs)乳糖、乳脂和乳蛋白合成影响及其潜在机制,本试验构建LPS诱导的奶牛乳腺上皮炎症细胞模型,检测DNA 甲基转移酶DNMT1 和DNMT3A 表达变化、AKT1 基因启动子甲基化水平变化,检测泌乳指标,以期发现其内在联系,为研究LPS对奶牛泌乳功能的影响机制提供理论基础。
1 材料与方法
1.1 主要试剂和仪器
主要试剂:I 型胶原酶,购自美国Gibco 公司;LPS 购自美国Sigma 公司;RNA 微量提取试剂盒,购自广州美基生物科技有限公司;AxyPrep 基因组DNA 小量制备试剂盒,购自美国Axygen 公司;EZ DNA Methylation-LightningTM Kit,购自美国ZYMO RESEARCH 公 司;PrimeScriptTMRT re⁃agent Kit with gDNA Eraser(Perfect Real Time)、TB Green®Premix Ex TaqTMII(Tli RNaseH Plus),购自日本Takara 公司;CSN2 一抗,AKT1 一抗,PAKT1一抗,均购自武汉爱博泰克生物科技有限公司;DNMT1、DNMT3A一抗,购自美国Cell Signal⁃ing Technology 公司;组织细胞甘油三脂(TG)含量酶法测定试剂盒,购自北京普利莱基因技术有限公司;Bovine Lactose ELISA KIT,购自上海瑞番生物科技有限公司;CCK-8 试剂盒,购自上海碧云天生物技术有限公司。
主要仪器:CO2细胞培养箱购自美国Thermo,Fisher,激光共聚焦显微镜购自德国Leica,PCR仪,购自美国Eppendorf,酶标仪购自美国Thermo Fisher,化学发光成像系统购自英国Uvitec,实时荧光定量PCR仪购自美国Thermo Fisher。
1.2 方法
1.2.1 奶牛乳腺上皮细胞的获取与鉴定
本试验选取处于泌乳期的中国荷斯坦奶牛新鲜乳腺组织,利用胶原酶消化法分离得到原代乳腺上皮细胞,向细胞中加入含10%胎牛血清,100 U·mL-1青霉素和100 μg·mL-1链霉素DMEMF12 培养基,置于5% CO2、37 ℃无菌恒温培养箱中培养。培养体系中含有成纤维细胞和奶牛乳腺上皮细胞,待细胞铺满至细胞培养瓶瓶底,利用两种细胞对胰酶的敏感性和耐受性差异,使用0.25%胰酶进行纯化去除成纤维细胞。
采用免疫荧光染色法对纯化后奶牛乳腺上皮细胞进行角蛋白18(CK18)染色鉴定。将纯化获得的奶牛乳腺上皮细胞传代至3.5 cm 细胞培养皿中,待细胞生长密度达到70%左右时,弃培养液,用4%多聚甲醛室温固定20 min 后加入封闭液(含5%BSA的PBS/T溶液)在37 ℃环境下封闭1 h,然后加入封闭液稀释的CK18(1∶200)一抗,4 ℃孵育过夜,弃一抗,用PBS清洗细胞后,加入封闭液稀释的FITC标记的山羊抗兔二抗,37 ℃孵育1 h,逐滴加入DAPI 溶液,激光共聚焦显微镜检测乳腺上皮细胞CK18的特异性荧光。
1.2.2 筛选LPS刺激BMECs的最佳剂量
取处于对数生长期的细胞接种于96 孔板,培养24 h 后,显微镜下观察细胞生长状态,生长良好时,用0、1、10 和100 μg·mL-1的LPS 分别处理细胞12 h,每个处理设置5个重复。弃上清,每孔加入100 μL 新鲜培养基(含10 μL CCK-8 溶液),继续培养3 h。在酶联免疫检测仪450 nm处测量各孔吸光值,以细胞抑制率(IR)≤10%为判断标准,确定LPS 最佳处理浓度。IR=(空白OD-模型OD)/空白OD×100%。
1.2.3 BMECs中AKT1和炎症因子表达变化
取状态良好的奶牛乳腺上皮细胞接种于六孔板,待细胞贴壁率达到80%~90%时,弃培养液,分别加入含有浓度为0、1、10 和100 μg·mL-1LPS新鲜培养基继续孵育12 h。LPS 诱导细胞12 h 后,按照RNA 微量提取试剂盒说明书提取细胞总RNA,使用NanoDrop2000 测定提取的RNA 浓度、OD260/OD280值及OD260/OD230值,检测后RNA 应立刻通过PrimeScriptTMRT试剂盒逆转录合成cDNA。按照TB Green®Premix Ex TaqTMII(Tli RNaseH Plus)试剂盒说明书步骤进行RT-qPCR,反应体系为20 μL,反应程序为95 ℃,30 s;95 ℃,5 s;60 ℃,30 s,40 个循环。根据GenBank 中牛AKT1、TNF-α、IL-1β及IL-6 的mRNA 序列,借助Primer Premier 5.0 软件分别设计扩增引物。引物由上海生工生物工程股份有限公司合成,序列信息见表1。

表1 荧光定量PCR引物序列Table 1 Primer sequence of fluorescence quantitative PCR
1.2.4 DNMT1、DNMT3A、AKT1 及P-AKT1 蛋白表达水平变化
将各组细胞弃去培养液,经预冷PBS 洗涤3 次后,向各孔内加入200 μL RIPA 裂解液,待细胞裂解充分后将裂解液转移至1.5 mL离心管,10 000~14 000 g 离心3~5 min,将上清液转移至新的1.5 mL 离心管,加入等量2×蛋白上样缓冲液,100 ℃煮沸10 min,超声3 次,每次15 s。在10%SDS-PAGE凝胶中将蛋白样品进行电泳分离,然后电转移至硝酸纤维素膜,将湿转后硝酸纤维素膜放入TBST配制的5%脱脂乳中37 ℃摇床封闭2 h,将NC 膜 置 于 含 有DNMT1、DNMT3A、AKT1 及PAKT1特异性抗体(所用抗体均属兔源,按照1∶1 000的比例进行稀释)的一抗稀释液中,4 ℃孵育过夜。次日,TBST 洗膜3×10 min,使用HRP 标记的山羊抗兔二抗在37 ℃环境中孵育1 h,再次用TBST漂洗NC膜,ECL化学发光液检测目的蛋白条带,Image J软件分析各条带灰度值。
1.2.5 AKT1基因启动子甲基化水平变化
使用BSP 法检测AKT1 基因转录起始位点上游-2 000~-1 500 bp 区域CpG 岛(该CpG 岛内共有16 个CG 位点)甲基化情况。使用Axygen 基因组DNA 提取试剂盒提取细胞总DNA 并用NanoDrop 2000 测定其浓度。使用EZ DNA Methylation-Light⁃ningTMKit 对基因组DNA 进行亚硫酸氢盐修饰。使用在线网站MethPrimer Home(http://www.urogene.org/)和Primer premier 5软件设计AKT1启动子特异性BSP引物,正向引物序列为5'GGAGTAGAGAGTA TTATTTTTGGAAGGT 3',反向引物序列为5'ACTA CTAACAAAACCAAACAACTATC 3'。以修饰后DNA为模板,使用Taq DNA 聚合酶进行PCR 扩增,扩增产物长度为252 bp。PCR反应条件:94 ℃8 min;94 ℃30 s,58 ℃30 s,72 ℃40 s,45 个 循 环;72 ℃10 min,4 ℃∞。PCR产物采用Axygen凝胶纯化试剂盒进行纯化,纯化产物克隆到pMD18-T 载体上,并转化到JM109大肠杆菌感受态细胞中。经涂板,阳性克隆筛选,每个样品至少挑取10 个克隆送至吉林库美生物科技有限公司测序。
1.2.6 LPS对奶牛乳腺上皮细胞乳糖、甘油三酯和β-酪蛋白合成的影响
采用裂解液低温处理细胞约10 min,短暂离心后收集上清70 ℃加热10 min,按照组织细胞甘油三酯(TG)含量酶法测定试剂盒说明书操作,检测各组细胞甘油三酯含量。
收集细胞培养液,3 000 r·min-1离心10 min,将上清液转移至新的1.5 mL 离心管中,按照牛乳糖ELISA检测试剂盒说明书操作,使用酶标仪检测标准品和样品OD值。利用已知标准品浓度和对应OD 值作标准曲线,通过标准曲线计算样品中乳糖浓度。采用Western blot 方法检测乳奶牛乳腺上皮细胞中β-酪蛋白含量,具体步骤同1.2.4。
1.2.7 数据处理与统计分析
所有数据均使用GraphPad Prim 8 软件进行统计分析,结果以平均数±标准差表示,采用单因素方差分析法分析组间差异。P<0.05,差异显著;P<0.01,差异极显著,均具有统计学意义。
2 结果与分析
2.1 奶牛乳腺上皮细胞分离培养与鉴定
本研究中原代乳腺上皮细胞是通过酶消化法从奶牛乳腺组织中获取。成纤维细胞和上皮细胞对胰酶敏感性存在差异,利用这一特点实现两者分离,达到纯化细胞目的。纯化的奶牛乳腺上皮细胞呈椭圆形,排列较为紧密。角蛋白18 是乳腺上皮细胞特异性标志蛋白,采用免疫荧光染色法检测角蛋白18 表达,检测结果如图1 所示,细胞核被DAPI 染成蓝色,细胞质中绿色丝状物质为CK-18,图像融合后可观察到蓝染的细胞核位于呈现绿色荧光的胞质中,据此确定纯化得到的细胞为奶牛乳腺上皮细胞。
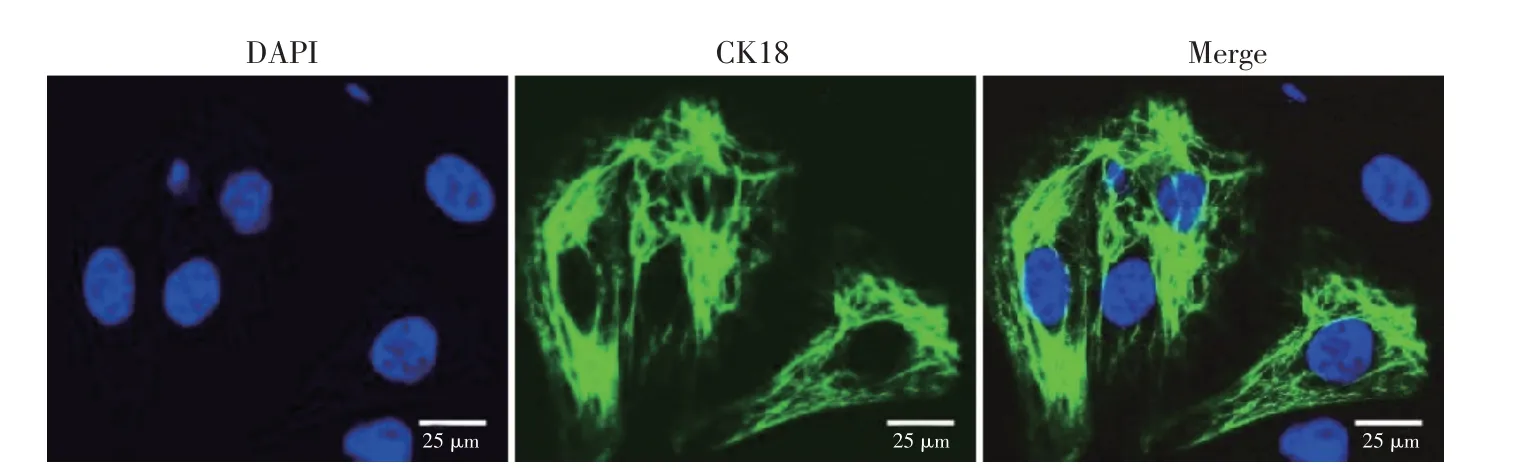
图1 奶牛乳腺上皮细胞角蛋白18鉴定Fig.1 Identification of keratin 18 in bovine mammary epithelial cells
2.2 LPS刺激BMECs的最佳质量浓度
设置3 组不同浓度LPS 分别处理BMECs 12 h,结果如图2A 所示,随浓度增加,LPS 对细胞活性抑制作用也逐渐增加,具有剂量依赖性。1 μg·mL-1LPS 抑制率为3.52%,10 μg·mL-1LPS 抑制率为9.71%,因此,按照细胞抑制率(IR)≤10%判定标准,选择10 μg·mL-1作为诱导炎症反应发生的最佳质量浓度。

图2 LPS对奶牛乳腺上皮细胞的影响Fig.2 Effects of LPS on mammary Epithelial Cells in Dairy Cows
2.3 炎症因子TNF-α、IL-1β、IL-6表达
为验证LPS诱导的奶牛乳腺上皮细胞炎症模型可靠性,采用RT-qPCR 法检测奶牛乳腺上皮细胞中IL-1β、IL-6 和TNF-α的mRNA 含量,由图2B可知,1、10 和100 μg·mL-1LPS 处理组细胞中IL-1β、IL-6 和TNF-α的mRNA 含量均极显著高于空白对照组(P<0.01),且10 μg·mL-1LPS 刺激条件下上述3种炎症因子表达量均略高于其他处理组,表明LPS诱导的奶牛乳腺上皮细胞体外炎症模型构建成功,后续试验均采用10 μg·mL-1LPS诱导奶牛乳腺上皮细胞构建体外炎症细胞模型。
2.4 BMECs中甘油三酯合成变化
采用10 μg·mL-1LPS 诱导奶牛乳腺上皮细胞体外炎症模型后,根据组织细胞甘油三脂酶法测定LPS对奶牛乳腺上皮细胞甘油三酯合成的影响。结果显示,与空白对照组相比,在LPS 刺激12 h 后,奶牛乳腺上皮细胞中甘油三酯含量极显著降低(P<0.01)(见图3A)。

图3 LPS对奶牛乳腺上皮细胞泌乳功能的影响Fig.3 Effects of LPS on lactation function of mammary epithelial cells in dairy cows
表明LPS 极显著抑制BMECs 中甘油三酯合成,可能进一步降低乳汁中乳脂含量。
2.5 BMECs中乳糖合成变化
采用牛乳糖检测试剂盒检测LPS刺激对奶牛乳腺上皮细胞乳糖合成的影响。结果表明,与空白对照组相比,炎症模型组中乳糖含量极显著降低(P<0.01,见图3B)。表明LPS 对BMECs 中乳糖合成和分泌具有极显著抑制作用。
2.6 BMECs中β-酪蛋白合成变化
采用Western blot 检测LPS 刺激对奶牛乳腺上皮细胞中β-酪蛋白合成的影响。结果显示,与空白对照组比较,LPS处理的奶牛乳腺上皮细胞中β-酪蛋白表达量极显著下降(P<0.01,见图3C和D)。表明LPS 抑制β-酪蛋白合成,并可能进一步降低乳蛋白含量。
2.7 AKT1基因表达变化及P-AKT1蛋白含量检测
采用荧光定量PCR 检测LPS 对AKT1 mRNA 表达的影响,采用Western blot 检测LPS 对AKT1 和P-AKT1 蛋白表达的影响,结果见图4,LPS 处理组中AKT1 mRNA 表达量极显著低于空白对照组(P<0.01),AKT1 和P-AKT1 蛋白表达量均极显著低于空白对照组(P<0.01)。结果提示,LPS 抑制AKT1基因表达,且抑制AKT1蛋白激活。

图4 LPS对奶牛乳腺上皮细胞中AKT1基因表达及AKT1蛋白磷酸化的影响Fig.4 Effects of LPS on AKT1 gene expression and AKT1 protein phosphorylation in mammary epithelial cells of dairy cows
2.8 DNA甲基转移酶DNMT1和DNMT3A表达量检测
采用Western blot 检测LPS 对BMECs 中DNMT1和DNMT3A 表达水平的影响。结果显示,与空白对照组相比,LPS 处理组DNMT1 和DNMT3A 蛋白表达极显著上升(P<0.01,见图5)。上述结果提示,DNA 甲基转移酶表达显著上调可能导致部分泌乳相关基因甲基化水平升高,进一步抑制其表达。
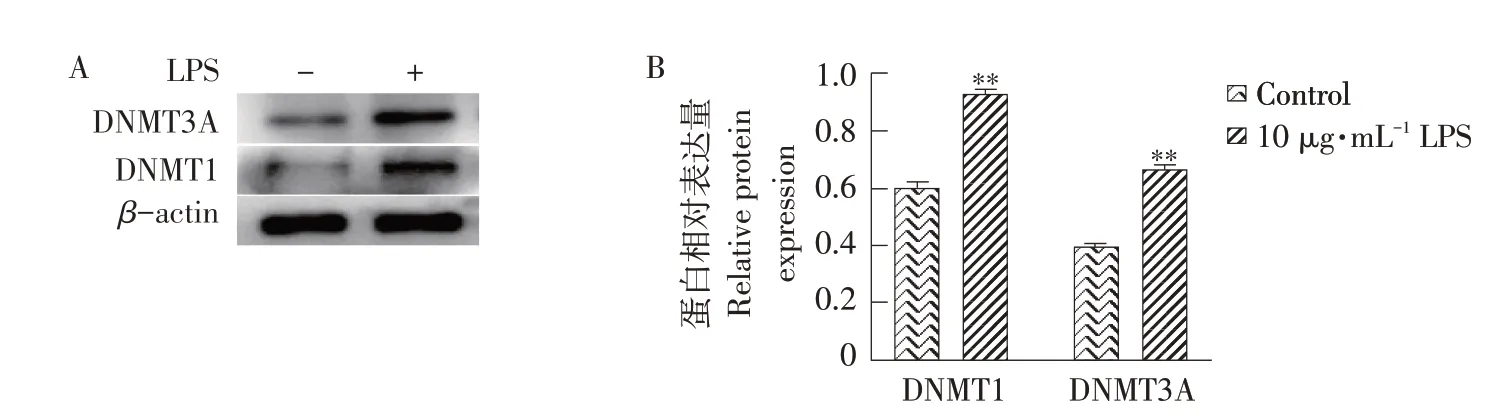
图5 LPS对奶牛乳腺上皮中DNMT1和DNMT3A蛋白表达的影响Fig.5 Effects of LPS on DNMT1 and DNMT3A protein expression in mammary epithelial cells of dairy cows
2.9 AKT1基因启动子甲基化水平检测
收集LPS诱导的奶牛乳腺上皮细胞样品,提取细胞全基因组DNA,通过BSP方法检测AKT1启动子甲基化水平。根据AKT1基因启动子区CpG岛位置设计BSP引物,以亚硫酸氢盐修饰后基因组DNA为模板,使用Taq酶进行PCR扩增反应,扩增后产物长度为252 bp,包含16个CG位点,PCR产物经琼脂糖凝胶电泳检测、DNA胶回收、连接及转化后,挑取阳性单克隆菌落送至生物公司测序。电泳检测结果见图6A,目的条带大小与实际相符,表明该BSP引物有效扩增出目的基因片段。甲基化水平检测结果见图6B和C,与空白对照组相比,LPS诱导奶牛乳腺上皮细胞12 h后,AKT1基因启动子甲基化水平极显著升高(P<0.01),上升至18.75%,表明BMECs发生炎症反应后,AKT1表达受甲基化调节,AKT1启动子甲基化水平受LPS作用影响。

图6 LPS对奶牛乳腺上皮细胞中AKT1基因启动子甲基化水平的影响Fig.6 Effects of LPS on methylation level of AKT1 gene promoter in mammary epithelial cells of dairy cows
3 讨 论
在乳腺炎发生过程中,炎症部位细胞短时间内产生大量炎症因子,Wu 等发现LPS 刺激奶牛乳腺上皮细胞后,促进肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)等炎性细胞因子分泌[2]。因此炎症因子表达量增加作为乳腺炎发生重要特征之一,可衡量乳腺炎症模型构建是否成功。本研究在LPS 刺激BMECs 后通过对细胞活性、炎症因子表达及泌乳指标检测验证,成功构建奶牛乳腺上皮炎症细胞模型,为进一步探究乳腺炎致病机制和治疗靶点提供一个良好平台。
研究发现,LPS 在诱导BMECs 炎症反应同时还抑制BMECs 增殖,最终导致细胞损伤和凋亡[14-16]。众所周知,AKT1 基因在调控细胞增殖、细胞存活及细胞凋亡等方面发挥重要作用,Lin等研究显示当沉默AKT1基因表达时,奶牛乳腺上皮细胞活力和增殖活性均显著降低[13]。Che 等研究报道AKT1 基因激活促进小鼠B 细胞增殖和分化[17]。在小鼠C2 成肌细胞中,沉默AKT1 基因表达显著降低细胞周期蛋白A含量,诱导细胞周期停滞,表明AKT1 可通过调控细胞周期进程影响细胞增殖[18]。本研究通过CCK8 法检测细胞增殖活性,通过RT-qPCR 检测AKT1 mRNA 水平表达,Western blot 检测AKT1 和P-AKT1 蛋白水平表达,结果表明经LPS处理后,细胞增殖活性受抑制,奶牛乳腺上皮细胞中AKT1 mRNA、AKT1及P-AKT1蛋白表达均极显著降低,该结果提示LPS对奶牛乳腺上皮细胞增殖活性的抑制作用可能是通过AKT1 基因介导。
牛奶中乳蛋白、乳脂和乳糖含量是评价乳品质主要指标,其合成受诸多因素影响[19-20]。本研究发现,在10 μg·mL-1LPS处理12 h条件下,奶牛乳腺上皮细胞中乳脂、乳糖、乳蛋白含量均显著降低。关于LPS所致奶牛泌乳功能降低的分子机制复杂,涉及DNA 甲基化等方面内容鲜有报道。已证实AKT1促进乳糖、乳脂和乳蛋白合成和分泌,在奶牛泌乳调控中发挥重要作用[13,21-22]。实验室前期工作也发现高产和低产奶牛乳腺组织中AKT1基因启动子甲基化水平存在显著差异,确定AKT1启动子甲基化水平与乳成分合成呈负相关[23]。因此,本研究检测奶牛乳腺上皮炎症细胞模型中DNA 甲基转移酶表达变化和泌乳相关基因AKT1启动子甲基化水平变化,以期探究乳腺炎条件下DNA 甲基化在奶牛泌乳调控中的角色。
DNA 甲基化是由DNA 甲基转移酶(DNMTs)催化的一种表观遗传修饰方式,与多种疾病发生发展和转录调控有关[24-25]。哺乳动物中,DNA甲基转移酶主要包括DNMT1、DNMT3A 和DNMT3B,其中DMNT1 主要参与维持甲基化状态,DNMT3A 和DNMT3B 主要负责从头甲基化。Ma 等研究发现LPS 处理后,人脐静脉内皮细胞DNMT1 表达显著增加[26]。Yang等研究表明,LPS诱导猪肺泡巨噬细胞(AMs)12 h,DNMT3A 基因表达增加[27]。Koval⁃chuk 等发现,小鼠连续2周饮用含LPS的水,显著上调脾脏中DNMT1、DNMT3A、DNMT3B和MeCP2蛋白表达水平[28]。上述研究结果表明经LPS 处理后,在多种不同类型细胞中均可检测到DNA甲基转移酶表达升高,具有普遍性。本研究检测BMECs 中DNMT1和DNMT3A 表达情况,结果表明LPS 诱导后,DNMT1 和DNMT3A 表达量也显著增加。另外,AKT1 基因启动子甲基化水平升高,AKT1 基因表达和P-AKT1 蛋白表达均降低,乳脂、乳糖和乳蛋白合成减少,表明DNA 甲基化参与乳腺炎条件下奶牛泌乳调控,且LPS也可通过增加DNA 甲基转移酶DNMT1 和DNMT3A 表达提高AKT1 基因甲基化水平,抑制AKT1 基因表达,并影响AKT1蛋白磷酸化水平,抑制乳成分合成,具体作用机制有待进一步研究证实。本研究为LPS对奶牛泌乳功能的影响机制研究提供新思路和研究方向。
4 结 论
综上,DNA 甲基化参与LPS 诱导的奶牛乳腺上皮细胞中泌乳功能调控,LPS也可通过增加泌乳关键基因AKT1甲基化水平抑制其表达,导致奶牛乳腺上皮细胞泌乳功能降低。
