耐盐解磷菌筛选鉴定及生理特性研究
2023-06-19王宏燕韩凯鑫冯丽荣于志鹏范金霞章圣龙
王宏燕,韩凯鑫,冯丽荣,于志鹏,王 露,范金霞,章圣龙,孙 岩
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.黑龙江国宏节能环保有限公司,哈尔滨 150000;3.东北农业大学工程学院,农业农村部生猪养殖设施工程重点实验室,哈尔滨 150030)
我国农耕土壤盐碱化面积逐步升高[1]。随着人口增长和土壤退化,人均耕地面积减少,盐碱地改良至关重要。客土改良、灌溉排水和添加改良剂等传统的改良盐碱地方式成本较高,实效性低,易造成土壤二次污染,破坏生态环境。微生物改良盐碱地节约能源、改良效果佳、持久性较强,保护土壤环境。在盐碱土壤中,高浓度盐基离子通过吸附作用降低土壤有效磷活性,导致磷元素胁迫性,作物对磷肥利用率仅为5%~25%[2]。解磷菌代谢产物通常包含较多有机酸,其分泌降低植物根际土壤pH,将难溶性磷酸盐转化为可溶性磷供植物吸收利用,促进植物生长,改善土壤环境。
国内外关于微生物菌剂改良盐碱土,促进植物生长已有大量研究。目前,筛选耐盐碱解磷菌主要有单胞菌属、假单胞菌属及芽孢杆菌属等。逄焕成等研究表明,施加微生物菌剂降低盐碱土含盐量和pH,增加土壤速效氮、速效磷、速效钾含量,表明微生物改良盐碱土具有可行性[3]。Wang等研究表明,在NaCl 胁迫下,接种芽孢杆菌(Ba⁃cillussp.)明显增加作物产量[4]。Sahay 等在盐碱土中,使用3株耐盐碱解磷菌接种万寿菊,均不同程度促进万寿菊生长,促进万寿菊对磷的吸收,增加土壤酶活性,改善盐碱土土壤性质[5]。Tripathi等研究表明,土壤盐碱度在较大程度上影响微生物群落及其活性[6]。Naz 等从巴基斯坦凯沃拉盐场分离3 株具有解磷能力的假单胞菌(Pseudomonas),3株菌均具有分泌生长素(IAA)、赤霉素(GA)、反式玉米蛋白核苷(t-zr)和脱落酸(ABA)能力[7]。Nautiyal 等从盐碱土中分离出10% NaCl 浓度,pH 12 条件下可生长的解磷细菌,表明产酸促进磷酸盐增溶[8]。我国盐碱土壤中分离得到多种解磷菌。张巍等从松嫩平原地区盐碱土中分离出2株耐盐碱解磷菌[9]。胡山等从河西走廊盐碱土中筛选得到一株高效解磷菌,研究发现菌株容磷量和pH呈显著负相关[10]。李学平等从黄河三角洲盐碱土中分离筛选出一株解磷菌[11]。赵飞等从滨海盐碱土中筛选到具有溶磷能力的鳞质霉菌(Apophysomycessp.)[12]。刘长霞等从滨海盐碱土壤中分离得到一株在10%NaCl盐分浓度条件下仍有较好解磷能力的真菌[13]。Zhu等从中国黄海岸大桥盐场分离得到嗜盐解磷细菌(Kushneriasp.),在20% NaCl 盐分浓度,pH 4~10条件下仍正常生长[14]。盐碱环境中可存活微生物可提高盐碱土壤中难溶性磷利用率,促进植物生长。目前,东北地区苏打盐碱土主要通过物理灌溉、石膏和生物炭改良,对耐盐碱解磷菌研究和应用较少。
本试验从盐碱土中筛选高效解磷菌株,观察筛选菌株菌落形态,研究菌株生理特性并对菌种作分子生物学鉴定,测定菌株溶磷能力、培养液pH 及菌株生长量变化,分析菌株解磷能力与溶液pH 和菌株生长量之间相关性,测定菌株分泌IAA、胞外多糖和产酸能力及菌株对种子萌发的促生效果,测定菌株耐盐碱能力,以期为耐盐碱解磷微生物菌肥研发提供菌种资源,克服外源菌剂在盐碱土壤中存活率低的现状,为盐碱土地改良作出贡献。
1 材料与方法
1.1 材料
1.1.1 土壤样品
土壤样品取自黑龙江省齐齐哈尔市甘南县双河农场盐碱土壤(含盐量:1.54 g·kg-1;pH:9.23),采样深度15~20 cm,将采集土壤样品立即放入无菌塑料袋中,封口,放于实验室内4 ℃冰箱保存,用于筛选解无机磷细菌。
1.1.2 培养基
①蒙金娜无机磷培养基(Pikovskaya's medi⁃um,以下简称“PVK 培养基”):葡萄糖10.00 g,(NH4)2SO40.50 g,NaCl 0.30 g,KCl 0.30 g,MgSO4·7H2O 0.30 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,Ca3(PO4)25.00 g,蒸馏水1 000 mL,调节pH至7.0。
②LB 培养基:溶菌肉汤培养基(Luria-Ber⁃tani;以下简称“LB培养基”):胰蛋白胨10.00 g,酵母提取物5.00 g,NaCl 10.00 g,蒸馏水1 000 mL,调节pH至7.0。
培养基配方为液体培养基,在以上配方内加入20 g琼脂即为固体培养基。
1.2 方法
1.2.1 解磷菌初筛
称取10 g采集土壤,放入含有90 mL无菌水灭菌三角瓶中,于恒温振荡培养箱中30 ℃,180 r·min-1培养20 min后静置30 min,其上清液即为10-1g·mL-1土壤稀释液,采用10 倍系列稀释,分别稀释至10-2、10-3、10-4、10-5、10-6、10-7和10-8g·mL-1土壤悬液,吸取0.1 mL 悬液涂布至PVK 固体平板培养基上,30 ℃培养5 d。用已灭菌接种环挑取固态平板中有明显透明圈的单菌落,在PVK 固体平板培养基上划线作纯化培养,依次重复此操作5 次以上,直至固体平板上生长为单菌落,结束纯化。将已纯化菌株接种于LB 斜面培养基中,放于4 ℃冰箱保存。
将已分离纯化单株解磷菌接种于PVK液体培养基中,置于30 ℃恒温培养箱培养24 h,无菌水调节所有菌株菌悬液一致(均为1×108CFU·mL-1),吸取20 μL 菌悬液,接种于PVK 固体平板培养基中央,倒置于30 ℃恒温培养箱中培养5 d,每个菌株进行3次重复处理。5 d后,测定菌株菌落直径(D)及其形成的溶磷圈直径(d),计算溶磷指数(Phosphate solubilizing index,PSI)[15]。
式中,PSI-溶磷指数;D-菌落直径(cm);d-溶磷菌圈直径(cm)。
1.2.2 解磷菌株复筛
挑取初筛得到菌株,将其接种于已灭菌有LB液体培养基的250 mL 三角瓶中,于恒温振荡培养箱中30 ℃、180 r·min-1培养24 h获得接种液,稀释菌株OD600为1.0;按照1%接种量接种至PVK 液体培养基(调节pH 为7.0)中,于恒温振荡培养箱中30 ℃、180 r·min-1条件下培养5 d,采用钼锑抗比色法测定菌株溶磷量[16],最终确定高效稳定的解磷菌株。
1.2.3 解磷菌株鉴定
参照《常见细菌系统鉴定手册》中试验方法对菌株进行葡萄糖、蔗糖利用、氧化酶试验、VP 试验、MR 试验、硫化氢产生试验、明胶液化试验、硝酸盐还原试验、精氨酸双水解酶试验和赖氨酸脱羧酶试验[17]。通过透视电镜和16S rRNA 序列分析法进行菌株形态学观察和分子生物学鉴定。
1.2.4 解磷菌解磷能力、pH、菌体生长量测定
将分离菌株接入LB 培养基中进行活化,无菌水稀释菌株OD600为1.0,按1%接种量接入PVK 液体培养基中,对照组接入等量无菌水,于恒温振荡培养箱中30 ℃、180 r·min-1培养168 h。从培养开始每间隔24 h 取样一次,分别测定菌株生长量(OD600)和溶磷量及培养液pH。采用钼锑抗比色法测定菌株溶磷量。
1.2.5 解磷菌株分泌生长因子特性
①IAA 含量测定:采用Sackowski 比色法测定菌株分泌IAA 能力[18]。将菌株接种于LB 液体培养基(含L-色氨酸)中,于恒温振荡培养箱中30 ℃、180 r·min-1培养3 d,3次重复试验,无菌水调节菌悬液OD600为1.0。取菌株悬液置于离心管中,之后于高速离心机4 000 r·min-1离心10 min。吸取2 mL上清液于试管中,加入等量Sackowski 显色剂,摇匀,避光静置30 min,测定OD530分光光度值计算菌株分泌IAA含量。
②菌株分泌胞外多糖能力测定:采用苯酚-硫酸法[19]。将菌株接种至LB 液体培养基中,于恒温振荡培养箱中30 ℃、180 r·min-1培养3 d,之后用无菌水调节菌悬液OD600为1.0,于高速离心机中4 500 r·min-1离心15 min,加入80%三氯乙酸于上清液中使其浓度为4%,4 ℃静置24 h,于高速离心机中10 000 r·min-1离心20 min,用等量去离子水溶解收集红色沉淀,透析得到粗多糖。吸取粗多糖溶液1 mL,之后加入1.0 mL 6%苯酚溶液和5.0 mL浓硫酸,混合均匀,20 min 后于波长490 nm 处测定吸光度值,计算菌株分泌多糖含量。
③菌株产酸能力测定:采用高效液相色谱法测定菌株产有机酸能力[20]。将菌株接种于LB 液体培养基中,于恒温振荡培养箱中30 ℃、180 r·min-1培养3 d,无菌水调节菌悬液OD600为1.0。将其置于高速离心机中10 000 r·min-1离心10 min,之后吸取上清液过0.22 μm 滤膜后上机。液相色谱柱为SVEA AQ 柱;检测器为DAD;柱温设置为40 ℃;进样量为10 μL;流速为0.5 mL·min-1;波长设置为210 nm;流动相使用10 mmol·L-1K2HPO4(pH=2.55)。测定菌株产甲酸、丙酸、丁酸、草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、丁二酸、马来酸、富马酸含量。
④植株出芽率及芽长测定方法
菌株菌悬液配制:将菌株接种到LB 液体培养液中,30 ℃,180 r·min-1,恒温摇床培育3 d;菌悬液在4 000 r·min-1下离心15 min。取离心前发酵液(无菌水稀释活菌密度为1×109CFU·mL-1),离心后上清液及用无菌水稀释底部菌体(无菌水稀释活菌密度为1×109CFU·mL-1),备用。
供试白菜型油菜种子处理:筛选大小相同种子若干粒,乙醇浸泡1 min消毒后,继续将其浸泡于5%次氯酸钠溶液中2 min作消毒处理,无菌水冲洗3~4次,将冲洗的种子置于灭菌滤纸上作干燥处理(所有操作保持无菌处理)。
发芽试验:将经消毒处理的白菜型油菜种子分别用上述发酵液、上清液和菌液浸泡6 h,以无菌水处理作为对照(CK)。将浸泡的白菜型油菜种子放在置于底部铺有双层灭菌滤纸培养皿中,每皿随机放入20 粒种子,重复3 次,并在种子上覆盖一层滤纸,用无菌水润湿滤纸,置于30 ℃生化培养箱中培养7 d,每天浇适量水(每皿水量保持一致),在4 d 后测定种子发芽势,7 d 后,测定种子芽长,统计种子发芽率。
1.2.6 解磷菌株耐盐碱试验
耐盐试验:按照沈萍等方法测定耐盐性[21]。将菌株接种于LB 液体培养基中培养种子液,无菌水调节菌液OD600值为1.0,然后按1%接种量接种到含有不同NaCl浓度梯度(5%、8%、10%)PVK液体培养基中,在30 ℃、180 r·min-1振荡培养箱中培养5 d,测定菌株OD600及其溶磷量。
耐碱试验:按照潘媛媛等方法测定耐碱性[22]。将菌株接种于LB 液体培养基中培养种子液,使用无菌水调节菌液OD600值为1.0,然后按1%接种量接种到含有不同pH(pH=8、9、10)PVK 培养基中,在30 ℃、180 r·min-1振荡培养箱中培养5 d,测定菌株OD600及其溶磷量。
1.2.7 数据统计处理与分析
利 用SPSS 21.0、Microsoft Office 2016 和ORI⁃GIN2019对数据进行分析和作图。
2 结果与分析
2.1 解磷菌分离筛选
经初步分离纯化,得到53 株可在PVK 固体平板上生长菌株。溶磷指数(PSI)是判断菌株溶磷能力的指标,PSI值越大,其溶磷能力越强。根据平板法,将分离纯化的菌株单菌落培养,筛选出4株溶磷能力较好菌株。根据公式计算初筛4 株菌的PSI,结果见表1。其中PSI最大菌株是P-W13,为2.06,P-K21、P-X24 和P-H10 的PSI 分 别 为1.68、1.62、1.56。测定这4 株菌在发酵上清液中的溶磷量进行复筛,结果如表1所示,解磷能力较强的是P-W13,溶磷量为86.23 mg·L-1;其余处理溶磷量分别为84.87、62.29、81.99 mg·L-1(均小于86.23 mg·L-1)。

表1 解磷菌筛选结果Table 1 Screening results of phosphate solubilizing bacteria
2.2 菌种形态学和分子生物学鉴定
解磷细菌P-W13 菌落形态及透射电镜图片如图1 所示。观察其形态,发现菌株P-W13 在平板上呈圆形、光滑、半透明、白色、边缘整齐的菌落(见图1A)。图1B为菌株电镜图,观察发现,PW13 菌体细胞多呈杆状、末端较方;成短链;无荚膜、菌落大、扁平。

图1 解磷菌株P-W13菌落形态及其透射电镜图Fig.1 Colony morphology and transmission electron microscopy of strain P-W13
菌株可利用葡萄糖、蔗糖为碳源。甲基红、明胶液化、硝酸盐还原及精氨酸双水解酶试验均为阳性,氧化酶、V-P、硫化氢产生及赖氨酸脱羧酶试验均为阴性。
解磷细菌P-W13 分子生物学鉴定结果表明,提取P-W13 基因序列与GenBank 中近缘种序列进行同源性比对,选取相似度最高的几株菌序列利用MEGA 进行同源性对比并构建系统发育树,如图2 所示。菌株P-W13 基因序列与LC415612(En⁃terobacter asbburiaeM4-VN)、MW429195(Entero⁃bactersp. strainLAM2022)和MH169128(Enterobac⁃ter cloacaestrain NP07)亲缘关系最近,可确定菌株P-W13为肠杆菌属(Enterobactersp.)。

图2 解磷菌株P-W13同源性分析Fig.2 Homological analysis of phosphate-solubilizing strain P-W13
2.3 解磷细菌P-W13解磷能力分析
解磷细菌P-W13 在解磷液体培养基中连续培养168 h,结果如图3A 所示,对照组溶磷量变化较小,保持在0.67~0.68 mg·L-1,解磷细菌P-W13有较好解磷能力,P-W13 溶磷量随培养时间增加,溶磷量增加,在72~120 h 溶磷量增加较为明显,随时间增加,在第144 h表现出最大溶磷量89.86 mg·L-1,之后,溶磷量开始下降。解磷细菌P-W13结果表明,该菌株在144 h时达到最优解磷能力。
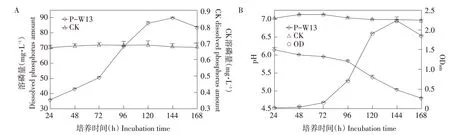
图3 解磷细菌P-W13在168 h内溶磷量、pH和OD600变化Fig.3 Changes of dissolved phosphorus amount,pH and OD600 of P-W13 in 168 h
如图3B 所示,培养168 h 内,对照组pH 保持在7.0左右,无明显变化;解磷细菌P-W13培养液pH 呈逐渐下降趋势,解磷细菌P-W13 培养24 h后,培养液pH已降至6.15,培养液pH和培养时间呈负相关,培养168 h后,培养液pH降至4.80。随培养时间增加,解磷细菌P-W13 生长量呈上升趋势,在144 h时增至最大值(OD600为2.23),之后随培养时间增加,解磷细菌P-W13 生长量逐步降低。解磷细菌P-W13 解磷能力在第144 h 达到最强,表明解磷细菌P-W13 解磷能力与其生长状况一致。
2.4 解磷过程中溶液pH、菌体生长量变化
如图4A所示,将解磷细菌P-W13溶磷量与培养液pH 进行相关性分析,结果发现两者存在极显著负相关(R2=0.776,P<0.01)。如图4B所示,将解磷细菌P-W13溶磷量与其生长量OD600进行相关性分析,结果表明两者存在极显著正相关(R2=0.918,P<0.01)。

图4 菌株溶磷量和培养液pH、菌株OD600相关性分析Fig.4 Correlation analysis of dissolved phosphorus amount with pH of medium and OD600 of strain
2.5 解磷菌株分泌生长因子
如表2所示,解磷细菌P-W13分泌IAA含量和胞外多糖,含量分别为42.01 和72.55 mg·L-1。同时,细菌P-W13 能产生富马酸、丁二酸和丙酸,其分泌丙酸含量最高,为1518.2 mg·L-1,分泌富马酸和丁二酸含量分别为386.2 和94.2 mg·L-1。菌株P-W13 具有分泌胞外多糖的能力,研究发现,具有分泌胞外多糖的菌株分泌的有些多糖类物质具有吸收无机盐作用,对盐碱地改良促进作用明显[23]。不同解磷细菌同时分泌多种有机酸降低土壤pH,提高磷利用率,但不同菌株分泌有机酸的种类和含量之间存在差异。解磷细菌P-W13 具有分泌富马酸、丁二酸和丙酸能力,其他研究中产生这些有机酸的报道较少。初步判断菌株P-W13 通过分泌有机酸降低pH从而溶解无机磷,提高溶磷量。

表2 解磷细菌P-W13分泌生长因子含量Table 2 Growth factors content secreted by P-W13
解磷细菌P-W13 不同处理下对白菜型油菜种子促生长能力如表3 所示。与CK 相比,经菌株P-W13 发酵液、上清液和菌体处理后的白菜型油菜种子其发芽率、根长、芽长均比未经处理的白菜型油菜种子高,其中菌株P-W13 上清液可显著提高种子发芽率、芽长和根长,上清液相比对照发芽率、芽长和根长分别提高6.06%、35.97%和28.52%;P-W13 菌体也可促进种子萌发,菌体处理组与对照相比发芽率、芽长和根长分别提高18.18%、17.99%和28.52%;经菌株P-W13发酵液处理的种子发芽率、芽长、根长相比对照分别提高5.68%、68.35%、94.10%。菌株P-W13 发酵液对番茄种子促生作用显著。

表3 解磷细菌P-W13对白菜型油菜发芽势、发芽率、芽长和根长的影响Table 3 Effects of phosphorus solution-bacteria P-W13 on germination potential,germination rate,bud length and root length of Brassica napus L.
2.6 解磷菌株耐盐碱性能试验
将解磷细菌P-W13 分别接种于不同含盐量PVK液体培养基中培养5 d,在5%、8%和10%NaCl盐分浓度下,解磷细菌P-W13生长正常,菌株生长良好。如图5所示,随盐分浓度升高,菌株生长量逐渐降低。在5%、8%和10%NaCl盐分浓度下,解磷细菌P-W13溶磷量呈现下降趋势,其溶磷量分别为74.84、66.32 和57.09 mg·L-1。解磷细菌P-W13在5%NaCl盐分浓度下生长量和溶磷量均最高。

图5 解磷菌株P-W13在不同盐度下溶磷量和光密度变化Fig.5 Changes of dissolved phosphorus amount and OD600 of P-W13 strain at different salinities
根据对NaCl 耐受能力,微生物可分为:非嗜盐微生物(NaCl 浓度<0.2 mol·L-1)、轻度嗜盐微生物(NaCl 浓度为0.2~0.5 mol·L-1)、中度嗜盐微生物(NaCl 浓度为0.2~2.5 mol·L-1)和极端嗜盐微生物(NaCl 浓度为2.5~5.2 mol·L-1)[24]。解磷细菌P-W13在10%(1.7 mol·L-1)NaCl盐分浓度下正常生长。在浓度为0.5~2.5 mol·L-1NaCl溶液中菌株统称为耐盐菌标准,细菌P-W13属于耐盐解磷菌。
将解磷细菌P-W13分别接种于不同pH的PVK液体培养基中培养5 d,在pH 为8、9 和10 时,解磷细菌P-W13 正常生长,菌株生长良好。如图6所示,随pH 升高,菌株生长量逐渐降低。pH 为8、9和10时,解磷细菌P-W13溶磷量下降,其溶磷量分别为86.47、74.94 和61.42 mg·L-1。pH 为8时,解磷细菌P-W13生长量和溶磷量均最高。

图6 解磷菌株P-W13在不同pH下溶磷量和光密度OD600变化Fig.6 Changes of dissolved phosphorus amount and OD600 of P-W13 strain at different pH
根据对pH 耐受能力,微生物可分为:耐碱微生物(pH 7~9 生长,pH>9.5 不能生长)和嗜碱微生物(pH 10~12 生长)[24]。解磷细菌P-W13 在pH达到10时生长。根据在pH 7~12条件下生长的菌株统称为耐碱菌的标准,细菌P-W13 属于耐碱解磷菌。
3 讨 论
研究表明,细菌P-W13在培养第144 h达到最大溶磷量,之后溶磷量开始下降,贺梦醒等研究解磷菌株B25在第96 h解磷能力达到最大值,之后下降并趋于稳定,与本试验结果一致[25]。这可能因碳源、氮源等营养物质被消耗及菌体本身生长繁殖受抑制等,导致菌株溶磷量降低。
目前研究中解磷菌数量众多,解磷过程复杂,解磷机理具有多样性。目前解磷菌通过直接氧化或者氧化呼吸作用分泌代谢产物或者分泌柠檬酸、葡萄糖酸、草酸等小分子有机酸降低pH 溶解无机磷是比较常见的途径[26]。研究表明,在东北黑土和暗黑棕土壤中,细菌分泌草酸、苹果酸和柠檬酸可使土壤中难溶性磷转化为可供植物吸收利用的有效磷,提高磷利用效率[24]。Lee 等筛选出分泌乳酸、乙酸和柠檬酸的解磷细菌提高磷的利用效率[27]。Yang等研究表明,菌株分泌草酸显著溶解难溶性磷[28]。研究发现,菌株分泌葡萄糖酸也提高磷利用效率。柠檬酸在盐碱化土壤上与土壤表面金属离子络合,有效降低离子浓度及其活性,缓解土壤盐害,为作物提供良好土壤环境;葡萄糖酸与钙、锌等金属离子合成可溶性盐;草酸可结合碱土金属元素,降低其溶解性[29-31]。本研究中解磷细菌P-W13具有分泌富马酸、丁二酸和丙酸的能力,富马酸有强缓冲作用,降低土壤溶液pH;丁二酸促进植物生长,调节养分、增加抗旱、抗病、抗冻能力;丙酸对黄曲霉、某些好气性芽孢杆菌、沙门氏菌及酵母菌均有较好抑制作用,可合成酯类及其衍生的中间体,丙酸酯可广泛用于农药除草剂、树脂改性剂、灭菌剂等[32-34],其他研究中解磷菌产生有机酸的报道较少。初步判断通过产生有机酸降低pH,随培养时间增加,解磷细菌P-W13溶磷量和pH 呈极显著负相关,姜焕焕研究耐盐碱解磷菌改良盐碱土效果时发现以磷酸三钙为磷源的培养基中可溶性磷含量与pH 呈极显著负相关,分析其原因可能是无机磷溶解作用机制主要是因释放低分子质量有机酸,降低培养液pH[24]。这与本研究解磷细菌P-W13溶磷量与pH呈极显著负相关一致。培养液介质pH 降低是溶解无机磷的重要条件,但不是必须有酸产生才溶解无机磷。贺梦醒等研究发现具有解磷功能芽孢杆菌的解磷能力与培养液pH 之间存在相关性[25],但并未达到显著水平,可能在培养过程中解磷菌除分泌低分子有机酸降低pH 溶解难溶性磷之外,还存在其他解磷机理,有待深入研究。
胞外多糖属于微生物次级代谢产物,对作物根际具有保护作用。李文谦等研究菌株分泌胞外多糖含量是54.2 mg·L-1[35]。本文研究解磷菌株P-W13 分泌胞外多糖含量为72.55 mg·L-1,其分泌胞外多糖能力较优。Rojas-Tapias 等研究发现,在盐碱土壤中,接种菌剂后玉米与对照相比,接种菌剂的玉米生长效果更优,与菌株能分泌胞外多糖相关[36]。研究表明,分泌胞外多糖的微生物与金属离子复合,抑制难溶性磷酸盐形成,提高磷利用率[37]。因此,具有分泌胞外多糖特性的解磷菌株增加可利用磷含量,提高磷酸三钙溶解率。
IAA 属于植物生长调节剂,对植物细胞分裂、伸长、分化和种子萌发等方面具有重要作用。姜焕焕研究解磷菌TPM26分泌IAA含量为11.6 mg·L-1[24]。本研究表明,土壤中解磷细菌P-W13 分泌IAA 含量为41.67 mg·L-1。菌株发酵液、上清液及菌体在白菜型油菜发芽试验中,经菌株处理的白菜型油菜种子发芽势、根长、芽长及发芽率均提高,其中菌株P-W13发酵液处理对白菜型油菜种子促生显著,其种子发芽率、芽长、根长相比对照分别提高5.68%、68.35%、94.10%。姜焕焕研究中发现分泌IAA 菌 株TPM26 促 进 花 生 种 子 萌 发[24]。Bahadur 等研究解磷菌株分泌IAA并促进根长增加,提高营养元素利用率,促进植物在盐碱土中生长[38]。王向英等研究解磷菌株对玉米生长具有显著促进效果,表明分泌IAA的解磷菌株能够促进植物生长[39]。
后续将探究温度对筛选菌株溶磷能力的影响。将本文筛选得到的菌株,接种至盐碱土后测定土壤细菌群落结构和理化性质变化,分析接种菌剂对细菌群落结构的影响,探究菌株对改良盐碱土壤的效果,以期为高效耐盐碱解磷微生物菌肥研发提供优良微生物菌种资源。
4 结 论
a.从盐碱土壤中筛选得到一株解磷细菌P-W13,观察菌落形态和经16S rRNA 序列对比,该菌株属于肠杆菌(Enterobactersp.)。
b. 细菌P-W13 在第6 天达到最大溶磷量89.86 mg·L-1,其溶磷量与溶液pH、OD 之间均存在显著相关性。
c.细菌P-W13 在5% NaCl 盐分浓度和pH 为8时解磷能力最强,在10%NaCl盐分浓度和pH为10时仍表现出较好的解磷能力,细菌P-W13 具有较强耐盐碱性,属于耐盐碱解磷菌。
d.菌株P-W13具有分泌IAA的能力,产生IAA含量为42.10 mg·L-1;其分泌胞外多糖含量为72.55 mg·L-1;同时产生富马酸、丁二酸和丙酸,其产生丙酸含量最高,为1 518.2 mg·L-1;产生富马酸和丁二酸含量分别为386.2 和94.2 mg·L-1;经菌株P-W13 处理后的白菜型油菜种子其发芽率、根长、芽长均有提高,且菌种发酵液促生效果优于上清液。
