人参内生真菌强壮土赤壳菌RSA2004中抗乳腺癌活性化合物的分离鉴定
2023-06-19毛伟业李圣宇傅惠英寿旗扬
张 红,毛伟业,刘 霞,金 璐,李圣宇,傅惠英, *,寿旗扬, *
人参内生真菌强壮土赤壳菌RSA2004中抗乳腺癌活性化合物的分离鉴定
张 红1,毛伟业2,刘 霞1,金 璐1,李圣宇1,傅惠英1, 2*,寿旗扬1, 2*
1. 浙江中医药大学附属第二医院,浙江 杭州 310005 2. 浙江中医药大学药学院,浙江 杭州 310053
研究人参内生真菌强壮土赤壳菌RSA2004次生代谢产物的化学成分,以期发现具有抗乳腺癌活性的化合物。该菌大米固体发酵的95%乙醇水提取物经硅胶、Sephadex LH-20凝胶及HPLC等多种柱色谱技术进行分离纯化,并根据核磁共振、质谱、圆二色谱(electronic circular dichroism,ECD)、计算ECD等手段鉴定化合物的结构,采用MTT法评价化合物对乳腺癌细胞MDA-MB-231的细胞毒性。从人参内生真菌强壮土赤壳菌RSA2004发酵产物中分离得到4个化合物,分别鉴定为强壮土赤壳菌内酰胺A(1)、根赤壳菌素(2)、单青霉素I(3)和单青霉素IV(4)。活性测试结果表明化合物1和3对乳腺癌细胞MDA-MB-231的增殖有显著的抑制活性,半数抑制浓度为(9.37±3.1)(5.13±2.5)μmol/L。化合物1为新的生物碱类化合物,命名为强壮土赤壳菌内酰胺A;化合物1和3对MDA-MB-231细胞增殖有较强的细胞毒性。
人参;内生真菌;次生代谢产物;生物碱;抗乳腺癌活性;强壮土赤壳菌内酰胺A;单青霉素I
乳腺癌是当前威胁女性生命健康的主要难治疾病之一,2020年世界卫生组织国际癌症研究机构(International Agency for Research on Cancer)最新数据显示,全球乳腺癌新增人数达226万,在女性癌症中发病率跃居第1[1],死亡率跃居第5[1]。临床中,手术和化学药物是治疗乳腺癌的主要手段,但存在个体差异、耐药性、不良反应大等问题,寻找并开发新作用模式且不良反应低的抗癌药物一直是药物研发领域的热点与难点。在1981—2019年被FDA批准的抗肿瘤药物中,64.9%的药物源于天然药物[2],天然药用成分具有不良反应小、适合长期服用等特点。
植物来源的抗乳腺癌天然药物临床上应用广泛,但植物资源有限,仅围绕植物去开发药用活性成分,很难满足人类对医药的需求。植物内生真菌与植物互利共生[3],一些定殖在植物体内的真菌发挥着重要的生态功能,并对植物次生代谢物的形成起着重要的调控作用[4]。20世纪初,从红豆杉var.(Pilger) Florin中得到能产紫杉醇的内生真菌[5]开始,医药研究者们发现植物内生真菌是人类寻找药用活性成分的重要来源。此外,随着分子生物学、生物信息学、系统生物学等新兴交叉学科的飞速发展,发现内生真菌来源的天然产物的研究有着巨大的开发潜力。
目前,专家学者们已对近千种药用植物的内生真菌进行了研究。植物内生真菌被认为是潜在的产生新颖活性次生代谢产物的来源,产生了有抗肿瘤、抗病原微生物、抗艾滋病病毒(human immunodeficiency virus,HIV)和杀虫等活性的多种新颖骨架的化合物[6-9]。人参C. A. Meyer是五加科人参属多年生草本植物,《神农本草经》记载:“主补五脏,安精神,定魂魄,止惊悸,除邪气,明目,开心益智,久服轻身延年”,药用价值极高。人参主要化学成分有皂苷、多糖、挥发油、生物碱、黄酮类和甾醇类等[10]化合物,人参皂苷和人参多糖是从植物人参提取的主要药理活性成分,具有抗肿瘤、抗心肌缺血、提高免疫力、降血糖、抗衰老等作用[11]。国内外学者对人参开展了大量研究,主要聚焦于化学成分及药理作用、内生菌多样性及可利用菌株筛选[12]、人参质量标准[13]等方面。人参种植品被批准为新资源食品[14],人参根的价值取决于它们的大小、形状和整体外观[15],在4~6年的田间耕作中,根系易受多种土传病害的侵袭,红皮病、锈腐病、菌核病是人参栽培中最常见和最严重的问题,所以对人参内生真菌的深入研究是很有必要的。
本研究对人参根部分离出的一株强壮土赤壳菌RSA2004进行次生代谢产物的研究。强壮土赤壳菌广泛分布于木本和草本植物的根内[16],属于腐生真菌或弱寄生真菌。该属真菌代谢产物类型丰富、代谢途径多样,常见的代谢产物有聚酮、大环内酯和萜类等,具有抗肿瘤、抗菌等生物活性。对强壮土赤壳菌RSA2004进行大米固体发酵,95%乙醇水超声提取得到总浸膏,综合利用硅胶柱、凝胶Sephadex LH-20等柱色谱和HPLC制备等方法对其进行分离纯化,通过核磁共振谱和圆二色谱(electronic circular dichroism,ECD)等光谱技术鉴定,从该菌中得到4个化合物,分别鉴定为强壮土赤壳菌内酰胺A(robusta A,1)、根赤壳菌素(radicicol,2)、单青霉素I(monocillin I,3)和单青霉素IV(monocillin IV,4)。其中化合物1为新的生物碱类化合物,进一步采用MTT法测定分离化合物对乳腺癌MDA-MB-231细胞增殖的抑制活性,化合物1和3对MDA-MB-231细胞增殖有较强的细胞毒性,半数抑制浓度(half maximal inhibitory concentration,IC50)分别为(9.37±3.10)(5.13±2.50)μmol/L。
1 仪器与材料
1.1 仪器
LDZX-40B1型蒸汽灭菌锅(上海申安器械厂),MJ-2502-I型真菌培养箱(上海一恒科学仪器有限公司),ZHWY211B型摇床(上海智城分析仪器制造有限公司),Agilent 1260型液相色谱仪(美国Agilent公司),YMC C18色谱柱(250 mm×10 mm,5 μm;博纳艾杰尔科技有限公司),Bruker AV III-600型核磁共振波谱仪(德国Bruker公司),UV-2401A型紫外分光光度计(日本岛津股份有限公司),Nicolet IS50光谱仪(美国赛默飞世尔科技有限公司),JASCO J-810型圆二色光谱仪(日本分光株式会社),Waters SYNAPT G2-Si质谱仪(美国沃特世科技有限公司),CYTATION多功能酶标仪(美国BioTek公司)。
1.2 试剂与材料
马铃薯葡萄糖琼脂培养基(PDA,杭州百思生物技术有限公司),马铃薯葡萄糖培养基(PDB,杭州百思生物技术有限公司),柱色谱硅胶(100~200、300~400目,青岛海洋化工产),Sephadex LH-20葡聚糖凝胶(日本GE医疗集团),色谱级色谱甲醇和乙腈(美国Tedia公司),分析纯乙醇、石油醚、醋酸乙酯、甲醇(广东光华科技有限公司),磷酸盐缓冲溶液和四甲基偶氮唑盐(PBS和MTT,上海麦克林生化科技有限公司),顺铂(批号170701,国药准字H20040813,上海源叶生物科技有限公司)。
1.3 菌株来源
本研究所用菌株为2020年9月从吉林长白山区5年生园参C. A. Meyer植物根茎中分离所得,由浙江天科高新技术发展有限公司王庭璋副研究员鉴定为人参内生真菌强壮土赤壳菌(GenBank序列号CBS 308.35),储存于浙江中医药大学第二临床医学院中心实验室。
2 方法与结果
2.1 菌株发酵
将活化后的强壮土赤壳菌挑取少量菌丝,均匀接种到装有PDB的锥形瓶中,在恒温培养摇床中培养3天(28 ℃、130 r/min),得到菌株种子液。将等量种子液接种至无菌大米培养基(80 g/瓶)中,共培养50瓶,室温下发酵40 d,得到固体发酵物55 g。
2.2 菌株发酵物分离
发酵物用95%乙醇水提取3次,合并提取液并浓缩得到粗提物55 g。粗提物经硅胶柱色谱,石油醚-醋酸乙酯(100∶0~0∶1)梯度洗脱,经HPLC分析后合并,共得到5个组分(Fr. 1~5)。Fr. 3(100∶10部分,15.3 g)经凝胶Sephadex LH-20(二氯甲烷-甲醇1∶1)柱分离,得到7个组分Fr. 3.1~3.7。Fr. 3.6经过半制备型 HPLC(YMC C18柱,95%甲醇-水洗脱,体积流量2.5 mL/min)分离纯化,得到化合物1(R=30.5 min,14.1 mg);Fr. 3.3经过半制备型 HPLC(YMC C18柱,26%乙腈-水洗脱,体积流量2.5 mL/min)分离纯化,得到化合物2(R=19.5 min,4.5 mg)、3(R=24.1 min,7.0 mg)。Fr. 3.4经过半制备型HPLC(YMC C18柱,70%甲醇-水洗脱,体积流量2.5 mL/min)分离纯化,得到化合物4(R=25.3 min,12.6 mg)。
2.3 结构鉴定
化合物1:白色针状结晶(甲醇),HR-ESI-MS/: 552.308 7 [M+Na]+(计算值552.309 0),结合1H-NMR和13C-NMR谱,确定化合物1的分子式为C34H43NO4,不饱和度为14。化合物1的1H-NMR(表1)显示有4个部分重叠的芳香氢信号(H6.78, 7.02~7.05)、1个连氧次甲基信号(H4.52)、6个甲基氢信号(H0.93, 0.94, 1.07, 1.23, 1.52和1.80) 和9个次甲基信号(H1.05, 1.56, 1.70, 1.90, 2.05, 2.22, 2.82, 3.16和3.40)。13C-NMR谱显示有34个碳信号,其中10个芳香碳信号、2个羰基碳信号(C173.1和201.2) 和1个连氧碳信号(C87.3),结合DEPT和HSQC谱,显示有与上述质子信号对应的9个次甲基(C31.3, 32.3, 42.4, 44.0, 48.4, 53.4, 55.4, 55.6和57.7)、4个亚甲基(C34.7, 40.2, 45.1和46.7)、6个甲基信号(C14.5, 15.6, 19.0, 20.1, 22.6和27.8)和2个季碳信号(C53.2和88.8)。根据其1H-1H COSY相关信号,存在3个自旋系统,分别为H-7/H-8/H-9/H-10/H3-24/H-11/H-12/H3-25/H-13/H-14/H-15/H-16,H-1/H3-20和H-3/H3-21;据其HMBC相关信号,甲基H3-20与C-1、C-2、C-5和C-6相关,H3-21与C-1相关,H3-22与C-3、C-4、C-5和C-16相关,以及H3-23与C-5、C-6和C-7相关,可以构建1的6/5/6/5四环骨架;H2-1与C-18 (C55.4)、C-2(C88.8) 和C-19 (C173.1) 相关,H-18与C-1(C34.7)、C-2和C-19相关,结合这几个碳的化学位移和结构中含有1个原子表明存在-内酰胺片段;H2-3与C-1、C-2、C-4和C-5的相关信号表明,1,4-二取代的芳环通过亚甲基 (C-3,C46.7) 连接到-内酰胺片段;H-14与C-7的相关信号,以及去屏蔽的C-14 (C87.3) 和C-7(C160.5),表明C-14和C-7通过氧原子连接;然后,H-16与C-17/C-18和H2-1与C-17/C-18的相关性进一步证实了1个不寻常的13元大环与四环系统融合。对NMR数据的综合分析表明,除了1中-内酰胺上C-18和C-1的双键还原,化合物1类似于ascomylactam B[17],因此,确定了化合物1的平面结构,见图1。

表1 化合物1的NMR数据(600/150 MHz, CDCl3)

图1 化合物1的结构及主要HMBC、1H-1H COSY和ROESY相关
在ROESY谱(图1)中,H-14/H-6、H-6/H-16、H-16/H-7、H-7/H-13、H-16/H3-22、H3-22/H3-20、H3-25/H-6′、H3-25/H-11a和H-11a/H3-24的相关表明这些基团是共面的,H-15/H-8′、H-8′/H-19和 H-15/H-8相关表明这些质子位于化合物平面的另一侧。此外,H-14/H-6′、H3-25/H-6′、H-1′/H-9′、H-1′/H-8′和H-15/H-8′的相关性表明,1的限制旋转的苯环和-内酰胺部分几乎平行取向,该片段与化合物ascomylactam B[17]相同,可确定化合物1中的2′相对构型。通过计算ECD的方法对化合物1的绝对构型进行确证,采用TDDFT和B3LYP/6-311++G (2d, p) 法对化合物1进行ECD计算,1的实验ECD光谱在230 nm和315 nm处显示出负Cotton效应,在275 nm处显示正Cotton效应,这与计算的结果非常一致(图2)。因此,1的绝对构型确定为1、4、7、8、10、12、13、14、15、16、18和2′。经检索化合物为1个新化合物,命名为强壮土赤壳菌内酰胺A
化合物2:白色粉末(甲醇),分子式C18H17O6Cl;1H- NMR (600 MHz, DMSO-6): 10.57 (1H, brs, 16-OH), 10.02 (1H, brs, 14-OH), 7.15 (1H, dd,= 15.9, 9.8 Hz, H-8), 6.53 (1H, s, H-15), 6.08 (1H, t,= 9.8 Hz, H-7), 5.95 (1H, d,= 15.9 Hz, H-9), 5.90 (1H, dd,= 9.8, 3.0 Hz, H-6), 5.17 (1H, m, H-2), 4.98 (1H, d,= 16.5 Hz, H-11a), 4.65 (1H, d,= 16.5 Hz, H-11b), 4.44 (1H, m, H-5), 3.46 (1H, m, H-4), 2.00 (1H, m, H-3a), 1.61 (1H, m, H-3b), 1.34 (3H, d,= 6.7 Hz, H3-1);13C-NMR (150 MHz, DMSO-6): 196.3 (C-10), 167.1 (C-18), 156.0 (C-16), 155.8 (C-14), 144.6 (C-8), 138.7 (C-12), 133.4 (C-6), 130.3 (C-9), 125.1 (C-7), 114.3 (C-13), 113.1 (C-17), 103.1 (C-15), 71.2 (C-2), 69.9 (C-4), 68.1 (C-5), 42.7 (C-11), 38.8 (C-3), 21.1 (C-1);以上数据与文献报道一致[18],故鉴定化合物2为根赤壳菌素。
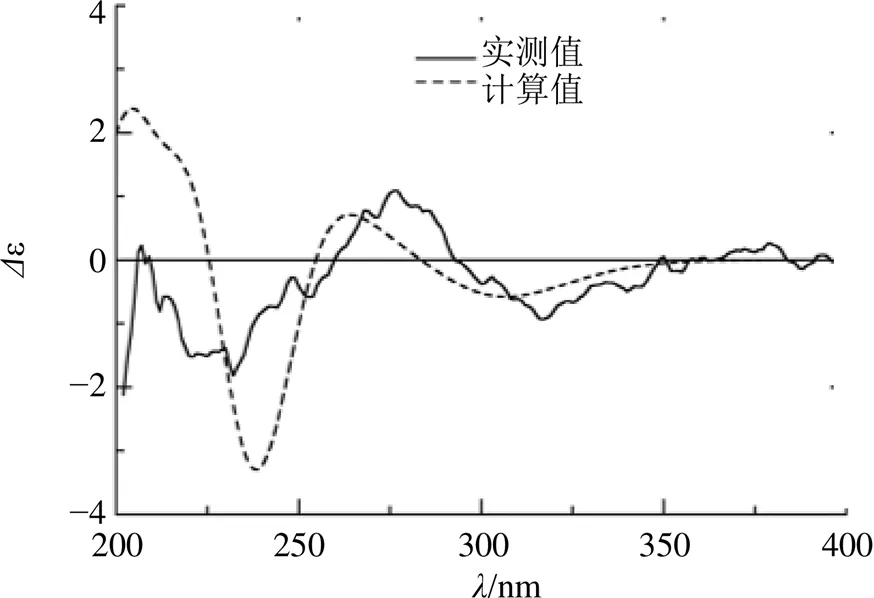
图2 化合物1的实测与计算ECD谱图
化合物3:无色油状物(甲醇),分子式C18H18O6;1H-NMR (600 MHz, DMSO-6): 10.94 (1H, brs, 16-OH), 9.16 (1H, brs, 14-OH), 7.57 (1H, dd,= 16.1, 11.3 Hz, H-8), 6.35 (1H, dd,= 11.3, 10.7 Hz, H-7), 6.20 (1H, d,= 2.7 Hz, H-15), 6.05 (1H, d,= 2.7 Hz, H-13), 5.82 (1H, d,= 16.1 Hz, H-9), 5.83 (1H, dd,= 10.7, 2.7 Hz, H-6), 5.49 (1H, ddq,= 3.7, 3.7, 6.7 Hz, H-2), 4.97 (1H, d,= 14.0 Hz, H-11a), 3.56 (1H, d,= 14.0 Hz, H-11b), 3.52 (1H, q,= 2.7 Hz, H-5), 3.14 (1H, dt,= 8.5, 2.7 Hz, H-4), 2.38 (1H, m, H-3a), 1.66 (1H, m, H-3b), 1.43 (3H, d,= 6.7 Hz, 1-CH3);13C-NMR (150 MHz, DMSO-6): 198.4 (C-10), 167.7 (C-18), 160.3 (C-16), 158.8 (C-14), 140.4 (C-8), 112.0 (C-12), 137.5 (C-6), 131.6 (C-9), 130.3 (C-7), 101.9 (C-13), 112.0 (C-17), 106.6 (C-15), 69.7 (C-2), 55.8 (C-4), 54.8 (C-5), 42.4 (C-11), 36.5 (C-3), 19.1 (C-1)。以上数据与文献报道一致[18],故鉴定化合物3为单青霉素I。
化合物4:白色结晶(甲醇),分子式C18H22O5;1H-NMR (600 MHz, DMSO-6): 10.71 (1H, brs, 16-OH), 10.11 (1H, brs, 14-OH), 6.23 (1H, d,= 2.4 Hz, H-15), 6.11 (1H, d,= 2.4 Hz, H-13), 5.41 (2H, m, H-4, 5), 5.13 (1H, m, H-2), 3.87 (1H, d,= 14.0 Hz, H-11a), 3.68 (1H, d,= 14.0 Hz, H-11b), 2.41 (1H, m, H-3a), 2.24 (1H, m, H-3b), 2.38 (2H, m, H2-9), 2.00 (2H, m, H-6), 1.50 (2H, m, H2-8), 1.40 (2H, m, H2-7), 1.29 (3H, d,= 6.3 Hz, 1-CH3);13C-NMR (150 MHz, DMSO-6): 207.8 (C-10), 169.7 (C-18), 161.6 (C-16), 161.3 (C-14), 137.7 (C-12), 133.9 (C-5), 126.2 (C-4), 111.0 (C-13), 109.1 (C-17), 102.0 (C-15), 72.2 (C-2), 48.2 (C-11), 40.9 (C-9), 38.0 (C-3), 31.9 (C-6), 25.7 (C-7), 22.7(C-8), 19.8 (C-1)。以上数据与文献报道一致[19],故鉴定化合物4为单青霉素IV。
2.4 活性测试
采用MTT法对得到的化合物进行抗乳腺癌的活性评价,以顺铂为阳性药,具体的细胞毒性实验操作参考文献方法[20]。数据分析显示化合物1和3对MDA-MB-231细胞增殖具有显著的抑制活性,其IC50分别为(9.37±3.10)、(5.13±2.50)μmol/L,活性强于阳性对照药顺铂[IC50为(11.3±0.6)μmol/L],其余化合物对MDA-MB-231细胞增殖的抑制活性较弱,在初筛50 μmol/L下,抑制率低于50%。
3 讨论
植物内生真菌的次生代谢产物在抗菌、抗肿瘤和抗氧化等生物活性方面展现出较好的应用潜力,是新药发现的潜在资源。本实验对人参内生真菌强壮土赤壳菌 RSA2004的次生代谢产物的化学成分进行研究,运用多种分离纯化和鉴定技术,从强壮土赤壳菌RSA2004中得到十三元大环生物碱类新化合物1和芳香聚酮类化合物2~4。经抗乳腺癌活性筛选,化合物1和3对MDA-MB-231细胞株增殖有显著的抑制活性。本研究丰富了对强壮土赤壳菌次生代谢产物的认识,且对十三元大环和四环聚合的大环生物碱类化合物的抗乳腺癌活性值得进一步深入研究,可为人参内生真菌资源的合理开发应用做出积极贡献。
利益冲突 所有作者均声明不存在利益冲突
[1] Sung H, Ferlay J, Siegel R L,. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2021, 71(3): 209-249.
[2] Newman D J, Cragg G M. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019 [J]., 2020, 83(3): 770-803.
[3] Fadiji A E, Babalola O O. Elucidating mechanisms of endophytes used in plant protection and other bioactivities with multifunctional prospects [J]., 2020, 8: 467.
[4] Kudo R, Masuya H, Endoh R,. Gut bacterial and fungal communities in ground-dwelling beetles are associated with host food habit and habitat [J]., 2019, 13(3): 676-685.
[5] Strobel G, Stierle A, Stierle D,., a proposed new taxon for a bulbilliferous hyphomycete associated with Pacific yew () [J]., 1993, 47(71): 71-80.
[6] Singh A, Singh D K, Kharwar R N,. Fungal endophytes as efficient sources of plant-derived bioactive compounds and their prospective applications in natural product drug discovery: Insights, avenues, and challenges [J]., 2021, 9(1): 197.
[7] Chen G D, Zhao B X, Huang M J,. Tripodalsporormielones A-C, unprecedented cage-like polyketides with complex polyvdent bridged and fused ring systems [J]., 2021, 11(11): 3648-3654.
[8] Wu T Z, Salim A A, Capon R J. Millmerranones A-F: A meroterpene cyclic carbonate and related metabolites from the Australian fungussp. CMB-MRF324[J]., 2021, 23(21): 8424-8428.
[9] Xu K, Li R J, Zhu R X,. Xylarins A-D, two pairs of diastereoisomeric isoindoline alkaloids from the endolichenic fungussp [J]., 2021, 23(20): 7751-7754.
[10] Razgonova M P, Veselov V V, Zakharenko A M,.components and the pathogenesis of Alzheimer’s disease (Review) [J]., 2019, 19(4): 2975-2998.
[11] Mancuso C, Santangelo R.and: From pharmacology to toxicology [J]., 2017, 107(Pt A): 362-372.
[12] 张亚光, 张艳欣, 高崎. 人参内生真菌群落结构及其与有效成分相关性分析[J]. 人参研究, 2021, 33(3): 2-8.
[13] 陈小玲, 司函瑞,付东兴, 等. 人参三醇组皂苷质量标准的初步研究 [J]. 特产研究, 2022, 44(1): 20-28.
[14] 中国药典 [S]. 一部. 2020: 8.
[15] Zhou Y, Yang Z M, Gao L L,. Changes in element accumulation, phenolic metabolism, and antioxidative enzyme activities in the red-skin roots of[J]., 2017, 41(3): 307-315.
[16] Chaverri P, Salgado C, Hirooka Y,. Delimitation ofand(Nectriaceae, Hypocreales, Ascomycota) and related Genera with-like anamorphs [J]., 2011, 68: 57-78.
[17] Chen Y, Liu Z M, Huang Y,. Ascomylactams A-C, cytotoxic 12- or 13-membered-ring macrocyclic alkaloids isolated from the mangrove endophytic fungussp. CYSK-4, and structure revisions of phomapyrrolidones A and C [J]., 2019, 82(7): 1752-1758.
[18] Shinonaga H, Noguchi T, Ikeda A,. Synthesis and structure-activity relationships of radicicol derivatives and WNT-5A expression inhibitory activity [J]., 2009, 17(13): 4622-4635.
[19] Gao J T, Radwan M M, León F,.sp.-derived resorcylic acid lactones withbinding affinity for human opioid and cannabinoid receptors [J]., 2013, 76(5): 824-828.
[20] 胡永, 段玉书, 苑春茂, 等. 艾纳香中1个新倍半萜内酯及其细胞毒活性研究 [J]. 中草药, 2019, 50(14): 3274-3278.
Isolation and identification of compounds with anti-breast cancer activity in endophytic fungusRSA200g
ZHANG Hong1, MAO Wei-ye2, LIU Xia1, JIN Lu1, LI Sheng-yu1, FU Hui-ying1, 2, SHOU Qi-yang1, 2
1.The Second Clinical Medical College & Second Affiliated Hospital, Zhejiang Chinese Medical University, Hangzhou 310005, China 2. Pharmacy Division of Zhejiang Chinese Medical University, Hangzhou 310053, China
To study the secondary metabolites of the endophytic fungusRSA2004 fromin order to obtain compounds with anti-breast cancer activity.The 95% ethanol extracts from the solid fermentation of rice were separated and purified by silica gel, Sephadex LH-20 gel and HPLC. The structures of the compounds were determined by NMR, mass spectrometry, circular dichroism, computational circular dichroism, etc. MTT experiment was used to evaluate the cytotoxicity of the compounds to breast cancer cell line MDA-MB-231.Four compounds were isolated and identified from the fermentation products of the endophytic fungusRSA2004, which were identified as robusta A (1), radicicol (2), monocillin I (3), and monocillin IⅤ (4). The activity test results showed that compounds 1 and 3 had significant inhibitory activity on breast cancer cell line MDA-MB-231 with the IC50values of (9.37±3.1) μmol/L and (5.13±2.5) μmol/L.Compound 1 is a new alkaloid compound named robusta A. Compounds 1 and 3 have strong cytotoxicity on the proliferation of MDA-MB-231 cells.
C. A. Meyer; endophytic fungi; secondary metabolites; alkaloids; anti-breast cancer activity; robusta A;monocillin I
R284.1
A
0253 - 2670(2023)12 - 3771 - 06
10.7501/j.issn.0253-2670.2023.12.003
2023-03-28
浙江省医药卫生科技计划项目(2023KY880)
张 红(1988—),女,助理研究员,主要从事中药及中药内生菌活性成分的研究。Tel: 15305187672 E-mail: zhanghong_16@126.com
通信作者:寿旗扬,研究员,博士生导师。Tel: (0571)86613569 E-mail: sqy133@126.com
傅惠英,研究员。Tel: (0571)86633010 E-mail: fhy131@126.com
[责任编辑 王文倩]
