胰十二指肠切除术后发生临床胰瘘的相关危险因素分析
2023-06-16储伟丁莉莉金慧莉
储伟,丁莉莉,金慧莉
复旦大学附属华山医院东院胰腺外科,上海 200120
胰十二指肠切除(pancreaticoduodenectomy,PD)术为胰腺炎、胆总管占位病变等胰腺、肝胰壶腹周围疾病的常见术式,为目前临床最复杂、涉及脏器最多、手术区域解剖结构最复杂的普外科手术之一[1]。传统开腹PD 术术中创伤大、术后并发症发生率及死亡率高,但随着医疗技术的发展,腹腔镜、超声刀、数字智能化系统等微创技术逐步应用于肝胆胰外科手术中,PD 术式得到改进,安全性显著提高,死亡率显著降低[2]。但由于术中涉及脏器种类较多、范围较广、吻合难度大故并发症发生风险仍较大。胰瘘为PD术后主要并发症之一,胰液流至腹腔可腐蚀腹腔脏器,还可为细菌增殖提供条件,增加术后感染和出血发生风险,部分患者还可继发败血症导致死亡[3]。因此,本研究旨在分析PD 术后胰瘘发生的相关危险因素,现报道如下:
1 资料与方法
1.1 一般资料 回顾性分析2020 年6 月至2022年3月期间于复旦大学附属华山医院东院胰腺外科行PD术的110例患者的临床资料。(1)纳入标准:①于我院行PD 术,PD 术适应证,术前经检查怀疑为十二指肠恶性肿瘤、壶腹周围癌、胆总管下段癌、胰头癌、胰头炎合并梗阻等;②临床资料完整;③行腹腔镜PD术。(2)排除标准:①既往合并胰腺手术史者;②既往有恶性肿瘤病史;③合并免疫缺陷疾病者;④PD术禁忌证:如胰头癌已侵犯主要血管,癌症已合并肝肾等其余器官转移。(3)胰瘘诊断标准:接受PD术3 d后吻合口依然可引流出液体,且液体经检测可见淀粉酶含量为正常血清水平的三倍以上,经影像学检查可见瘘管[4]。依据患者术后是否并发胰瘘,将术后7 d内继发胰瘘的32例患者纳入胰瘘组,将术后未继发胰瘘的78例患者纳入无胰瘘组。胰瘘组患者病变位于胰腺患者的比例高于非胰瘘组,差异有统计学意义(P<0.05),但两组患者的年龄等一般资料比较差异均无统计学意义(P>0.05),见表1。
表1 两组患者的一般资料比较[例(%),±s]Table 1 Comparison of general data between the two groups[n(%),±s]
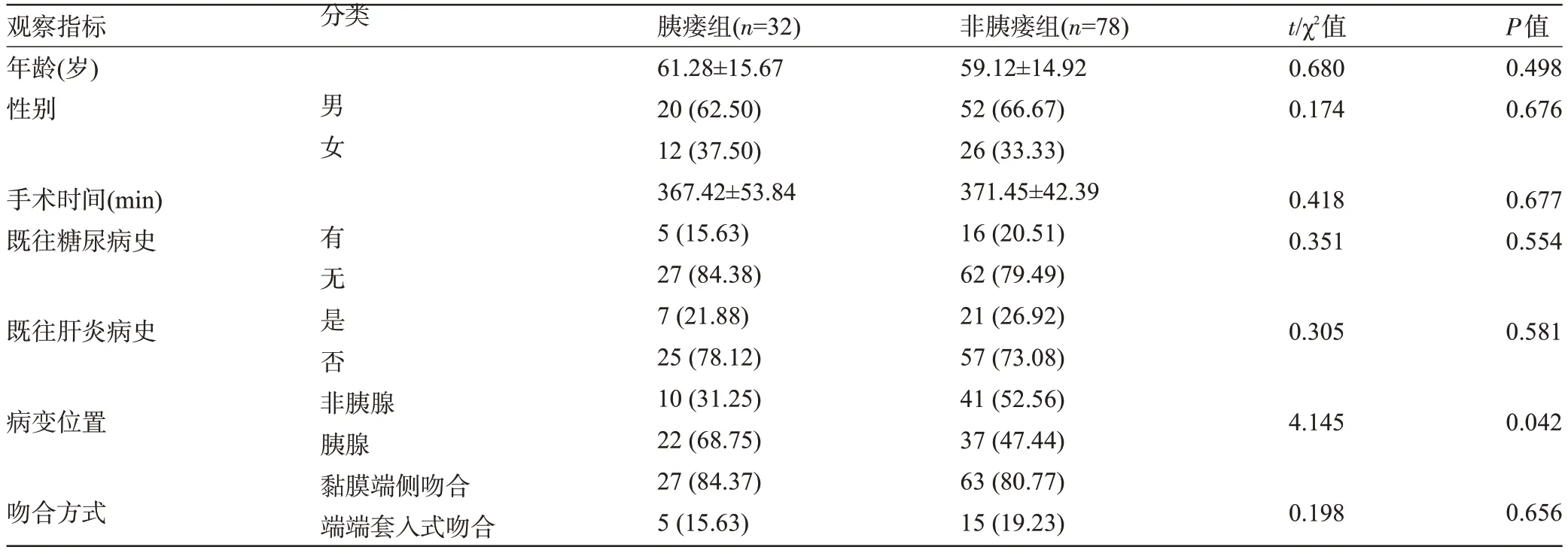
表1 两组患者的一般资料比较[例(%),±s]Table 1 Comparison of general data between the two groups[n(%),±s]
观察指标年龄(岁)性别分类t/χ2值0.680 0.174男女 有无是否胰瘘组(n=32)61.28±15.67 20(62.50)12(37.50)367.42±53.84 5(15.63)27(84.38)7(21.88)25(78.12)10(31.25)22(68.75)27(84.37)5(15.63)非胰瘘组(n=78)59.12±14.92 52(66.67)26(33.33)371.45±42.39 16(20.51)62(79.49)21(26.92)57(73.08)41(52.56)37(47.44)63(80.77)15(19.23)P值0.498 0.676手术时间(min)既往糖尿病史0.418 0.351 0.677 0.554既往肝炎病史0.305 0.581病变位置4.145 0.042吻合方式非胰腺胰腺黏膜端侧吻合端端套入式吻合0.198 0.656
1.2 手术方法 所有患者均给予腹腔镜下PD术,术前完善血常规、CT等相关检查,合并梗阻性黄疸的患者需接受减黄治疗,患者平卧于手术台上,统一采取静脉全麻,全麻生效后留置颈内静脉导管,建立气腹后先放置入腹腔镜,于患者肚脐下方做一12 mm切口,置入12 mm 管状通道(Trocar),腹腔镜从此处置入,另做两个操作孔,切口分别位于右锁骨中线与肚脐水平线交点的上方2 cm处、右侧腋前线与肋骨下缘交点下1 cm处,分别置入10 mm和12 mm Trocar,于腹腔镜下进行探测腹腔,根据探查及术前影像学检查结果,使用超声刀显露胰腺表面,暴露肠系膜上静脉,离断相关韧带,切断空肠,切除远端胃、胰腺、胆囊,离断肝总管,切除胆囊,过程中注意结扎肝总动脉等血管,清扫淋巴结,切除完毕后冲洗腹腔,重新建立气腹进行常规消化道重建,于胆管-肠管吻合后方、胰肠吻合前方放置引流管并固定,撤出腹腔镜等设备后逐层关闭腹腔完成手术。
1.3 观察指标与检测方法 (1)影像学表现:行腹部B超(品牌:贝尔斯;型号:BLA-860)检测腹部总脂肪、腹壁脂肪。行CT(品牌:飞利浦;型号Brilliance)检查胰管直径,术中具有丰富经验的肝胆胰外科临床医生结合术中观察情况及CT检测结果评估胰腺质地。比较两组患者腹部总脂肪、腹壁脂肪、胰腺质地。(2)实验室指标:抽取患者术前3 d时空腹的外周血液,经离心后收集上层清液,采用J-G 法检测血清总胆红素(TBiL)水平,采用BCG法检测白蛋白(Alb)水平,采用电化学发光法检测术前降钙素原(PCT)。比较两组患者的术前TBiL、Alb、PCT水平。
1.4 统计学方法 应用SPSS20.0 统计学软件进行数据统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验,计数资料比较采用χ2检验,采用非条件Logistic多元逐步回归分析PD术后胰瘘的相关因素。以P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者的影像学表现比较 胰瘘组患者的腹部总脂肪、腹壁脂肪、胰腺软质地比例明显高于非胰瘘组,差异均有统计学意义(P<0.05),见表2。
表2 两组患者的影像学表现比较[例(%),±s]Table 2 Comparison of the imaging findings between the two groups[n(%),±s]
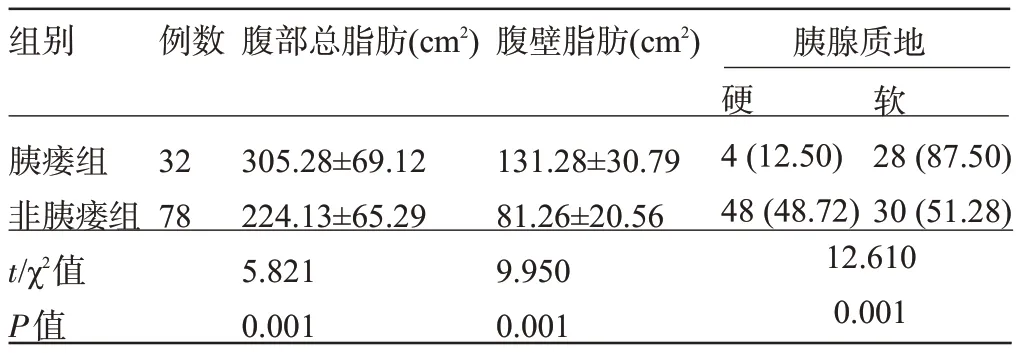
表2 两组患者的影像学表现比较[例(%),±s]Table 2 Comparison of the imaging findings between the two groups[n(%),±s]
组别例数腹部总脂肪(cm2)腹壁脂肪(cm2)胰腺质地硬软胰瘘组非胰瘘组t/χ2值P值32 78 305.28±69.12 224.13±65.29 5.821 0.001 131.28±30.79 81.26±20.56 9.950 0.001 4(12.50)48(48.72)28(87.50)30(51.28)12.610 0.001
2.2 两组患者的术前实验室指标比较 胰瘘组患者的术前TBiL、术前PCT 水平明显高于非胰瘘组,术前Alb 水平明显低于非胰瘘组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者的术前实验室指标比较(±s)Table 3 Comparison of laboratory test indexes between the two groups(±s)
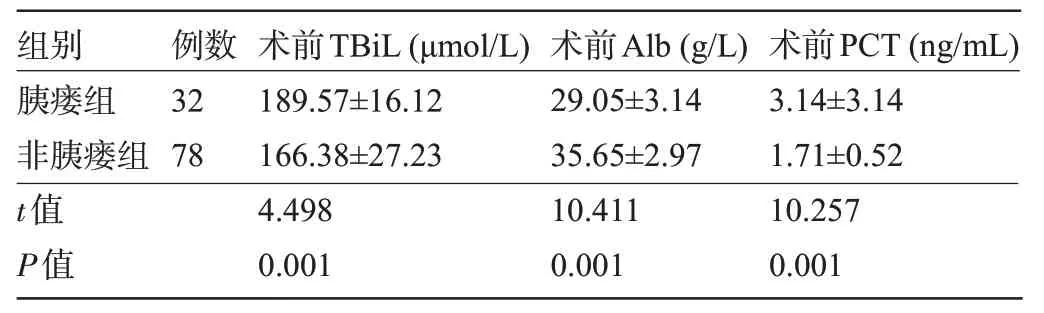
表3 两组患者的术前实验室指标比较(±s)Table 3 Comparison of laboratory test indexes between the two groups(±s)
组别胰瘘组非胰瘘组t值P值32 78 189.57±16.12 166.38±27.23 4.498 0.001 29.05±3.14 35.65±2.97 10.411 0.001 3.14±3.14 1.71±0.52 10.257 0.001例数术前TBiL(μmol/L)术前Alb(g/L)术前PCT(ng/mL)
2.3 导致PD 术后胰瘘的危险因素 经非条件Logistic 多元逐步回归分析结果显示,病变位置、腹部总脂肪、腹壁脂肪、胰腺质地、术前TBiL,PCT 水平均为导致PD 术后胰瘘的危险因素(P<0.05),而术前Alb为PD术后胰瘘的保护因素(P<0.05),见表4。
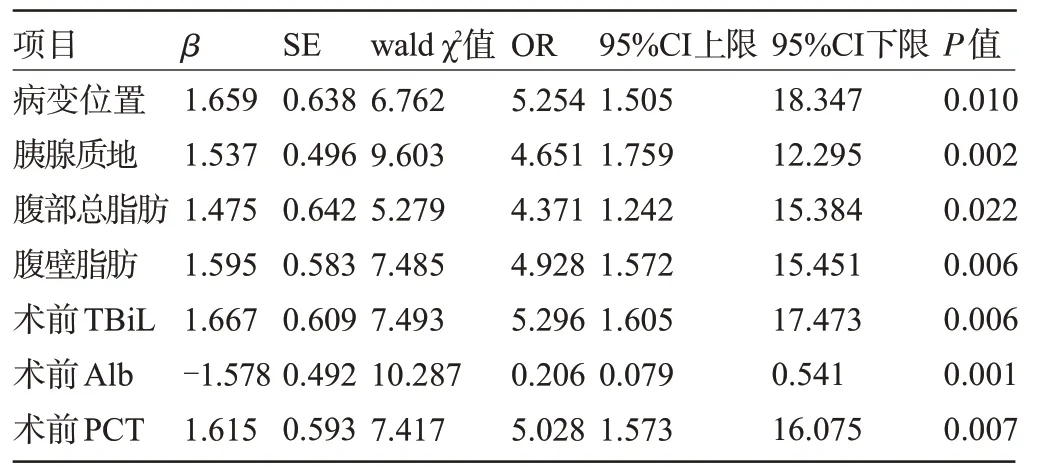
表4 导致PD术后胰瘘因素的非条件Logistic多元逐步回归分析Table 4 Multivariate Logistic stepwise regression analysis of factors leading to pancreatic fistula after pancreaticoduodenectomy
2.4 腹部总脂肪、腹壁脂肪、实验室指标对术后胰瘘的预测效能 经ROC分析结果显示,腹部总脂肪、腹壁脂肪、术前TBiL、术前Alb、术前PCT对PD术后胰瘘的预测效能良好(P<0.05),对应的Cut-off值分别为>233.96 cm2、>121.79 cm2、>173.7 μmol/L、≤32.70 g/L、>3.17 ng/mL,见图1、表5。
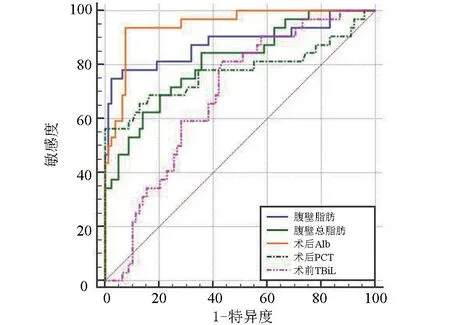
图1 ROC曲线Figure 1 ROC curves
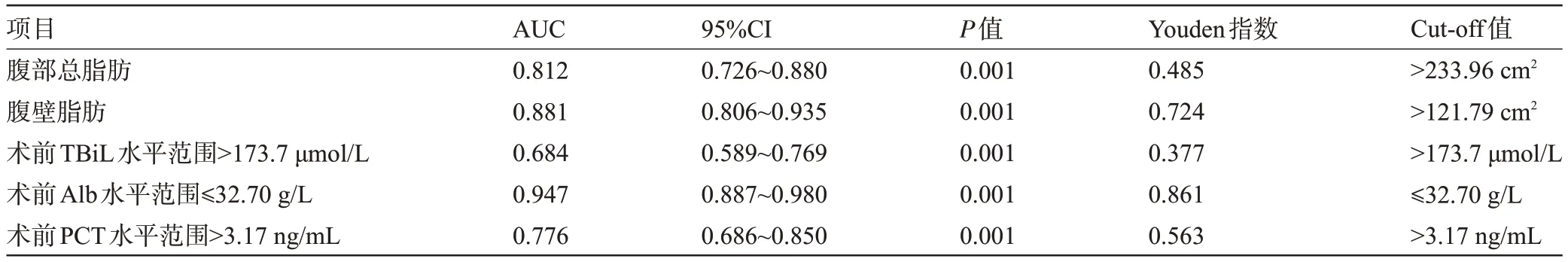
表5 ROC曲线参数Table 5 ROC curve parameters
3 讨论
PD 术中切除范围广泛,术后需进行消化道重建,要求手术医生具有丰富的经验和熟练的操作技术,为最复杂和难度最高的外科手术之一。但大量研究已证实其近远期疗效良好,故PD为目前临床胰腺、肝胰壶腹周围疾病的首选术式[5]。术后胰瘘为PD 术后常见并发症,分析PD 术后并发胰瘘的相关危险因素为临床研究热点。
既往研究显示,肥胖与高血脂等多种慢性疾病、手术并发症的发生与发展密切相关[6]。罗海峰等[7]研究结果提示BMI≥28 kg/m2的PD患者术后并发胰瘘风险较大。而PD 术后胰瘘的发生与胰腺坏死、胰液引流不畅等原因相关,故现认为患者胰腺基本情况也可成为PD 术后并发胰瘘的危险因素[8]。本研究结果显示当PD 患者腹部总脂肪>233.96 cm2、腹壁脂肪>121.79 cm2时,术前可并发胰瘘,上述腹部总脂肪、腹壁脂肪、胰腺质地、病变是否位于胰腺与PD患者术前胰瘘的发生明显相关,这表明腹部脂肪堆积较多、病变位于胰腺且胰腺质地更软的PD患者术后并发胰瘘的风险较大,与既往研究结果类似[9]。分析其原因为:(1)PD 术的切口位于腹部,腹部脂肪过度堆积可影响手术视野,增加腹腔探查难度,影响手术操作,且腹部脂肪层厚的患者难以完成术中脂肪分离。(2)病变位于胰腺则术中对胰腺的损伤更大,故术后并发胰瘘风险更高。(3)腹部脂肪堆积可导致胰腺脂肪浸润,脂肪过度浸润可导致胰腺质地较软,而软质地胰腺通常伴随小直径胰管,可增加术中胰管吻合难度,增加术中胰瘘发生风险。同时软质地胰腺腺泡数量较硬质地胰腺多,其外分泌功能保存良好,可促进腐蚀性酶的分泌,增加胰瘘发生风险[10]。但由于现今多为腹腔镜PD术,术中无法直接接触胰腺,胰腺软硬程度仅能在腹腔镜下观察胰腺形态等进行主观评估,且胰腺质地软硬缺乏统一评估标准,故其精确性有待考证。
患者基础身体状况、组织愈合能力、机体炎症水平同样为增加其并发症的危险因素,患者基础生理状况欠佳,免疫功能下降、体内炎症因子过度表达均可导致组织愈合缓慢,增加胰瘘发生风险。本研究结果显示,术前TBiL>173.7 μmol/L、术前Alb≤32.70 g/L、术前PCT>3.17 ng/mL 均可提示患者存在术前并发胰瘘风险,这表明术前TBiL、Alb、PCT均为导致PD患者并发胰瘘的危险因素,与既往研究结果类似[11]。分析其原因为:(1)术前TBiL水平过高可提示患者肝功能损伤严重,肝功能障碍可导致患者凝血因子低表达,凝血功能下降,增加术中止血和吻合难度,增加术后胰瘘发生风险。且肝功能损伤可影响胆汁的正常排泄,诱发胆道感染,增加术后胰瘘发生风险[12]。(2)Alb 为刺激组织修复、愈合的重要物质,Alb可通过调节胶体渗透压维持细胞膜通透性,若术中Alb 水平低下可导致吻合口局部水肿,还可延缓吻合口愈合,增加胰瘘发生风险[13]。(3)血清PCT 升高可提示机体存在炎症、感染,炎症刺激可导致炎性分泌物聚集,不仅可导致胶原过度溶解,还可局部细胞组织萎缩,阻碍吻合口愈合,增加胰瘘发生风险。
综上所述,胰腺质地、病变位置、腹部总脂肪、腹壁脂肪、术前TBiL、术前Alb、术前PCT均为导致PD患者术后并发胰瘘的独立危险因素,临床上应给予高度重视。
