人组织激肽释放酶在肝癌中的研究进展
2023-06-16程大伟综述郑军审校
程大伟 综述 郑军 审校
三峡大学第一临床医学院(宜昌市中心人民医院)肝胆胰外科三峡大学肝胆胰外科研究所,湖北 宜昌 443003
原发性肝癌是目前我国第四位常见恶性肿瘤及第二位肿瘤致死病因,它主要包括肝内胆管癌(ⅠCC)、肝细胞癌(HCC)和混合型(HCC-ⅠCC)三种常见的病理类型,以及两类罕见的肝母细胞瘤和纤维状肝细胞癌(FLC)[1-3]。目前作为肝癌筛查和诊治的肿瘤标志物有血清甲胎蛋白(alpha-fetoprotein,AFP)、异常凝血酶原(PⅠVKA-Ⅱ)[4-5],且PⅠVKA-Ⅱ对AFP 阴性的肝癌具有重要的诊断价值,可与AFP 互补,进而提高肝癌的早期诊断率[6]。虽然这些标志物为众多肝癌患者赢得了手术时机,但其依然有着较高的术后复发率。目前肝肿瘤的治疗方案已由过去的手术和传统化疗药物相结合的治疗方法演变成现在的以手术为主的综合治疗策略,辅以肝癌转化治疗、新辅助治疗、分子靶向药物和传统化疗药物相结合的综合治疗。于是肝癌的分子靶向治疗已成为近年来临床治疗方案中的新突破口,而探寻一个精准的分子靶点,是安全而有效治疗肝脏恶性肿瘤的关键。相关研究表明人组织激肽释放酶(human tissue kallikreins,KLKs)与肝癌的发生、发展、侵袭以及转移密切相关,可作为肝癌诊断、治疗以及预后判断的新型分子生物学靶点[7]。因此,本文就KLKs在肝癌中的表达调控、作用机理、化疗敏感性及预后评估价值方面进行综述,以期为肝癌的分子靶向治疗提供更精准的治疗决策。
1 KLKs家族基因介绍
20 世纪30 年代,由Kraut 等在胰腺组织中首次发现KLKs,KLKs 具有胰凝乳蛋白酶或胰蛋白酶的特性,是人类基因组中最大的具有连续性的丝氨酸蛋白水解酶亚群。KLKs 由14 种激肽释放酶相关肽酶(KLK2-KLK15)和人组织激肽释放酶(KLK1)组成,其编码基因存在于人类染色体的19q13.3-13.4 长臂上,长度为262 kbp,各成员之间的蛋白质水平、三级结构以及基因序列极为保守,分别编码出相对应的KLK1-KLK15 蛋白[8]。目前有关研究显示单个KLKs 基因的长度为4~10 kbp,其不仅结构排列紧密而且无假基因存在,KLK4与KLK5之间相邻最远,距离为32.5 kbp,而KLK1 与KLK15 之间相邻最近,二者仅间隔1.5 kbp[9]。着丝粒端与KLK1间有一个非KLKs基因—睾丸酸性磷酸酶(ACPT),末尾基因KLK14 与末尾基因KLK14 端粒端之间也存在一个非KLKs 基因—唾液酸结合性免疫球蛋白样凝集素9 (Siglec9) (图1)。KLKs基因编码序列由4个内含子和5个外显子组成,内含子相位高度保守,总是遵循Ⅰ~Ⅱ~Ⅰ~0的模式;外显子的长度和数量基本相似,其长度差异主要体现在内含子上;编码的丝氨酸蛋白酶均含保守的丝氨酸(Ser195)、天冬氨酸(Asp102)和三联体催化残基(组氨酸(His57)。此外,多数KLKs 基因会受到类固醇激素的调节,均有10~12 个半胱氨酸残基,理论上可形成5~6个二硫键。

图1 染色体19q13.4上人组织激肽释放酶基因位点示意图Figure 1 Schematic diagram of the human tissue kallikrein gene locus on chromosome 19q13.4
KLKs 有15 个成员(KLK1~KLK15),广泛表达于不同表达水平的各种组织中,参与细胞生长、组织重塑等一系列生理过程,虽然KLKs在人体中广泛表达,但由于其表达水平的显著差异,使KLKs 在不同部位或组织中产生不同的生理作用[10]。Koumandou等[11]发现,KLKs在肿瘤微环境中起着关键作用,与多类肿瘤的发生、发展、侵袭和转移密切相关,且部分KLKs 已被当作肿瘤标志物,应用于癌症的早期诊断、治疗方案的确立以及预后评估等临床实践中。临床上将KLK3作为前列腺癌的标志物,从而用于其筛查、诊疗及预后分析[12];KLK5 与口腔鳞状细胞癌的侵袭性相关[13];KLK5的蛋白表达水平与人胃腺癌的侵袭深度和淋巴结转移呈正相关,KLK5可以促进肿瘤细胞的迁移和侵袭,则KLK5 表达较高的患者总生存期较差[14];KLK6 是治疗卵巢癌的潜在靶点,也是评估卵巢癌不良预后的生物学标志物[15];KLK7 在结肠癌等恶性肿瘤的异常表达可促进肿瘤细胞在人体组织中的增殖与侵袭[16];此外,KLK13 在乳腺肿瘤和卵巢肿瘤的预后评判中亦是关键的生物学标志物,并且在预估胃癌细胞化疗敏感性方面也具有潜在的临床价值[17-18]。由此可见,KLKs与肿瘤的研究紧密相关。
2 KLKs对肝癌增殖、侵袭和转移的调控机制
随着学者对KLKs研究的不断深入,KLKs基因在肝癌的发生与发展中的作用也日渐受到研究者们的重视。相关研究表明,KLKs 的异常表达基本存在于所有的激素依赖性肿瘤和实体瘤中,KLKs 表达失调并借助不同的信号传导通路诱导肝肿瘤细胞的增殖、侵袭,进而促进肿瘤细胞的恶性转移[19-20]。如图2 所示,KLKs可通过以下方式促进肝癌的进展。
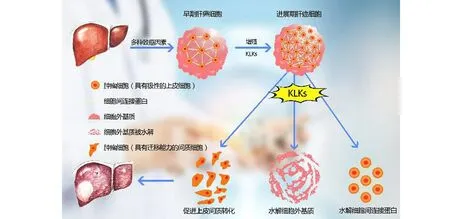
图2 KLKs促进肝癌细胞侵袭与转移的机制Figure 2 Mechanism of KLKs promoting invasion and metastasis of hepatocellular carcinoma cells
2.1 KLKs可通过蛋白酶激活受体通路介导肝癌细胞的增殖 蛋白酶激活受体(protease-activated receptor,PAR)作为细胞表面的G蛋白偶联受体,通过介导细胞外信号调节激酶的信号转导通路及传递信号,调控着多种肿瘤的发生与进展[21]。Michel等[22]研究证实,KLKs可激活癌细胞中的PAR,通过PAR通路介导肿瘤细胞的增殖作用。KLK6 可通过PAR2 依赖性表皮细胞生长因子受体的反式激活,从而促进癌细胞的增殖并抑制其凋亡,KLK6 也可以介导PAR1 信号通路,使多形性胶质细胞瘤的增殖能力增强[23]。
2.2 KLKs可通过介导生长因子通路调控肝癌细胞的增殖 生长因子(growth factor,GF)是一类由细胞分泌的信号分子,通过与细胞膜上的特异性受体结合来调节细胞的生长与分化。KLKs 可通过调节GF的活性和生物利用度,进而激活蛋白酶活化受体,从而调控着肿瘤细胞的增殖[24]。有关研究报道,KLK12通过水解细胞间的GF信号蛋白来调节成纤维细胞生长因子-2、转化生长因子-β1和血管内皮生长因子的活性,进而参与肿瘤细胞增殖的调控[25];Sano等[26]研究发现KLK11可水解大多数胰岛素样生长因子结合蛋白,通过促进活化的胰岛素样生长因子的释放来提高其生物利用度,进而在肝癌的发展中起着关键作用。此外,KLKs还可通过间接激活GF相关信号通路进而促进肝癌的恶性转化。Mukai等[27]通过免疫组化法探究了肝细胞生长因子(hepatocyte growth factor,HGF)特异性受体酪氨酸激酶MET (mesenchymal epithelial transition factor,MET)和KLK4的表达及磷酸化情况,结果显示KLK4可激活MET,间接将前体HGF分散因子转化为磷酸化的形式,进而促进肝癌的进展。
2.3 KLKs可通过调控雄激素受体促进肝癌细胞的增殖 在激素相关性肿瘤中,肿瘤细胞的增殖可受KLKs 活性调节的影响。Shang 等[28]研究发现,KLK2可通过雄激素受体(androgen receptor,AR)信号系统,与AR辅助调节因子ARA70相互结合从而诱导AR反式激活,进而促进肝癌细胞的生长与增殖。与KLK2不同的是,KLK4 和KLK14 则是通过水解性激素结合球蛋白(sex hormone-binding globulin,SHBG)来调控AR 的表达,KLK4 仅能水解部分游离的SHBG,而KLK14却能使SHBG完全水解[29]。
2.4 KLKs 可通过水解细胞黏附分子、细胞间连接蛋白和细胞外基质促进肝癌细胞的侵袭与转移 有关体内外试验结果表明,KLKs 可介导肝癌细胞的侵袭和转移过程,KLKs 可通过水解某些大分子物质如细胞间连接蛋白、细胞外基质(extracellular matrixc,ECM)和细胞黏附分子等促使肝癌细胞的侵袭与转移。Dong 等[30]的研究证实了KLKs 在肝癌细胞中的异常表达,可以降解绝大多数ECM 分子和黏附蛋白质。也有相关文献报道,KLKs 促进肿瘤的侵袭和转移的作用机制与其水解ECM 蛋白、重塑血管生成有关,KLK12 可通过促进血小板衍生生长因子B(platelet derived growth factor B,PDGF-B)的合成从而增加血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)的分泌,而这一过程恰与肿瘤血管生成中的内皮分化和毛细血管结构的形成密切相关[31]。ECM 的水解与重塑可使肿瘤细胞获得局部扩散和侵入血管的能力,更有利于肿瘤细胞的迁移和黏附,例如在内皮祖细胞中KLK1 的高表达使VEGF 分泌增加,并使血管内皮细胞免受凋亡,KLKs基因通过转导内皮祖细胞的迁移和黏附进而诱导新生血管形成[32]。Jiang 等[33]研究发现,在KLK5 高表达的癌细胞系SCC25 中,沉默KLK5 基因的表达后,桥粒黏蛋白1(desmoglein 1,Dsg1)的水解明显受到抑制,同时细胞的聚集显著增加,因此,KLKs可通过水解细胞间连接蛋白从而介导细胞间的聚集,进而调控细胞骨架结构和细胞迁移。而且,KLKs还可借助上皮间质转化(epithelial-mesenchymal transition,EMT)过程来增强肿瘤细胞的侵袭及迁移能力[34-35]。在肝癌细胞中,EMT 是由ΔNp63β介导的,高表达的ΔNp63β蛋白可以使KLK6、PAR2的表达上调和PAR1的表达下调,从而诱导肝细胞的恶性转变,并借助激活细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号传导来促使肿瘤细胞的增殖;而当ΔNp63β表达降低时,KLK6、PAR2的表达下调和PAR1表达上调,从而诱导EMT 表型,通过降低侵袭前沿的ERK 信号传导进而增强肿瘤细胞的迁移和侵袭[36]。
3 KLKs对肝癌化疗敏感性的调控
众多研究指出,化疗药物的临床疗效亦受KLKs异常表达的影响。KLKs的异常表达与肿瘤的放疗效果也有一定的相关性,KLK5 对宫颈癌的放射抗性至关重要,KLK5 的过表达与放疗后预后不良有关,下调KLK5 的表达会增加放射敏感性,从而为宫颈癌的放疗提供新的靶点和标志物[37]。在肝癌组织中,KLK10 的高表达与索拉非尼的化疗抵抗显著相关,KLK10 可作为索拉非尼治疗反应的独立预测标志物[38-39]。Dong 等[40]研究表明,KLK4 高表达与仑伐替尼的耐药存在着一定的相关性,在内源性高表达KLK4 的OVCA432 细胞系和外源性过度表达KLK4的SKOV-3 细胞系中,KLK4 过表达导致多细胞团簇(multicellular aggregates,MCAs)的形成,从而产生仑伐替尼化疗抵抗;而抑制KLK4 的活性可不同程度地逆转MCAs 的形成,从而增强化疗敏感性。另有基于3D 球体的动物模型研究报道,仑伐替尼和KLKs/MAPK 信号通路抑制的组合方法可能比单独使用仑伐替尼化疗对晚期肝癌更有效,表明部分KLKs 基因可能与化疗药物耐药性的形成过程相关[41]。目前,尚缺乏关于KLKs在调控肝癌细胞化疗药物敏感性的机制及过程中的相关研究,因此开展深入研究或将有助于丰富以KLKs为靶点治疗肝癌的新思路。
4 KLKs在肝癌表达和预后评估中的研究进展
近年来KLKs在肝癌中的表达和预后评估中的价值引起了国内外专家的广泛关注。绝大多数KLKs蛋白可在正常人体的肝脏组织中表达,其中在肝脏提取物中可观察到相对浓度较高的KLK7、KLK9 和KLK12,其余KLK的家族成员则可在较低浓度下观察到;但在mRNA 水平上,除了可以观察到较低表达水平 的KLK11、KLK12 和KLK14 之 外,其 余KLKs mRNA的转录产物在肝脏中几乎检测不到[42-43]。现阶段关于KLKs与肝癌的研究报道尚不多见。有学者研究发现KLK1 在ⅠCC 中的表达比健康对照组低[44]。KLK6、KLK7、KLK12 mRNA 基因在正常肝脏标本中几乎检测不到,其在肝脏的表达仅见于肿瘤肝转移,而KLK5、KLK10、KLK11、KLK13和KLK14 mRNA基因不管是在正常肝组织还是在病理性肝组织中的表达均较弱[45]。Lu 等[46]研究指出KLK10 的高甲基化与丙型病毒性肝炎及肝硬化的感染呈正相关,而与乙型病毒性肝炎感染呈负相关;另外,KLK10 基因的表达恢复对HCC细胞的基质非依赖性生长产生阻碍作用,且增强其对细胞毒性剂的敏感性,这说明KLK10基因的失活在肝癌进展中产生着重要影响。但另有研究表明,KLK10 mRNA 在HCC 中的表达水平与肿瘤的数目、大小、临床分期等呈显著负相关,而表达水平明显降低,这说明KLK10的低表达或表达缺失与肝肿瘤的增殖、浸润及转移紧密相连,可考虑作为评估肝癌预后的良好指标[47-48]。同时,内源性KLKs 结合蛋白Serpin A4 还可通过拮抗KLKs 活性来阻碍血管生成,从而抑制肝癌HepG2细胞增殖并诱导细胞凋亡[49]。吴锦良[50]研究发现,与KLK9蛋白质在癌旁组织及正常肝组织中的表达水平相比,其在肝癌组织中的表达水平更高,而KLK9 mRNA 在肝癌细胞株的表达水平也显著高于正常肝细胞,说明KLK9 基因可能与正常肝组织的癌变过程密切相关;该研究还发现KLK9 蛋白质的阳性表达率与肿瘤的大小、分化程度、TNM 分期以及淋巴结转移呈显著的正相关,说明KLK9 基因可促进肝癌细胞的侵袭与转移,在肝癌的发生和发展中起着重要的作用,是肝癌诊断和预后评价的重要指标。
5 结语
综上所述,KLKs在肝癌中表达异常,其可以通过蛋白酶激活受体通路、生长因子通路和雄激素受体等信号通路促进肝癌细胞的增殖,以及通过水解细胞黏附分子、细胞间连接蛋白和细胞外基质,并介导肝癌细胞上皮间质转化,参与肝癌细胞的侵袭与转移。KLKs 在肝癌中的表达异常与肿瘤的增殖、侵袭和转移息息相关,未来可能作为新型生物学标志物应用于肝癌的早期筛查、个性化诊治以及预后评估中,也有学者提出将KLKs作为肝癌潜在的分子靶点以期丰富肝脏肿瘤的临床治疗策略进而改善患者预后。因此,进一步探索相关KLKs基因在肝癌组织中的信号传导通路、表达调控情况及蛋白的相互作用机理,结合大量的体内外临床研究,提出有针对性的干预策略,可为肝癌的分子靶向治疗提供更加精准的治疗决策。
