miR-34c抑制NLRP3炎性小体诱导的小胶质细胞焦亡机制研究
2023-06-15刘东亮屈洪党
骆 嵩,李 理,刘东亮,屈洪党
目前缺血性脑卒中已经成为我国常见的疾病之一,治疗手段有限,致残率高,死亡率高,复发率高,涉及到的病理生理过程复杂。挽救缺血半暗带是缺血性脑卒中治疗成败的关键,而在缺血半暗带区域同时也存在炎症反应,有学者形象地将其比作类似缺血半暗带的“炎症半暗带”[1-5]。NLRP3炎症小体过度表达和产生对于缺血性脑卒中进展加重都有不良影响。有研究发现,当发生大脑中动脉栓塞或全脑发生缺血时,就会加剧促炎细胞聚集活化和NLRP3炎性小体过度表达、产生,从而加剧缺血区域脑组织炎症免疫反应[6-10]。小胶质细胞焦亡在缺血脑组织固有炎症反应中有重要的作用[11-12],其分泌炎症因子,召集更多的活化的炎性细胞,进一步加剧炎症反应,其自身焦亡现象导致炎症反应更趋扩大,通过调节缺血半暗带周边的炎症反应,避免M1小胶质细胞焦亡对于保护缺血半暗带十分重要。MicroRNA(miRNA)是约18~25个核苷酸的内源性非编码小RNA分子,通过与靶基因的3′非翻译区(3′-UTR)结合调控基因表达,促进细胞的增殖、分化和凋亡等过程[13]。据报道,miR-34家族成员miR-34c能通过调节血管平滑肌细胞钙化、内皮细胞衰老等影响糖尿病引起的血管衰老[14]。在对缺血性脑卒中病人进行基因分型中发现,miR-34c的表达水平与缺血性脑卒中风险呈负相关关系[15]。提示miR-34c可能用于缺血性脑卒中的预测或治疗,但对于miR-34c的具体调控机制尚不清楚。因此,本研究旨在探讨miR-34c是否对NLRP3炎性小体所诱导的小胶质细胞焦亡具有抑制作用及可能的机制,为后续的缺血性脑卒中神经保护临床应用提供新的治疗靶点和实验依据。
1 材料与方法
1.1 细胞培养 实验所用细胞是人源小胶质细胞HMC3,该细胞株源于北京北纳创联生物技术研究院,并于37 ℃、5%CO2、CM8-1培养液条件下进行培养。
1.2 主要试剂 miR-34cmimics和miR-NC购自上海佰欧晶生物科技有限公司;一抗人抗兔NLRP3和GSDMD抗体(武汉爱博泰克公司);ATP由生工生物工程(上海)公司提供;脂多糖(LPS)由上海源叶公司提供;乳酸脱氢酶细胞毒性检测试剂盒(碧云天公司);SuperScriptⅢ Reverse Transcriptase购自赛默飞生物化工制品有限公司;Power Up SYBR Green Master Mix购自赛默飞公司;组织总蛋白提取试剂(T-PER tissue protein extraction reagent)和抑制剂(halt proteaseand phosphatase inhibitor cocktail)购自赛默飞公司;BCA蛋白浓度测定试剂盒(增强型) 购自上海碧云天公司;引物购自上海生工生物工程公司,CCK8试剂盒购自迈克生物公司。
1.3 方法
1.3.1 LDH检测 首先将对数生长期的HMC3细胞以5×103个/孔进行铺板(96孔板)。选择5个孔加入含100 ng/mL LPS的培养基培养24 h。含100 ng/mL LPS的培养基培养HMC3细胞24 h后更换含5 mmol/L ATP的培养基培养30 min,去除上清,PBS冲洗2遍。每孔加入100 μL无血清培养基。细胞培养板放入离心机(400 g)5 min后,每孔取上清60 μL,随后加入60 μ LLDH的检测液并加入到新的96孔板中。放入摇床避光混匀30 min。利用酶标仪以490 nm波段检测。INT 溶液(1×)的配制:首先把10×的INT溶液稀释为1×的INT溶液,稀释为总量为400 μL INT(1×)溶液,其中稀释比例(1∶10),试剂现配现用。LDH 检测工作液的配置:取乳酸溶液400 μL,INT 溶液(1×) 400 μL,酶溶液400 μL,进行混匀。
1.3.2 CCK-8检测 取各组细胞在96孔板中以5 000个/孔的细胞密种板。CCK8铺板后的细胞更换含100 ng/mL LPS的培养基培养24 h后,更换含5 mmol/L ATP的培养基培养30 min,CCK8实验的细胞更换完全培养基,每孔100 μL。CCK8实验每孔加入10 μL的CCK8溶液,培养箱孵育2 h后再酶标仪于450 nm检测吸光度,连续检测5 d,每天相同的时间加入10 μL CCK8溶液,培养箱孵育2 h后进行检测。
1.3.3 Western blotting检测 各组细胞培养到80%~90%时,胰酶消化后,离心后加入RIPA蛋白裂解液,冰上裂解30 min后,离心取上清。随后用BCA定量试剂盒进行蛋白定量,各组总浓度不低于60 μg/L。根据快速凝胶电泳试剂盒,配制10%凝胶,加入等量的样品后,上层浓缩胶以70 V电泳30 min,下层分离胶100 V进行电泳1.5 h。随后,取胶体,取等面积PVDF膜,并用甲醇浸泡10 s;紧贴到胶体上,加紧转膜夹后,以200 mA转膜2 h(转膜仪冰浴)。转膜结束后,BSA封闭液封闭1 h,然后TPBS洗膜3次(10分钟/次)。一抗孵育过夜,第2天,TPBS洗膜3次后,二抗孵育1~2 h,加入显影液,曝光显影。
1.4 细胞分组 按照实验分组,LPS+ATP联合诱导小胶质细胞作为对照组,miR-34c转染后LPS+ATP联合诱导小胶质细胞作为观察组。比较2组小胶质细胞的细胞活力和细胞焦亡相关关键因子关系。
1.5 统计学方法 采用t检验、方差分析和q检验。
2 结果
2.1 miR-34c在LPS+ATP联合诱导的小胶质细胞焦亡中表达情况 正常的小胶质细胞,其miR-34c表达相对较高,达到1.435±0.076;而LPS+ATP联合诱导下的小胶质细胞,其miR-34c表达减少,为1.000±0.066。两者表达差异有统计学意义(t=23.67,P<0.01)。
2.2 miR-34c转染后小胶质细胞LDH释放结果 对照组小胶质细胞发生焦亡后,LDH释放达到(0.070±0.004)。而在观察组中miR-34c转染后的小胶质细胞,其LDH释放呈现下降趋势(0.038±0.001)。2组之间差异有统计学意义(t=42.51,P<0.01)。
2.3 miR-34c转染后小胶质细胞细胞活力结果 观察组小胶质细胞活力随时间延长而明显延长(P<0.01)。而对照组中的小胶质细胞活力亦随时间延长而明显延长(P<0.01)。2组小胶质细胞除第1天活力差异无统计学意义(P>0.05)外,其他时间观察组均明显高于对照组(P<0.01)(见表1)。

表1 2组小胶质细胞活力比较
2.4 2组小胶质细胞内焦亡相关蛋白表达变化 与对照组相比,观察组NLRP3炎性小体、caspase-1、GSDMD、IL-1β、IL-18表达均有明显降低(P<0.01) (见表2)。
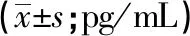
表2 2组小胶质细胞内焦亡相关蛋白表达变化
3 讨论
缺血性脑卒中有着复杂的病理生理过程,减轻缺血半暗带区域过度的炎症反应,对于保护和挽救缺血半暗带有着重要的意义。小胶质细胞在中枢神经系统炎性反应中占据着重要的作用,其过度活化,通过级联式地激活更多炎性细胞活化及其炎性因子释放,从而加剧缺血半暗带损伤[16-19]。目前研究[20]显示,小胶质细胞除了凋亡和坏死两种调控方式之外,还存在细胞焦亡的现象。细胞焦亡是机体一种重要的天然免疫反应,这种反应不同于传统意义上的细胞凋亡和细胞坏死,是一种既有凋亡的程序型特点,也具有炎性坏死特点的新的细胞死亡方式。之所以说其具有凋亡的某些特点,是因为细胞焦亡过程中存在细胞核逐渐皱缩,DNA断裂等发生;但又不全如凋亡最终悄无声息,而是在后期如坏死一样,发生细胞的肿胀破裂,大量细胞内容物从细胞膜中漏出,引起局部剧烈的炎症反应,故而把这种兼具细胞凋亡和坏死两种特点的细胞死亡方式称为细胞焦亡[21]。细胞焦亡在感染性疾病、神经系统变性疾病和动脉粥样硬化发生发展中均扮演着重要的角色[22-24]。
以往研究[14]发现miR-34家族成员miR-34c能通过调节血管平滑肌细胞钙化、内皮细胞衰老等影响糖尿病引起的血管衰老。在对缺血性脑卒中病人进行基因分型中发现,miR-34c的表达水平与缺血性脑卒中风险呈负相关关系[15]。表明miR-34c可能用于缺血性脑卒中的预测或治疗,但对于miR-34c的具体调控机制尚不清楚。本研究中,发现了类似结果,即正常的小胶质细胞miR-34c表达高于LPS+ATP组,提示miR-34c对于小胶质细胞具有保护性意义。在对miR-34c转染后的小胶质细胞膜完整性及其细胞活力检测中,均优于LPS+ATP诱导组小胶质细胞,也进一步证实miR-34c对于小胶质细胞存活,主要是抑制细胞焦亡具有保护意义。
另外,有研究指出在缺血性脑卒中损伤下,Pro-caspase-1被损伤相关分子模式(damage-associated molecular patterns,DAMPs)激活的炎症小体NLRP3裂解成活性caspase-1,并诱导细胞膜穿孔使细胞溶解、死亡,胞内物质通过不完整的胞膜外释引起炎症反应[25]。caspase-1还可以促进促炎因子释放到细胞外,募集更多的炎症细胞聚集,扩大炎症反应[26]。ZHOU等[27]在研究大鼠缺血性脑卒中发现,通过抑制小胶质细胞中NLRP3的表达,可以显著减弱小鼠体内caspase-1激活,对脑缺血性脑损伤起到保护作用。因此我们进一步提出问题,即miR-34c是否通过调控NLRP3炎性小体表达,介导caspase-1活化,从而降低小胶质细胞焦亡及相关炎症因子释放这一信号途径而发挥作用。本研究对2组小胶质细胞进行了焦亡相关蛋白及因子表达分析,结果显示miR-34c转染小胶质细胞与LPS+ATP诱导下的细胞焦亡相关蛋白比较,其NLRP3炎性小体、caspase-1、GSDMD、IL-1β、IL-18生成均下降,进一步提示miR-34c可能通过调控NLRP3炎性小体表达,介导caspase-1活化,从而抑制小胶质细胞焦亡。
综上所述,miR-34c可能通过抑制小胶质细胞NLRP3炎性小体活化,从而抑制经典的caspase-1活化依赖的小胶质细胞焦亡发生。
