血清sFlt-1、PLGF水平及比值变化对伴发子痫前期的风险评估及模型构建
2023-06-15韩道旭李春晓
王 勉, 韩道旭, 李春晓
(山东济宁医学院附属医院产科, 山东 济宁 272100)
子痫前期(PE)是妊娠20周以后出现的产科严重并发症,临床中PE发病率占全部妊娠的5%~7%[1]。随着高龄产妇数量不断增加,PE患者也逐年增多,已成为不良妊娠结局的主要原因[2]。目前PE尚无有效治疗方案,既往多采取对症支持或及时终止妊娠的方式以避免母体损害,因此,寻找可靠的实验室指标预测PE发生风险,筛查PE高风险人群,及时予以适当的干预措施对改善临床结局具有重要意义。
目前关于PE的发病机制涉及多种学说,其中滋养细胞重铸不良——胎盘因子释放导致广泛内皮功能受损的“双阶段”学说被广泛接受[3]。可溶性血管内皮生长因子受体1(sFlt-1)、胎盘生长因子(PLGF)是由胎盘合成和分泌的具有调节血管内皮功能、参与炎症及氧化应激反应的细胞因子[4]。已有研究发现,sFlt-1、PLGF与妊高征的发生及发展关系密切,且对预测PE的发生有一定临床价值[5],但仅采用上述两项指标进行PE风险预测存在灵敏度或特异度较低的问题。本研究通过分析健康孕妇与PE孕妇sFlt-1、PLGF表达水平的差异,并结合临床常见危险因素,构建PE发生的风险预测模型,旨在为临床筛查PE高风险人群提供可靠的评估策略。
1 资料与方法
1.1 临床资料选取2021年8月至2022年8月山东济宁医学院附属医院产科收治的137例PE患者设为PE组,年龄23~40岁,平均年龄(32.53±3.28)岁,平均孕周(31.60±4.05)周。纳入标准:(1)符合美国妇产科医师学会(ACOG)制定的PE诊断标准[6];(2)孕周20周以后;(3)均为单胎妊娠;(4)知情并签署同意书。排除标准:(1)入组前已开展治疗者;(2)入组时经评估需近期终止妊娠者;(3)合并原发性高血压、原发性慢性肾脏病、慢性感染性疾病者;(4)精神障碍者。另选取同期规律产检的137例健康孕妇为对照组,年龄22~35岁,平均年龄(28.04±3.11)岁,平均孕周(32.15±4.11)周。本研究经院伦理委员会审核批准。
1.2 方法
1.2.1 PE病情程度评估标准 根据《妇产科学》(第9版)[7]相关标准评估病情严重程度,出现任一症状即为重度PE:收缩压/舒张压≥160 mmHg/110 mmHg;血小板<100×109/L;肝酶>正常上限的2倍;无原发性肾病前提下血肌酐升高至正常值2倍以上或≥1.1 mg/dL;肺水肿;不明原因头痛、严重持续上腹痛、新发视觉障碍或中枢神经系统异常。根据病情程度评估标准将患者分为轻度PE(MPE)组和重度PE(SPE)组。
1.2.2 血清sFlt-1、PLGF检测 PE组确诊后未治疗前及对照组产检时分别采集空腹肘静脉血5 mL,静置血液分层后离心8 min,3 000 r/min,获得上层血清,分成两份置-80℃待测。采用电化学发光法检测sFlt-1、PLGF浓度,应用全自动电化学发光免疫分析仪(苏州新波生物技术有限公司,型号SuperFlex)及配套试剂检测,计算sFlt-1/PLGF。
1.2.3 临床资料收集 采用问卷调查及查阅病历的方式收集临床资料,包括年龄、孕前体质指数(BMI)、入组孕周、有无规范产检、产次、有无自然流产史、妊高征史、高血压家族史、是否合并妊娠期糖尿病或肾病、孕期有无尿路感染、是否羊水过少,记录入组后治疗前的实验室指标,包括血小板计数(100~300 ×109/L)、白蛋白(33~55 g/L)、血尿酸(180~420 μmol/L)、血肌酐(44~97 μmol/L)、24 h尿蛋白(<150 mg)。
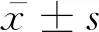
2 结果
2.1 对照组与轻、重度PE患者血清sFlt-1、PLGF水平及比值比较MPE组与SPE组血清sFlt-1、sFlt-1/PLGF比值均高于对照组,且SPE组高于MPE组(P<0.05);MPE组与SPE组血清PLGF低于对照组,且SPE组低于MPE组(P<0.05)。见表1。
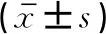
表1 对照组与轻、重度PE患者血清sFlt-1、PLGF水平及比值比较
2.2 对照组与PE组临床资料比较SPE组和MPE组患者中年龄>35岁、孕前BMI≥28 kg/m2、高血压病家族史、妊娠期糖尿病或肾病占比及血尿酸、血肌酐、24 h尿蛋白水平均高于对照组(P<0.05);SPE组有自然流产史、孕期尿路感染、羊水过少患者占比高于对照组(P<0.05)。SPE组和MPE组中规范产检患者占比、血小板计数、白蛋白水平低于对照组(P<0.05),且SPE组低于MPE组(P<0.05)。见表2。
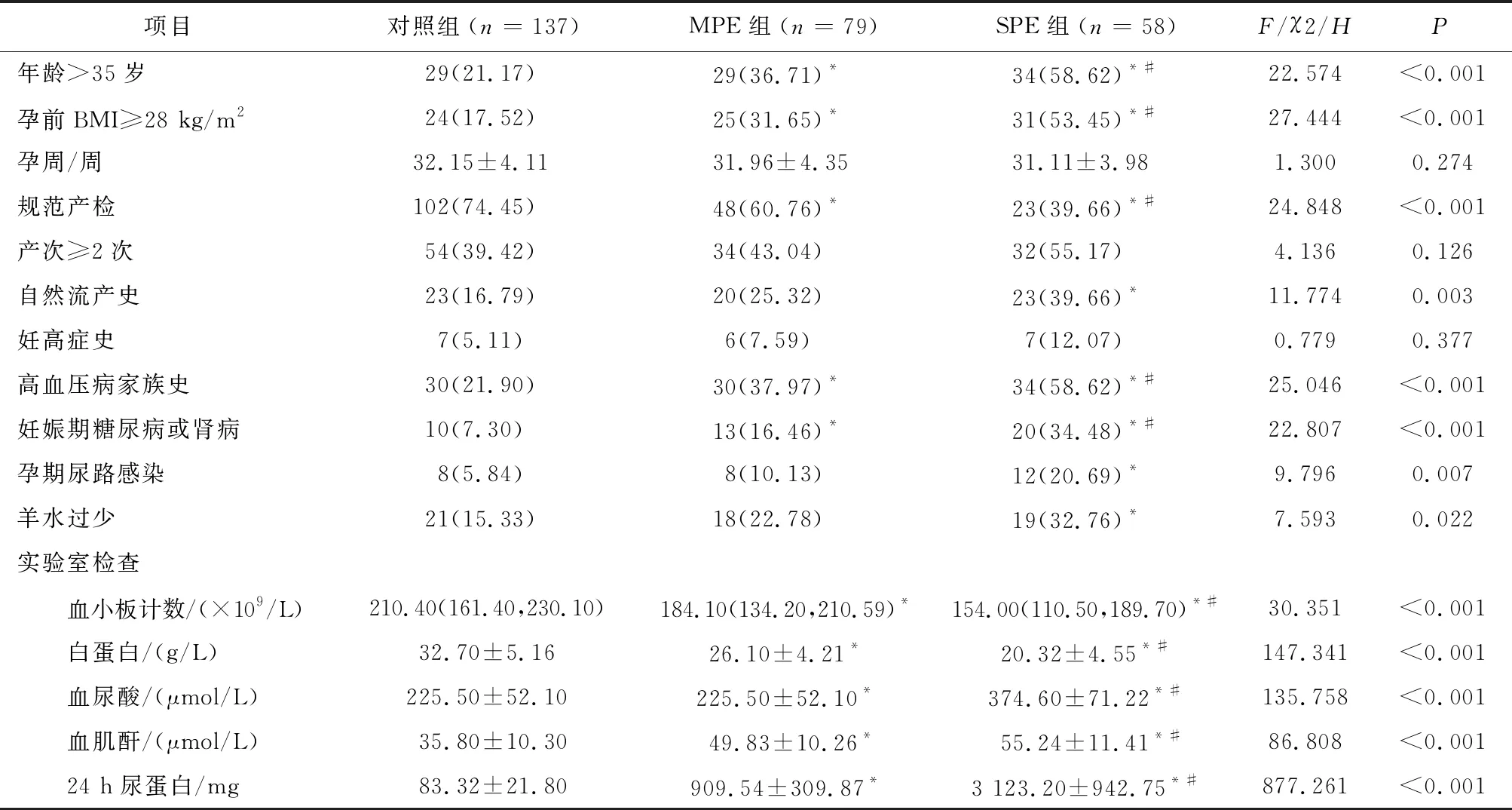
表2 对照组与PE组临床资料比较
2.3 多因素Logistic回归分析以有无发生PE为因变量(发生=1,未发生=0),将单因素有差异的项目作为自变量纳入二元Logistic回归模型,赋值方法:年龄>35岁(是=1,否=0)、孕前BMI≥28 kg/m2(是=1,否=0)、规范产检(是=1,否=0)、自然流产史(有=1,无=0)、高血压病家族史(有=1,无=0)、妊娠期糖尿病或肾病(有=1,无=0)、孕期尿路感染(有=1,无=0)、羊水过少(是=1,否=0),血尿酸、血肌酐、24 h尿蛋白、血小板计数、白蛋白、sFlt-1、sFlt-1/PLGF比值、PLGF赋值均为实际测量值,Logistic回归分析显示,年龄>35岁、孕前BMI≥28 kg/m2、有高血压家族史、妊娠期糖尿病或肾病、血小板计数减少、sFlt-1/PLGF升高是PE发生的独立危险因素(P<0.05)。见表3。
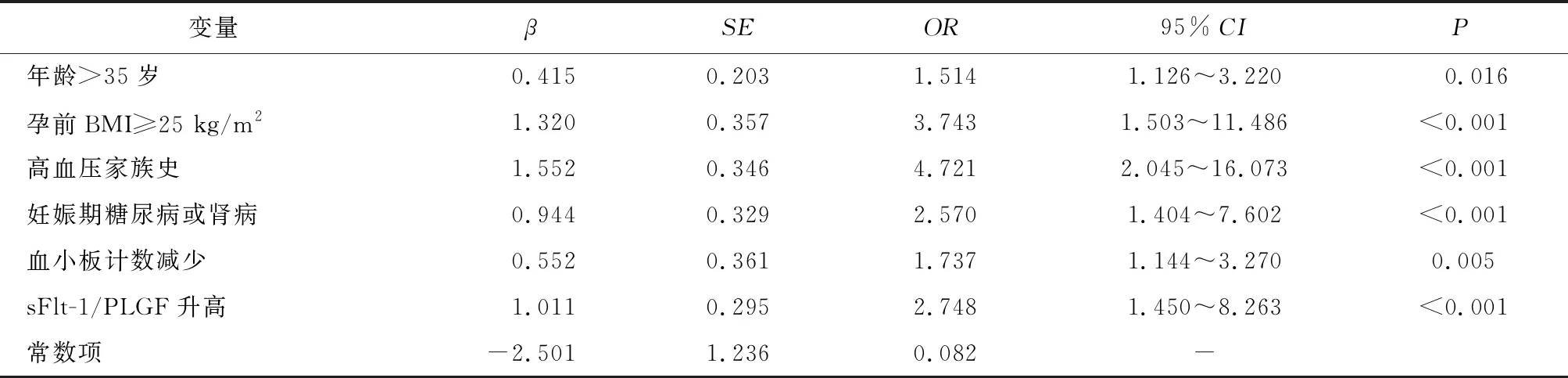
表3 Logistic回归分析法分析PE发生的危险因素
2.4 孕期PE发生风险预测模型的建立及验证以2.3项筛选的6个影响PE发生的危险因素为预测变量,建立风险预测模型方程:Logit(P)=年龄>35岁×0.415+孕前BMI≥28 kg/m2×1.320+有高血压家族史×1.552+妊娠期糖尿病或肾病×0.944+血小板计数减少×0.552+sFlt-1/PLGF升高×1.011-2.501。Bootstrap法内部验证显示风险预测方程的区分度好(C-index∶95%CI=0.862∶0.756~0.905);Calibration曲线评估风险预测方程的拟合度优(Hosmer-Lemeshowχ2=0.585,P=0.312),模型校准曲线见图1。
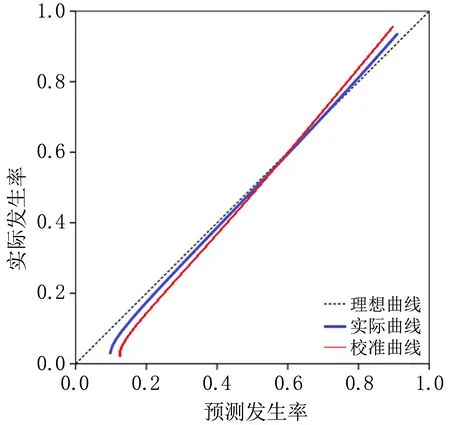
图1 PE风险预测模型的校准曲线验证
2.5 孕期PE发生风险预测效能评估应用PE预测模型方程对274例孕产妇进行回顾性验证,ROC曲线显示AUC为0.876(95%CI:0.823~0.917,P<0.05),灵敏度84.67%、特异度94.16%、约登指数0.778。将sFlt-1/PLGF比值单独作为预测因素绘制ROC曲线,结果显示sFlt-1/PLGF比值预测PE发生的AUC为0.776(95%CI:0.715~0.830,P<0.05),低于PE预测模型的预测效能(Z=2.105,P=0.034)。见图2、表4。
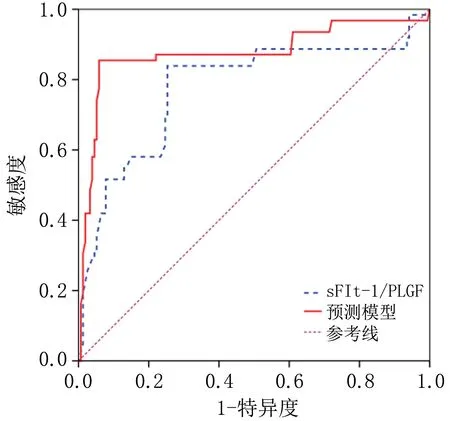
图2 风险预测模型对孕期PE预测的ROC曲线

表4 孕期PE发生风险预测效能评估
3 讨论
子痫前期(PE)是妊娠期特有并发症,尤其是重度PE,一旦发病则累及全身多个器官,严重威胁母婴健康[8]。PE的诊断主要依据临床表现,缺乏特异性诊断或预测指标。PE发病危险因素多样,有学者通过筛选对导致PE发生的危险因素如年龄、妊娠合并症、家族史等进行风险预测,但效果并不理想,结合血清标志物进行风险预测有重要临床意义[9-10]。有研究指出,胎盘血管内皮损伤、滋养细胞功能障碍是PE发病的病理学基础,滋养细胞分泌的细胞因子水平变化与PE的关系逐渐成为研究热点,其中血清sFlt-1、PLGF受到关注[11-12]。
本研究发现,MPE组与SPE组血清sFlt-1、sFlt-1/PLGF比值均高于对照组,且SPE组更高,MPE组与SPE组血清PLGF低于对照组,且SPE组更低,提示PE患者存在sFlt-1升高和PLGF降低情况,且随病情加重其异常程度增加。孕期机体血管内皮细胞功能障碍是公认的PE发病机制。PLGF属于血管内皮生长因子(VEGF)家族,具有诱导新生血管生成,促进滋养细胞增殖、迁移,维持血管通透性等多种功能[13]。有研究显示,妊娠期间PLGF水平呈先增高后降低的趋势,于孕30周达到高峰,而PE患者在同孕周期间PLGF水平明显降低[14]。sFlt-1是酪氨酸酶家族成员之一,其特异性配体为PLGF和VEGF,sFlt-1水平升高可竞争性结合PLGF和VEGF,从而阻止胎盘螺旋动脉重塑及新生血管生成,造成滋养层浸润不足,胎盘缺氧缺血,最终可导致PE发生。由既往研究可知妊娠期间sFlt-1升高、PLGF降低与PE发生密切相关,其机制可能与二者异常表达引起内皮细胞功能障碍及氧化应激,激活下游凋亡信号通路介导胎盘滋养层细胞凋亡有关[15]。Jeon等[16]研究表明,PE患者sFlt-1/PLGF比值升高,且其水平与PE严重程度有关,这与本研究结果一致。Tasta等[17]通过评估早发型PE患者妊娠结局发现,sFlt-1/PLGF比值升高可能通过增加妊娠期严重并发症风险从而导致不良妊娠结局。上述研究说明sFlt-1/PLGF在妊娠期PE的发生及病情进展中发挥重要作用。
本研究经多因素Logistic回归分析发现,年龄>35岁、BMI≥28 kg/m2、有高血压家族史、妊娠期糖尿病或肾病、血小板计数减少、sFlt-1/PLGF升高是PE发生的独立危险因素,与庄彩霞等[18]研究表明的年龄、孕前BMI、血小板计数、妊娠期糖尿病或肾病是PE发病危险因素的结果相符,与陈雅萍等[19]研究指出的年龄、肥胖、高血压家族史是PE发病危险因素的结果相符。合并症对PE的发生具有显著影响,本研究结果显示合并糖尿病或肾病患者PE发生风险更高,其可能原因为糖尿病或肾病患者本身存在血管内皮功能损害,可能会影响子宫血管生成、胎盘血液循环及功能,从而增加PE风险[20]。高血压患者血管内皮损伤,血小板大量激活或被消耗。Li等[21]研究发现血小板计数/平均血小板体积、sFlt-1/PLGF均是PE发生的危险因素,联合预测PE发生的AUC为0.820,有较好的预测效能,但仍存在误诊或漏诊情况。Ohkuchi等[22]研究发现,以sFlt-1/PLGF=38作为区分是否发生PE的临界值时对1周内发生PE的预测效能较高,但对4周内预测灵敏度仅32.4%,因此单独应用sFlt-1/PLGF预测PE发生风险的准确度仍需要进一步提高。本研究根据筛选的5个临床指标并联合sFlt-1/PLGF构建PE风险预测模型方程,经验证具有良好的区分度,ROC回顾性验证显示AUC=0.874,优于单独应用sFlt-1/PLGF比值的预测效能(AUC=0.776),说明本次构建的预测模型对筛查PE高风险人群有一定指导价值。除年龄、孕前BMI、有高血压家族史等不可控因素外,医护人员可通过对妊娠期合并症(糖尿病或肾病)进行强化管理,监测血小板计数、sFlt-1/PLGF水平,以快速识别高风险PE孕妇,及时予以干预治疗以改善临床结局。
综上所述,年龄>35岁、BMI≥28 kg/m2、有高血压家族史、妊娠期糖尿病或肾病、血小板计数减少、sFlt-1/PLGF升高是PE发生的独立危险因素,建立的风险预测模型对PE发生有较好的预测效能,能够为临床早期甄别PE高风险人群提供可靠依据。
