纳米二氧化硅和镉联合暴露对人脐静脉内皮细胞的影响*
2023-06-14焦卓亚骈玉杰
赵 婧 焦卓亚 王 娟 刘 璐 骈玉杰 王 丹
山西医科大学汾阳学院预防医学教研室,山西省汾阳市 032200
环境颗粒物(Particulate matters,PM)是世界范围内主要公共健康问题,已有越来越多的流行病学和实验室证据证实,环境PM与心血管疾病的发生有关[1]。不同类型的污染物在环境中通常共存[2],研究表明[3],PM的有害效应是细颗粒物及其吸附的有毒污染物共同作用的结果,然而,更细的颗粒物和空气污染物的联合毒性仍然不清楚。纳米二氧化硅(SiO2)广泛存在于工业、医药和食品中[2],镉(Cd)是一种广泛分布的污染物[4],可能与环境中的纳米SiO2共存。内皮细胞功能的体外研究常使用人脐静脉内皮细胞(Human umbilical vein endothelial cells,HUVECs)。因此,本文旨在研究纳米SiO2和Cd对HUVECs的联合暴露效应,通过评估HUVECs氧化损伤和DNA损伤来评价其联合作用。
1 材料与方法
1.1 材料、试剂及仪器 HUVECs株由华中科技大学同济医学院赠送。纳米SiO2(10~20nm,纯度≥99.8%,杭州万景新材料有限公司),氯化镉(CdCl2)(西安化学试剂厂),活性氧(ROS)试剂盒(碧云天生物技术研究所),超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性和丙二醛(MDA)试剂盒(南京建城),DMEM细胞培养液、胎牛血清(Gibco,USA),单细胞凝胶电泳(SCGE)试剂盒(Research Biolab,China)。所有其他化学品均属分析级,并可在市场上买到。多功能酶标仪(BbiTeK,USA),CO2水套培养箱(Forma 3111,USA),台式低温离心机(eppendorf 5810R,GER),电泳仪、电泳槽(北京市六一仪器厂),荧光显微镜、荧光数码显微成像系统(OLYMPUS,Japan)。
1.2 方法
1.2.1 纳米SiO2和CdCl2的配制:用无菌三蒸水制备2mg/ml纳米SiO2和50mmol/L CdCl2母液,高压灭菌,在4℃环境中保存,使用前紫外照射30min,超声处理15min,再将纳米SiO2母液和CdCl2母液用培养液稀释。
1.2.2 细胞培养及分组:HUVECs在添加10%灭活胎牛血清、青霉素/链霉素的DMEM培养基中培养,在37℃含5%CO2的培养箱保存,然后收集对数生长阶段的细胞,接种到96孔或24孔培养板,每孔150μl或1ml,接种密度5×104个/ml,24h后更换培养基,用PBS洗净,然后每孔按总体积150μl或1ml添加指定的化学物质。对照组(未添加任何药物)、纳米SiO2组(添加10μg/ml的纳米SiO2)、CdCl2组(添加25μmol/L的CdCl2)、联合组(添加10μg/ml的纳米SiO2和25μmol/L的CdCl2)。各组设三个复孔。以上浓度的设定都是建立在前期的预实验基础上的。每组均在37℃含5%CO2的培养箱中放置24h,然后用于分析。
1.2.3 ROS水平测定:24h后,取出96孔培养板,PBS洗净,加入100μl的DCFH-DA,37℃孵育30min,弃去培养液,无血清培养液润洗3次,再将培养板置于多功能酶标仪,对各组的DCF荧光强度进行检测。
1.2.4 SOD、GSH-Px活性和MDA含量的测定:24h后,取出24孔培养板,用冰冷的PBS洗涤细胞,并在冰冷的RIPA裂解缓冲液中裂解30min。将裂解物按12 000r/min离心10min,收集上清液,并参照试剂盒说明书对SOD、GSH-Px活性及MDA含量进行测定。
1.2.5 DNA损伤测定: 24h后,用PBS洗净,将10μl细胞悬液与90μl琼脂糖混合,移至琼脂糖包被的载玻片上,用盖玻片遮盖,在4℃下冷却4min,将载玻片置于新鲜裂解液中,4℃避光2h,然后25V、300mA,电泳30min,用于DNA解链,载玻片用碘化丙啶(PI)染色后,再经荧光显微镜检测。
1.3 统计学方法 基于析因设计实验获得数据采用双因素方差分析(ANOVA)进行分析,随后进行交互效应和不同组间差异事后检验。全部采用SAS8.2软件包进行统计分析。临界值设为P<0.05。
先通过双因素方差分析得到F值和P值确定相互作用类型,然后比较因素A和B的联合效应(EA×B)和单独效应(EA或EB),相互作用类型判断标准如下:(1)相加效应:F<5,P>0.05,且EA×B>EA+EB;(2)协同效应:F>5,P<0.05,且EA×B>EA+EB;(3)拮抗作用:F>5,P<0.05,且EA×B 2.1 纳米SiO2和Cd对细胞ROS生成的影响 纳米SiO2组未观察到ROS的显著变化(见表1);与对照组相比,Cd暴露组或纳米SiO2和Cd联合暴露组的ROS生成增加,联合暴露组的升高幅度更大。析因分析显示,纳米SiO2和Cd对细胞ROS生成有协同作用(F=107.896,P<0.01)。结果表明,纳米SiO2的暴露使Cd的细胞毒性增强。 表1 纳米SiO2和Cd对HUVECs ROS生成的影响 2.2 纳米SiO2和Cd对细胞SOD和GSH-Px活性的影响 SOD和GSH-Px是细胞内主要的抗氧化酶,其活性体现了细胞的酶促抗氧化能力。暴露于纳米SiO2的细胞中观察到SOD活性无显著变化(见表2),然而,与对照组相比,暴露于Cd以及纳米SiO2与Cd联合暴露的细胞SOD活性显著降低,与单独暴露于Cd的细胞相比,在暴露于Cd和纳米SiO2的细胞中观察到更显著的SOD活性降低。同样,在暴露于Cd或纳米SiO2与Cd组合的细胞中,GSH-Px活性显著降低,在暴露于纳米SiO2与Cd组合的细胞中观察到最高的降低。结果表明,纳米SiO2与Cd的联合作用使得HUVECs的酶促抗氧化能力明显下降。析因分析表明,纳米SiO2与Cd相加作用导致SOD活性下降(F=1.956,P>0.05),纳米SiO2与Cd协同作用导致GSH-Px活性下降(F=6.35,P<0.05)。 表2 纳米SiO2和Cd对HUVECs SOD和GSH-Px活性的影响 2.3 纳米SiO2和Cd对细胞MDA含量的影响 暴露于纳米SiO2的细胞MDA含量并未观察到显著变化(见表3),但与对照组相比,暴露于Cd或纳米SiO2与Cd联合暴露的细胞MDA含量有明显增加,最高的增加是在纳米SiO2与Cd联合暴露的细胞中观察到的。析因分析表明,纳米SiO2与Cd对MDA含量的增加具有相加作用(F=0.08,P>0.05)。 表3 纳米SiO2和Cd对HUVECs MDA含量的影响 2.4 纳米SiO2和Cd对细胞DNA损伤的影响 与对照细胞相比,暴露于纳米SiO2对细胞DNA损伤无明显影响(见表4),但Cd或纳米SiO2与Cd联合暴露均对细胞DNA损伤有明显诱导作用,表现为明显升高的OLIVE尾炬。纳米SiO2和Cd联合作用对HUVECs DNA损伤更严重。析因分析表明,DNA损伤是由纳米SiO2和Cd之间的协同作用引起的(F=12.962,P<0.01)。 表4 纳米SiO2和Cd对HUVECs DNA损伤的影响 因为PM组成复杂,吸入PM的生物反应不仅取决于单个组分,还取决于其与附着组分之间的相互作用,PM及其吸附污染物的联合暴露可能会影响污染物的单独作用[5],因此需要对PM及其吸附的有毒污染物的联合毒性进行判定。本研究表明,纳米SiO2和Cd可通过相加或协同作用增强HUVECs氧化应激和DNA损伤。 PM可诱导细胞的氧化损伤[6]。Cd具有诱导氧化应激、DNA损伤的作用[7]。本研究显示,适度细胞毒性浓度的Cd诱导HUVECs氧化应激和DNA损伤,如ROS生成增加、SOD、GSH-Px活性降低,MDA含量增加以及DNA尾炬值增加;仅暴露于非细胞毒性浓度的纳米SiO2对细胞内氧化还原平衡没有显著影响,然而,纳米SiO2和Cd的联合暴露显著增强了氧化应激和DNA损伤,表现为ROS生成和MDA含量升高幅度更大,SOD和GSH-Px活性降低幅度更大,DNA损伤更严重。 联合暴露于不同的毒物组合,可产生相加作用、协同作用或拮抗作用[8]。本研究表明,纳米SiO2与Cd联合暴露对细胞ROS生成、GSH-Px活性和DNA损伤具有协同效应,对SOD活性和MDA含量具有相加效应。相关类似研究表明[9],将人肝脏细胞(HepG2)暴露于纳米SiO2和砷的组合中,对ROS生成、SOD活性、DNA损伤产生相加作用,对MDA含量和GSH-Px活性产生协同作用。然而,目前尚不清楚非细胞毒性浓度的纳米SiO2如何增强Cd对HUVECs的毒性,可能是由于纳米SiO2促进了Cd的积累。Zhang等[10]表明,在纳米TiO2存在的情况下,鲤鱼体内Cd2+浓度增加了146%。Yu等[11]发现,将A549细胞暴露在纳米SiO2和甲基汞混合物中,细胞内甲基汞浓度明显高于单独暴露于甲基汞的细胞,表明纳米SiO2促进了细胞对甲基汞的摄取,这可能是暴露于纳米SiO2和甲基汞组合后毒性增强的原因。一些研究报道[12],纳米TiO2作为载体促进Cd内化进入人肝癌和乳腺癌细胞。Limbach等[13]认为,纳米SiO2在暴露于纳米SiO2和锰组合的细胞中起到“特洛伊木马”的作用,这可能解释了吸附在纳米SiO2上的有毒分子更容易进入细胞的原因。由于Cd的理化性质与吸附在PM上的典型空气污染物锰、汞相似,因此有理由推测,更多的Cd可能通过纳米SiO2的细胞内化作用进入细胞,纳米SiO2可能起到载体或“特洛伊木马”的作用,这可能促进了Cd在HUVECs中的积累,导致氧化应激和DNA损伤的增加。纳米SiO2在细胞质、细胞核等的定位,除了增加细胞对Cd的摄取,还可能诱发细胞、亚细胞结构或功能的紊乱[14],诱导产生ROS和后续的氧化应激可能是导致纳米SiO2诱导毒性的分子机制[15-16],所以,接下来我们要继续探究纳米SiO2细胞内分布的是怎样的。本研究显示,非细胞毒性浓度的纳米SiO2不影响细胞内的氧化还原平衡,然而,纳米SiO2对细胞的潜在干扰可能使细胞对Cd的易感性增加。 综上所述,非细胞毒性浓度的纳米SiO2和细胞毒性浓度的Cd共同作用于HUVECs,可增强细胞氧化应激和DNA损伤,其细胞毒性作用是通过纳米SiO2和Cd的相加或协同作用实现的。纳米SiO2作为载体的特殊理化特性,促进了Cd在HUVECs中的积聚,从而加剧Cd诱导的氧化应激和DNA损伤。更好地了解UFPs和空气污染物的联合毒性及其潜在毒性机制,有助于阐明暴露于PM的健康影响。2 结果

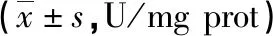


3 讨论
