原发性中枢神经系统淋巴瘤在MTX基因检测下进行RMT方案治疗的疗效与安全性
2023-06-14贾思思张桂芳何秋立王彩玲张海鹏孟娜娜
贾思思 张桂芳 何秋立 王彩玲 张海鹏 孟娜娜
原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma,PCNSL)是一种典型的侵袭性非霍奇金淋巴瘤,通常为大B细胞组织学,历史上被认为与相同组织学的系统性淋巴瘤相比,预后明显较差[1]。到目前为止,PCNSL的治疗还没有标准化的方法。甲氨蝶呤,为抗叶酸类抗肿瘤药,主要通过对二氢叶酸还原酶的抑制来阻碍肿瘤细胞DNA的合成,并进一步抑制肿瘤细胞增殖[2]。尽管人们一致认为高剂量甲氨蝶呤(HD-MTX)是治疗的基础,但HD-MTX作为单药治疗的中位无进展生存期(PFS)并不理想,只有11到13个月[3]。研究发现[4-6],一些耐药基因的多态性会影响甲氨蝶呤治疗癌症的疗效和不良反应,包括SLCO1B1 T521C、ABCB1 C3435T、MTHFR A1298C、MTHFR C677T。因此,针对这些基因多态性的PCNSL患者可以调整甲氨蝶呤剂量以减轻不良反应,提高治疗疗效。临床上,替莫唑胺和利妥昔单抗已经用于治疗PCNSL,并取得了较好的结果[7-9]。基于此,本研究通过检测甲氨蝶呤(MTX)相关耐药基因多态性(SLCO1B1 T521C、ABCB1 C3435T,MTHFR A1298C,MTHFR C677T)后,对原发性中枢神经系统淋巴瘤(PCNSL)进行甲氨蝶呤、替莫唑胺、利妥昔单抗(RMT)治疗,并评估其疗效和安全性。
1 资料与方法
1.1 一般资料
纳入2016年1月至2022年1月新乡市中心医院、安阳市肿瘤医院、安阳地区医院收治的PCNSL患者32例,平均年龄(60.5±10.2)岁,其中男性21例(65.63%),血清LDH升高26例(81.25%),ECOG评分大于1有17例(53.13%),存在脑深部病灶17例(53.13%),CSF蛋白升高19例(59.38%)。
纳入标准:①经两位病理专家诊断为PCNSL,CD20阳性;②病灶局限于中枢神经系统;③治疗前经甲氨蝶呤基因多态性鉴定;④临床资料完整,均可进行随访;⑤既往未接受化疗、放疗等抗肿瘤治疗;⑥患者自愿加入本研究,签署知情同意书,依从性好。排除标准:①患有其他肿瘤者;②严重肝功能损伤者;③严重肾功能损失者;④免疫缺陷者;⑤妊娠期或哺乳期患者;⑥具有精神类药物滥用史且无法戒除或有精神障碍者;⑦4周内参加过其他抗肿瘤药物临床试验。所有患者均签署知情同意书,并且此研究获得我院的伦理委员会批准。
1.2 治疗方法
所有患者均接受RMT方案治疗,具体为:利妥昔单抗(汉利康) 375 mg/m2d0静脉滴注;甲氨蝶呤3 g/m2d1 10%剂量静脉滴注0.5 h,剩余90%剂量静脉滴注23.5 h,第1周期根据基因检测结果适量减低剂量,后期根据不良反应调整剂量,甲氨蝶呤结束后行亚叶酸钙解救;d1~5口服替莫唑胺胶囊150 mg/m2,每21 d为1周期。
1.3 治疗疗效及不良反应的评估
疗效根据国际原发中枢神经系统淋巴瘤合作组PCNSL治疗指南[10]进行评估,包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、病情进展(progressive disease,PD)和病情稳定(stable disease,SD)。缓解率=(CR+PR)/总治疗人数×100%。疾病控制率=(CR+PR+SD)/总治疗人数×100%。不良反应的评估根据美国国家癌症研究所通用不良事件术语标准4.0版进行[11]。
1.4 MTX基因检测
抽取患者肘前外周血后提取血液基因组(beaverbio,70423-100),采用北京华夏时代基因科技发展有限公司测序反应通用试剂盒(备案号:京大械备20150009)进行荧光原位杂交方法检测MTX相关耐药基因多态性,通过序列比对发现均为SLCO1B1 521T>C、ABCB1 3435C>T,MTHFR 1298A>C,MTHFR 677C>T纯合。
1.5 统计学分析
本研究所有统计学分析使用python 3.8进行。Kaplan-Meier曲线和Log-Rank检验用于生存分析。使用双尾t检验用于定量数据比较。卡方检验用于定性数据比较。Cox回归用于多因素分析。
2 结果
2.1 RMT治疗的疗效
32例患者总治疗周期数为162周期,20例4周期治疗后评效CR,巩固2周期后进入随访阶段;8例患者经4周期治疗治疗后评效PR,序贯全脑放疗;2例4周期后评效SD,进入二线治疗;2例治疗1周期后未按时返院,评效PD。经RMT治疗后,CR有20例、PR有8例(序贯全脑放疗后CR)、SD有2例,PD有2例,因此RMT治疗的缓解率为87.5%,疾病控制率为93.8%。
2.2 RMT治疗后PCNSL患者的PFS
根据随访资料,计算RMT治疗后的生存率。无进展生存期(progression-free survival,PFS)定义为从患者确诊到疾病复发或进展或最后一次随访时间。本研究中位随访时间为35.9(2.0~51.0)个月,RMT治疗后的中位PFS为25.9个月。
2.3 RMT治疗后的不良反应
32例患者RMT治疗后总计不良反应有30次。其中,病毒感染1例(3.33%)、过敏1例(3.33%)、中性粒细胞减少4例(9.38%)、血小板减少2例(5.25%)、贫血2例(5.25%)、肾功能损伤1例(5.25%)、转氨酶增高4例(9.38%),未发生治疗相关性死亡。
2.4 PCNSL患者预后的单因素分析
单因素分析发现年龄>60岁、性别男、存在脑深部病灶对PCNSL预后影响不明显,但是血清LDH升高、ECOG评分大于1、CSF蛋白升高对PCNSL预后影响明显(P<0.05),见表1。
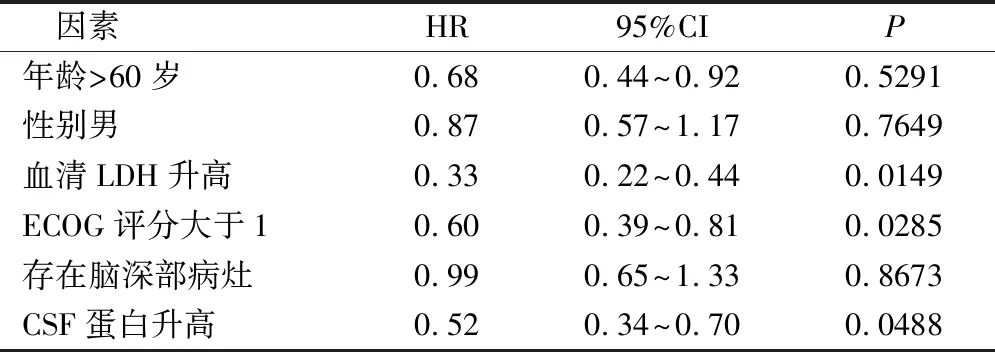
表1 PCNSL患者预后的单因素分析
2.5 PCNSL患者预后的多因素分析
用单因素分析结果中有统计学意义的因素进行Cox回归多因素分析,发现血清LDH升高、CSF蛋白升高是PCNSL预后的独立危险因素(P<0.05),见表2。
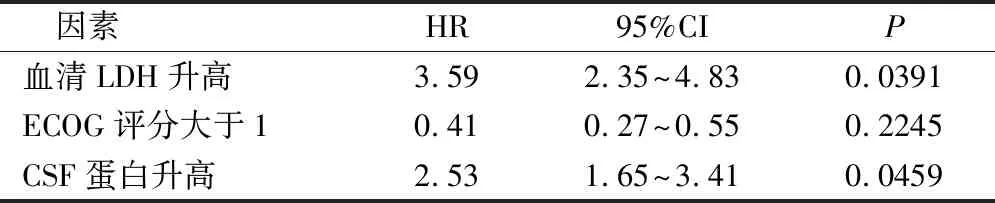
表2 PCNSL患者预后的多因素分析
3 讨论
原发性中枢神经系统弥漫性大B细胞淋巴瘤(PCNSL)是一种侵袭性结外非霍奇金淋巴瘤(NHL),局限于中枢神经系统(CNS),无全身受累的证据[12]。由于其独特的临床和分子特征,PCNSL在2017年世卫组织对血淋巴样肿瘤的分类中被确认为与系统性弥漫性大B细胞淋巴瘤不同的实体。PCNSL是一种罕见的恶性肿瘤,约占颅内肿瘤的4%,占结外淋巴瘤的4%~6%。尽管多年来化疗方案有所改进,但原发性中枢神经系统淋巴瘤(PCNSL)患者预后普遍较差,最佳治疗方案尚未确定。甲氨蝶呤、替莫唑胺、利妥昔单抗均已经在临床上用于治疗PCNSL。本研究针对特定的遗传背景PCNSL患者,通过甲氨蝶呤、替莫唑胺、利妥昔单抗三药联合治疗PCNSL患者取得了较好的缓解率。本研究发现RMT治疗后,缓解率为87.5%,疾病控制率为93.8%。此外,32例受试人员RMT治疗后总计不良反应有30次,中性粒细胞减少和转氨酶升高是主要不良反应(各4例),未发生治疗相关性死亡。在未检测MTX相关基因的情况下,邢倩[13]仅使用MTX治疗的缓解率为47.61%,疾病控制率为57.13%,而不良反应主要为口腔溃疡(54.76%)、肝功能损伤(61.90%)、贫血(59.52%)和消化道反应(64.29%)。同样在未检测MTX相关基因的情况下,庞迪文等[14]使用RMT治疗的缓解率为73.80%,疾病控制率为76.20%,42例患者出现3例贫血(7.14%)。因此,RMT治疗在MTX基因检测下可有效减少不良反应。
甲氨蝶呤转运途径中与甲氨蝶呤功效相关的每一步的药物遗传变异已经被研究了20多年[15]。一般来说,甲氨蝶呤靶向叶酸代谢周期,通过载体介导的转运系统进入和退出细胞膜[16]。转运蛋白网络属于两个主要的超家族:溶质转运蛋白(SLC)和ATP结合盒式转运蛋白(ABCB)[17]。一旦进入细胞,甲氨蝶呤就会抑制叶酸、蛋氨酸和腺苷的途径以及嘌呤和嘧啶的重新合成。抑制核酸合成进而导致细胞死亡。甲氨蝶呤的治疗结果受多种因素的影响,包括药物代谢、运输途径、环境和遗传因素[18],而遗传因素可能导致高达30%的临床疗效不确定。甲氨蝶呤转运通路中的基因多态性影响MTX的细胞内滞留,从而影响其疗效和安全性。基因多态性对MTX疗效和毒性的影响在类风湿性关节炎和淋巴瘤的研究中已有研究[19]。这些研究已经确定了ABCB1的表达作为MTX敏感性和毒性的潜在预测因子[20]。携带ABCB1的C3435T等位基因的类风湿性关节炎患者MTX耐药的风险更高,并且与高毒性有关[21]。一项全基因组关联研究发现有机转运多肽(SLCO1B1)基因参与MTX药代动力学和临床效应。SLCO1B1 T521C 等位基因也与MTX清除率低相关,这导致了高系统性暴露[22]。在其他临床环境中,MTHFR基因的多态性影响MTX疗效和毒性,包括两个位点MTHFR A1298C和MTHFR C677T[23]。
