外泌体介导miR-3473b靶向NF-κB对肺癌细胞肺内转移及B细胞数量的影响
2023-06-14李冯洋
李冯洋
肺癌为目前全球主要癌症发病和死亡原因之一。据2018全球癌症统计数据显示,全球癌症发病率约为236.9/10万,死亡率约为125.2/10万,其中肺癌发病率和死亡率均位居首位[1]。远处转移为肺癌常见扩散方式,亦是患者复发和死亡的主要原因之一。肺癌肺内转移是指在原发肿瘤外肺部出现的肿瘤,此时患者多处于晚期,预后较差[2]。近年研究发现,肿瘤细胞来源外泌体可诱导转移靶器官形成转移前微环境,并在循环肿瘤细胞定植后促进生成肿瘤血管,进而参与肿瘤转移过程[3]。除蛋白质外,外泌体miRNA在包括肺癌在内的大多数肿瘤进展过程中亦起到关键性作用[4]。Kim等[5]研究发现,肿瘤源性外泌体miR-619-5p可通过调节RCAN1.4,促进非小细胞肺癌细胞增殖和转移。目前国内为尚缺乏对肺癌细胞源性外泌体miR-3473b对肺癌细胞肺内转移及B细胞数量的影响的研究。本研究对此进行分析,旨在为临床治疗提供理论依据。
1 材料与方法
1.1 实验细胞及动物
小鼠肺癌细胞(LLC):购自上海抚生实业有限公司,货号FS-0291。C57BL/6小鼠:80只,SPF级,雌雄各半,购自南京君科生物工程有限公司,货号J006,周龄6~8周,体重110~120 g,自由饮食饮水,温度(21±2)℃,湿度30%~70%,光照周期12/12小时。肺成纤维细胞:分离自C57BL/6小鼠肺组织。细胞均置于含10%胎牛血清和100 IU/mL青霉素的DMEM高糖培养基(大连美仑生物技术有限公司,货号MA0212)中,37 ℃、5% CO2培养箱中培养。
1.2 主要试剂与仪器
外泌体提取及miRNA检测:由上海宇玫博生物科技有限公司完成。碳支持膜(货号AGS160H):英国Agar Scientific公司。3%磷钨酸负染液(货号G1871)、Cy5.5染料(货号S1061)、胶原酶Ⅳ(货号C8160)、ECL化学发光法检测试剂盒(货号SW2010)、总RNA提取试剂盒(货号R1200)、反转录试剂盒(货号RP1200):北京索莱宝科技有限公司。α-SMA(货号HL80016):上海哈灵生物科技有限公司。DAPI染色液(货号abs47047616):上海爱必信生物科技有限公司。BCA蛋白定量分析试剂盒(货号23221):美国赛默飞世尔公司。膜封闭液(货号SL1330):北京酷来搏科技有限公司。小鼠抗CD63单克隆抗体(货号D198650):上海生工生物股份有限公司。小鼠抗Hsp90单克隆抗体(货号AH732):上海碧云天生物技术有限公司。TaKaRa TB GreenTMPremix Ex TaqTMⅡ(货号RR820A):新疆宝信生物技术有限公司。共聚焦显微镜(型号Auto 2):美国赛默飞世尔公司。
1.3 方法
1.3.1 LLC来源外泌体鉴定及行踪 分离与鉴定:待LLC细胞生长融合度达80%时,更换无外泌体血清DMEM高糖培养基;24 h后收集细胞上清液,室温以2000 g离心30 min,取上清液移至新离心管,冰上保存;加入1/3体积外泌体提取试剂,4 ℃过夜;次日吸取2 mL液体于新离心管,4 ℃下以1500 g离心30 min,弃上清液;再次吸取2 mL液体于同一离心管,重复离心,直至所有液体均被吸取;取10 μL样品于封口膜上,上方放置碳支持膜,吸附制样;后将碳支持膜悬浮于3%磷钨酸负染液复染3 min,干燥后,透射电镜下观察外泌体大小及形态。细胞摄取:将Cy5.5染料与LLC来源外泌体混合,经尾静脉注射至小鼠体内;24 h后收集肺组织,制作组织切片,以α-SMA染色;加入胶原酶Ⅳ,收集肺成纤维细胞;将肺成纤维细胞接种于共聚焦培养皿中,2×105个/孔,加入Cy5.5标记的LLC来源外泌体;3 h后弃去上清,以PBS缓冲液冲洗3次,每次5 min;室温下以多聚甲醛固定10 min,PBS缓冲液冲洗3次,每次5 min;加入DAPI染色液,室温孵育10 min;PBS缓冲液冲洗3次,每次5 min;加入1 mL的PBS缓冲液,共聚焦显微镜下观察LLC来源外泌体行踪。外泌体标记蛋白表达:采用蛋白免疫印迹法。取LLC细胞,加入RIPA裂解液裂解30 min,按照BCA蛋白定量分析试剂盒说明书操作,检测相应蛋白浓度;10%聚丙烯酰胺凝胶电泳分离裂解产物后,转移至PVDF膜上,加入膜封闭液,室温封闭1 h;分别滴加CD63和Hsp90抗体,4 ℃过夜;TBST冲洗3次,每次5 min;滴加HRP标记相应二抗,室温孵育1 h;TBST冲洗3次,每次5 min;按照ECL化学发光法检测试剂盒说明书操作,凝胶成像系统分析目的条带分子量及光密度值。
1.3.2 细胞内及外泌体内miR-3473b表达 采用RT-PCR法。提取细胞RNA和外泌体miRNA,按照反转录试剂盒说明书操作,将RNA反转录为cDNA;引物序列,miR-3473b上游引物:5'-GCGGGCTGGAGAGATG-3',下游引物:5'-GTGCAGGGTCCGAGGT-3';反应体系:上游和下游引物各8 μL,TaKaRa TB GreenTMPremix Ex TaqTMⅡ 10 μL,cDNA 2 μL,4 ℃离心(1500 rpm)1 min,每孔设置3个复孔;反应条件:95 ℃预变性30 s(1个循环),95 ℃变性5 s(30个循环),60 ℃退火和延伸30 s(30个循环);取8 μL PCR产物,加2 μL 5×Loading Buffer,混匀后置于2%琼脂糖凝胶电泳,溴化乙锭染色后,凝胶成像系统进行定量分析。
1.3.3 LLC来源外泌体对小鼠肺内转移及B细胞数量的影响 尾静脉注射LLC来源外泌体,10 μg/20 g·次,1次/3 d;6 d后,尾静脉注射LLC细胞,5×105个,继续注射LLC来源外泌体3次,以及miR-3473b抑制剂6次;22 d后处死小鼠,收集肺组织,采用HE染色法观察小鼠肺转移数目及面积,流式细胞术分析肺部B细胞数量。
1.3.4 LLC来源外泌体miR-3473b对肺成纤维细胞NF-κB通路的影响 应用蛋白免疫印迹法。方法同1.3.1中外泌体标记蛋白检测步骤。
1.4 统计学处理

2 结果
2.1 LLC来源外泌体鉴定及行踪
透射电子显微镜显示,LLC来源外泌体微囊泡直径为30~100 nm,占80%以上(图1A);LLC来源外泌体微囊泡中Hsp90、CD63呈阳性表达(图1B);将Cy5.5标记的LLC来源外泌体加入成纤维细胞4 h后,LLC来源外泌体(绿色荧光颗粒)可被细胞摄取(图1C)。
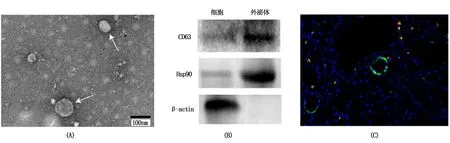
A为LLC来源外泌体大小和形态(箭头所示);B为外泌体标志物Hsp90、CD63表达(蛋白免疫印迹);C为成纤维细胞对Cy5.5标记的外泌体摄取情况(免疫荧光)。
2.2 细胞内及外泌体内miR-3473b表达
LLC来源外泌体内miR-3473b表达水平显著高于细胞内(t=5.498,P<0.01),见图2。
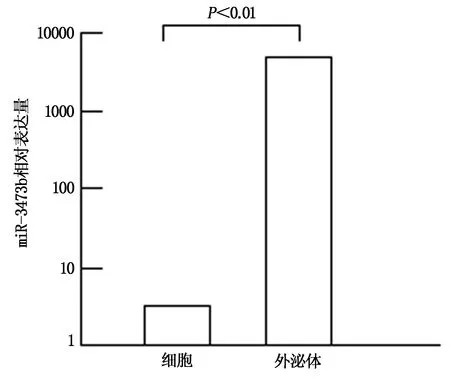
图2 细胞内及外泌体内miR-3473b表达
2.3 LLC来源外泌体miR-3473b对小鼠肺内转移的影响
LLC来源外泌体组小鼠肺转移数目及面积显著多于对照组(P<0.05);LLC来源外泌体+miR-3473b组与LLC来源外泌体组小鼠肺转移数目及面积比较,差异无统计学意义(P>0.05);LLC来源外泌体+miR-3473b抑制剂组小鼠肺转移数目及面积显著低于LLC来源外泌体组(P<0.05),见图3。

A为小鼠肺转移数量比较;B为小鼠肺转移面积比较。
2.4 LLC来源外泌体miR-3473b对小鼠肺内B细胞数量的影响
LLC来源外泌体组小鼠肺内CD45+标记免疫细胞中B细胞百分比显著高于对照组(P<0.05);LLC来源外泌体+miR-3473b组与LLC来源外泌体组小鼠肺内CD45+标记免疫细胞中B细胞百分比比较,差异无统计学意义(P>0.05);LLC来源外泌体+miR-3473b抑制剂组小鼠肺内CD45+标记免疫细胞中B细胞百分比显著低于LLC来源外泌体组(P<0.05),见图4。

图4 LLC来源外泌体miR-3473b对小鼠肺内B细胞数量的影响
2.5 LLC来源外泌体miR-3473b对肺成纤维细胞NF-κB通路的影响
LLC来源外泌体组小鼠成纤维细胞p65和p-p65水平显著高于对照组,Nfkbid水平显著低于对照组(P<0.05);LLC来源外泌体+miR-3473b组与LLC来源外泌体组小鼠成纤维细胞p65、p-p65及Nfkbid水平比较,差异无统计学意义(P>0.05);LLC来源外泌体+miR-3473b抑制剂组小鼠成纤维细胞p65和p-p65水平显著低于LLC来源外泌体组,Nfkbid水平显著高于对照组(P<0.05),见图5。

A为对照组;B为LLC来源外泌体组;C为LLC来源外泌体+miR-3473b组;D为LLC来源外泌体+miR-3473b抑制剂组。
3 讨论
外泌体为直径为40~100 nm的盘状囊泡,包括肿瘤细胞在内的多种细胞均可分泌。肿瘤微环境中,外泌体为细胞间通讯及遗传物质传递的重要载体,参与了肿瘤细胞生长、增殖、转移等生物学行为。Huang等[6]研究发现,非小细胞肺癌来源外泌体可通过传递α-平滑肌肌动蛋白,促进正常肺成纤维细胞和非小细胞肺癌细胞增殖和抑制细胞凋亡。外泌体中包含RNA、miRNA、DNA等多种成分。近年研究表明,外泌体miRNA在肺癌新生血管生成、细胞转移、免疫调节等方面发挥重要作用[7]。miR-3473b在肿瘤进展中作用尚未完全明确。Wang等[8]研究发现,小鼠大脑中动脉短暂性闭塞后,脑皮质和纹状体中miR-3473b表达显著上调,miR-3473b可通过增强卒中后神经炎症损伤,促进卒中发病。表明miR-3473b可能与炎症反应发生有关。NF-κB信号通路为炎症反应启动的经典通路之一。研究表明,NF-κB信号通路在介导肺癌炎症反应及细胞生长、增殖及转移中有着重要意义[9]。Shen等[10]从胃癌AGS细胞中提取外泌体,并与间充质干细胞培养发现,胃癌细胞来源外泌体可通过激活NF-κB信号通路,增强间充质干细胞激活免疫细胞、维持炎症环境、支持肿瘤生长的能力。
本研究首先对LLC提取的外泌体形态学及标志物鉴定发现,肺癌源性外泌体微囊泡直径为30~100 nm,占80%以上,且微囊泡中Hsp90、CD63呈阳性表达,与以往报道的肺癌源性外泌体相符[11]。既往研究表明,成纤维细胞为摄取肺内外泌体主要细胞之一[12]。本研究将Cy5.5标记的LLC来源外泌体加入α-SMA+成纤维细胞4 h后发现,LLC来源外泌体可被细胞摄取,提示LLC来源外泌体可被肺成纤维细胞吸收。后经RT-PCR反应发现,LLC来源外泌体内miR-3473b表达水平显著高于细胞内,提示外泌体miR-3473b参与调控肺癌细胞生物学行为。刘艳芳等[13]研究发现,肿瘤源性外泌体可通过激活肺上皮细胞Toll样受体3表达,促进肺转移前微环境形成。朱萌等[14]研究发现,低分化胃癌细胞来源外泌体可通过转运miR-106a影响胃癌腹膜转移。本研究发现,LLC来源外泌体可促进肺癌细胞肺内定植,注射miR-3473b抑制剂后,肺癌细胞肺内定植显著减少,提示miR-3473b抑制剂可减少肺癌细胞肺内定植,可能与抑制肺癌细胞增殖和转移有关,具体机制还需进一步探讨。B细胞为体液免疫主要细胞之一,可通过分泌抗体发挥免疫效应。研究显示,B细胞可诱导非保护性体液免疫,并可通过减弱体内CD4+、CD8+T细胞反应,促进癌细胞转移[15]。本研究发现,LLC来源外泌体可诱导肺内B细胞聚集,可能与减弱T细胞反应有关,注射miR-3473b抑制剂后,肺内B细胞聚集情况显著减轻,提示通过抑制LLC来源外泌体miR-3473b表达,可显著降低B细胞在肺内聚集,有可能可增加癌症免疫治疗疗效。另本研究还发现,LLC来源外泌体可显著抑制肺成纤维细胞Nfkbid表达,并靶向激活NF-κB信号通路,提示NF-κB信号通路在LLC来源外泌体miR-3473b介导的免疫应答可能发挥重要作用。
综上所述,外泌体介导miR-3473b可能通过抑制肺成纤维细胞Nfkbid表达,靶向激活NF-κB信号通路,促进肺癌细胞肺内转移以及诱导肺内B细胞聚集。
