ADAMTS19在子宫内膜癌组织中的表达及其意义
2023-06-14王亚苹
石 巍 王亚苹 田 赟
子宫内膜癌(endometrial cancer,EC)是子宫内膜的上皮性恶性肿瘤,在我国的发生率仅次于宫颈癌[1]。以往子宫内膜癌治疗多采用手术及放化疗等[2]。近年来,关于该疾病的分子机制和靶向治疗逐渐成为研究热点。有研究表明含血小板反应蛋白的解聚素样金属蛋白酶(a disintegrin and metalloproteinase with thrombospondin,ADAMTS)家族共有19个成员[3],ADAMTS家族成员的异常表达与肿瘤的发生发展密切相关[4]。ADAMTS家族的成员,如ADAMTS2、ADAMTS5、ADAMTS12和ADAMTS15均已证实可作为抑癌或者促癌因子[5-8]。已有研究发现在胃肠道肿瘤中,ADAMTS19的表观遗传失活可以促进结直肠癌的转移和扩散[9]。然而,ADAMTS19在子宫内膜癌中表达及作用机制尚未报道。本研究拟通过检测子宫内膜癌组织中ADAMTS19的表达,并探讨其临床意义,为疾病靶向治疗提供一个新的思路[10]。
1 材料与方法
1.1 组织标本
选择2017年1月至2019年12月于我院就诊的子宫内膜患者39例,分别取新鲜癌组织和对应癌旁组织(距离癌组织大于3 cm),所有标本术后病理证实为子宫内膜样腺癌及癌旁组织,诊断至少由两名独立的经验丰富的病理学专家完成。根据子宫内膜癌诊断与治疗指南(2021年版)标准确定子宫内膜癌FIGO分期。入选患者中无应用激素类药物者、无合并其他恶性肿瘤者、无合并自身免疫性疾病者和未行放、化疗者。所有组织离体后,迅速置于-80 ℃冰箱保存,并取石蜡切片子宫内膜癌和对应癌旁组织各10例。本研究经医院伦理委员会批准,所有研究对象均自愿参加。
1.2 细胞
Ishikawa细胞购自中科院协和细胞库。
1.3 主要试剂
兔抗人ADAMTS19、p-STAT3抗体购自美国Abcam公司,免疫组化试剂盒购自中杉金桥生物科技有限公司,lipofectamine3000、Trizol试剂购自赛默飞世尔科技有限公司,qRT-PCR试剂盒购自上海东洋纺生物科技有限公司,CCK8试剂盒购自日本同仁公司,引物由北京擎科生物科技有限公司合成。
1.4 方法
1.4.1 免疫组化(IHC)检测ADAMTS19蛋白的表达将标本固定、脱水、石蜡包埋,以4 μm为标准连续切片,应用二甲苯脱蜡,酒精脱水,3%H2O2去除内源性过氧化物酶,柠檬酸抗原修复。然后根据SP法对石蜡标本进行一抗(兔抗人ADAMTS19抗体)、二抗孵育,显色,封片。光学显微镜下观察染色。用Image J软件评价染色强度,结果用阳性细胞的平均灰度值和阳性面积百分比表示。
1.4.2 qRT-PCR检测ADAMTS19 mRNA的表达量 qRT-PCR检测子宫内膜癌及癌旁组织中ADAMTS19的mRNA水平表达情况。用消毒过的钢珠在组织匀浆仪中研磨组织,按照Trizol的说明书逐步提取总RNA,利用NanoDrop检测样品中的RNA浓度和纯度,将RNA反转录合成cDNA,反应参数为:37 ℃ 15 min;50 ℃ 5 min;98 ℃ 5 min。SYBR荧光定量试剂盒中每孔20 μL,95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火60 s,65 ℃延伸15 s,共40个循环。qRT-PCR引物由北京擎科生物科技有限公司设计完成(表1)。用2-△△Ct法记录各样本表达量。
1.4.3 细胞培养与转染 用含有10%胎牛血清的高糖DMEM培养基培养Ishikawa细胞(简称“完全培养基”),置于37 ℃的 5% CO2培养箱中,根据lipofectamine3000说明书进行实验操作,共设计三条si-RNA,即si#1、si#2和si#3。24 h后提取总RNA,使用qRT-PCR检测ADAMTS19的mRNA表达,筛选干扰效率最好的一个的用于后续试验。
1.4.4 CCK-8检测细胞增殖 在96孔板中接种Ishikawa细胞5×103个/孔,加入100 μL培养液培养24 h后,分别用NC(对照组)和干扰效率最佳的ADAMTS19-siRNA进行转染。在转染0 h、24 h、48 h、72 h后,每孔加入CCK-8 10 μL,置于体积分数为5% CO2的37 ℃培养箱中2 h,于450 nm处检测光密度。
1.4.5 划痕实验检测细胞迁移能力 在6孔板中接种Ishikawa细胞4×105个/孔,加入培养液2 mL,待细胞完全贴壁后转染24 h,将ADAMTS19沉默组和NC组分别用200 μL枪头在6孔板底部划一条线,再垂直它划一条直线,PBS冲洗3次,添加新培养基,在划痕0 h、24 h和48 h时拍照记录。用Image J划线法计算迁移距离。
1.4.6 transwell检测细胞侵袭能力 4 ℃完全融化Matrigel胶,按照1∶8稀释混匀后在transwell上室每孔加入50 μL,37 ℃培养箱中过夜使其充分凝固成膜,加入200 μL培养基水化基质胶,37 ℃ 15 min后弃去培养基。收集转染24 h后的细胞,下室中加10%胎牛血清的培养基600 μL孵育48 h。固定、染色,显微镜下每个小室取3个视野的平均细胞数判读。
1.4.7 蛋白质印迹法(Western blot)检测ADAMTS19蛋白的表达水平 ADAMTS19 si-RNA组、NC组细胞培养48 h后弃去废液,PBS洗三遍后加入裂解液,充分混匀后置于冰上裂解30 min,12000 r/min离心10 min,收集蛋白上清。用BCA法检测蛋白浓度。上样时每孔中加蛋白50 μg,80 V初始电泳,后改为120 V。4 ℃恒流100 mA下,蛋白转膜90 min。5%脱脂奶粉中孵育2 h,加一抗(1∶1000,4 ℃过夜)、二抗(1∶20000,37 ℃ 90 min),ECL显色试剂盒显色,以β-actin为内参,用Image J软件分析目的蛋白的表达量。
1.4.8 Western blot检测p-STAT3蛋白的表达水平 ADAMTS19 si-RNA组、NC组细胞培养48 h后,按1.4.7中Western blot方法检测细胞中p-STAT3的表达。
1.5 统计学方法

2 结果
2.1 子宫内膜癌组织中ADAMTS19蛋白表达低于癌旁组织
ADAMTS19蛋白主要表达于细胞质中,显微镜下呈棕黄色、颗粒状分布。对子宫内膜癌组织和癌旁组织中ADAMTS19蛋白表达进行分析,结果提示,子宫内膜癌组织中ADAMTS19的平均表达水平为(1.05±0.68),对应癌旁组织为(3.52±1.56),差异有统计学意义(T=4.227,P<0.001)。
2.2 ADAMTS19 mRNA在子宫内膜癌组织中呈低表达
qRT-PCR检测39对子宫内膜癌组织和癌旁组织中ADAMTS19的表达情况,结果表明子宫内膜癌组织和癌旁组织中的ADAMTS19 mRNA表达分别为(0.02±0.03)和(0.11±0.16),ADAMTS19在子宫内膜癌组织中的表达显著低于癌旁组织,且差异具有统计学意义(图1,T=3.833,P<0.001)。
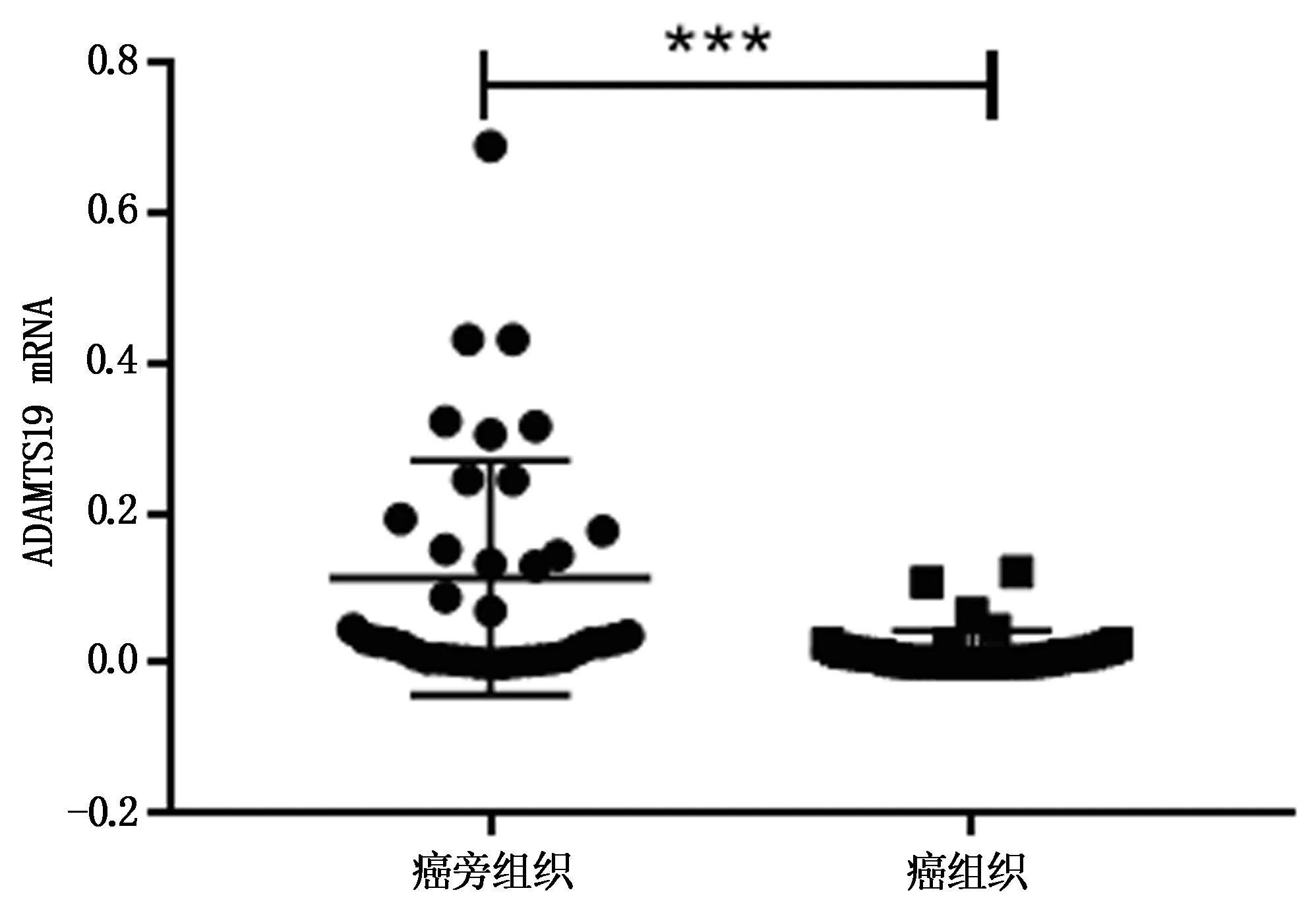
图1 ADAMTS19在子宫内膜癌组织及癌旁组织中的表达
2.3 ADAMTS19表达与子宫内膜癌临床病理特征的关系
以子宫内膜癌组织中ADAMTS19 mRNA表达中位值作为截断点,将患者分为高表达组(n=19例)和低表达组(n=20例)。对ADAMTS19表达与其临床参数的相关性进行分析。结果表明,ADAMTS19的表达水平与子宫内膜癌FIGO分期、淋巴结转移和肿瘤组织分化程度密切相关(P<0.05),而与患者年龄、BMI、是否绝经无明显相关(P>0.05),见表2。

表2 子宫内膜癌组织中ADAMTS19表达与其临床病理参数的关系/例
2.4 检测ADAMTS19 si-RNA转染Ishikawa细胞的最佳效率
实验组为转染ADAMTS19 si#1、si#2、si#3的三组细胞,阴性对照组为转染NC的细胞。转染24 h后NC组、si#1组、si#2组和si#3组中ADAMTS19相对表达量分别为(4.18±0.13)、(1.00±0.82)、(2.43±0.29)、(3.80±0.12)(表3),与阴性对照组相比,转染si#1的细胞中ADAMTS19的表达水平降低最为明显,且差异具有统计学意义(图2,T=35.630,P<0.001)。因此选择si#1用于细胞功能实验的相关研究。

图2 转染后各组细胞ADAMTS19表达情况

表3 不同组细胞中ADAMTS19的相对表达量
2.5 沉默ADAMTS19能显著促进Ishikawa细胞的增殖能力
用酶标仪在450nm处测定si#1组和NC组细胞的吸光度,结果提示:转染si#1的实验组中细胞的增殖能力较对照组明显增强,差异具有统计学意义(图3,P<0.001),提示沉默ADAMTS19可促进Ishikawa细胞的增殖能力。

图3 ADAMTS19对Ishikawa细胞增殖能力影响
2.6 沉默ADAMTS19能显著增强Ishikawa细胞的迁移能力
转染培养48 h后,si#1组划痕宽度明显比对照组宽度窄,差异有统计学意义(图4,T=7.706,P=0.002),表明沉默ADAMTS19可以促进Ishikawa细胞的迁移能力。
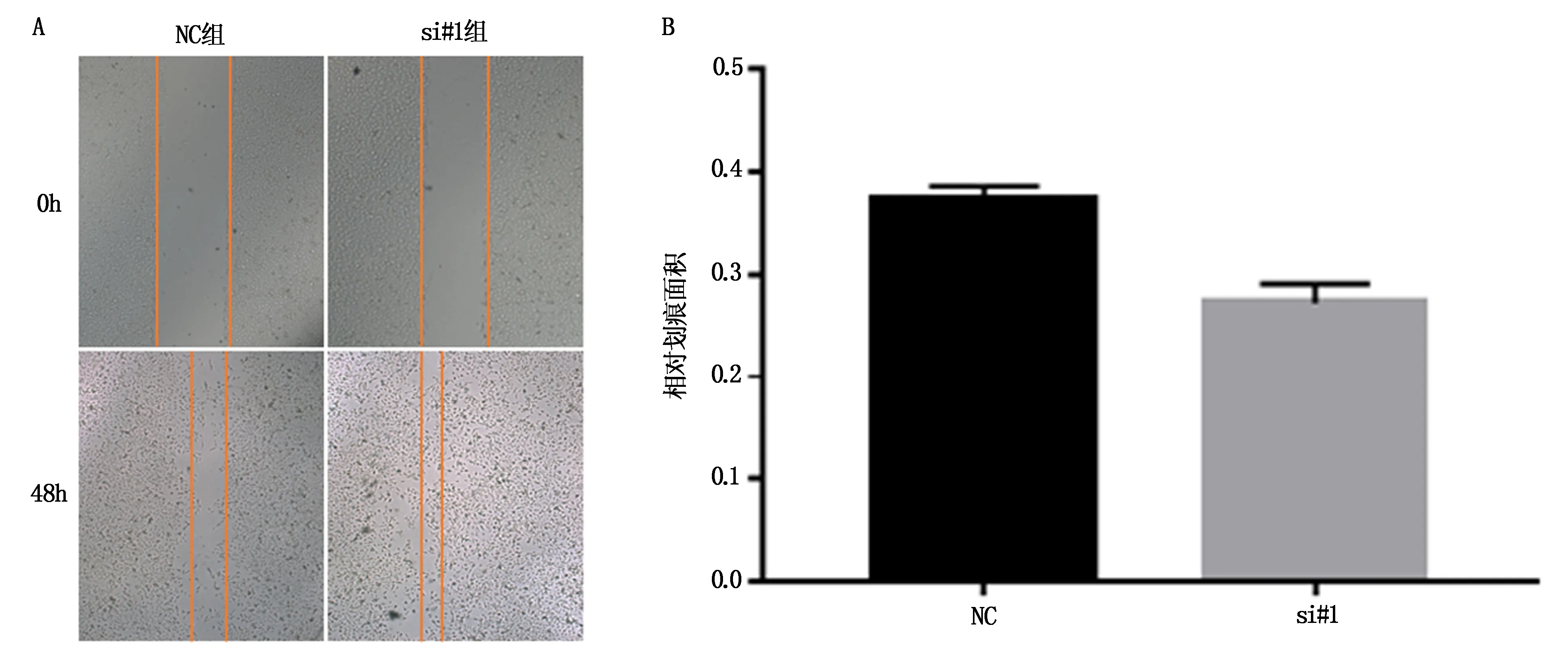
图4 ADAMTS19对子宫内膜癌Ishikawa细胞迁移能力的影响
2.7 沉默ADAMTS19能显著增强Ishikawa细胞的侵袭能力
与NC组比较,转染si#1的实验组穿膜细胞数量明显增加(图5);NC组与转染si#1的实验组细胞平均穿膜细胞数分别为(94.33±4.73),(908.33±33.61),差异具有统计学意义(T=41.550,P<0.001)。提示沉默ADAMTS19可以促进Ishikawa细胞的侵袭能力。
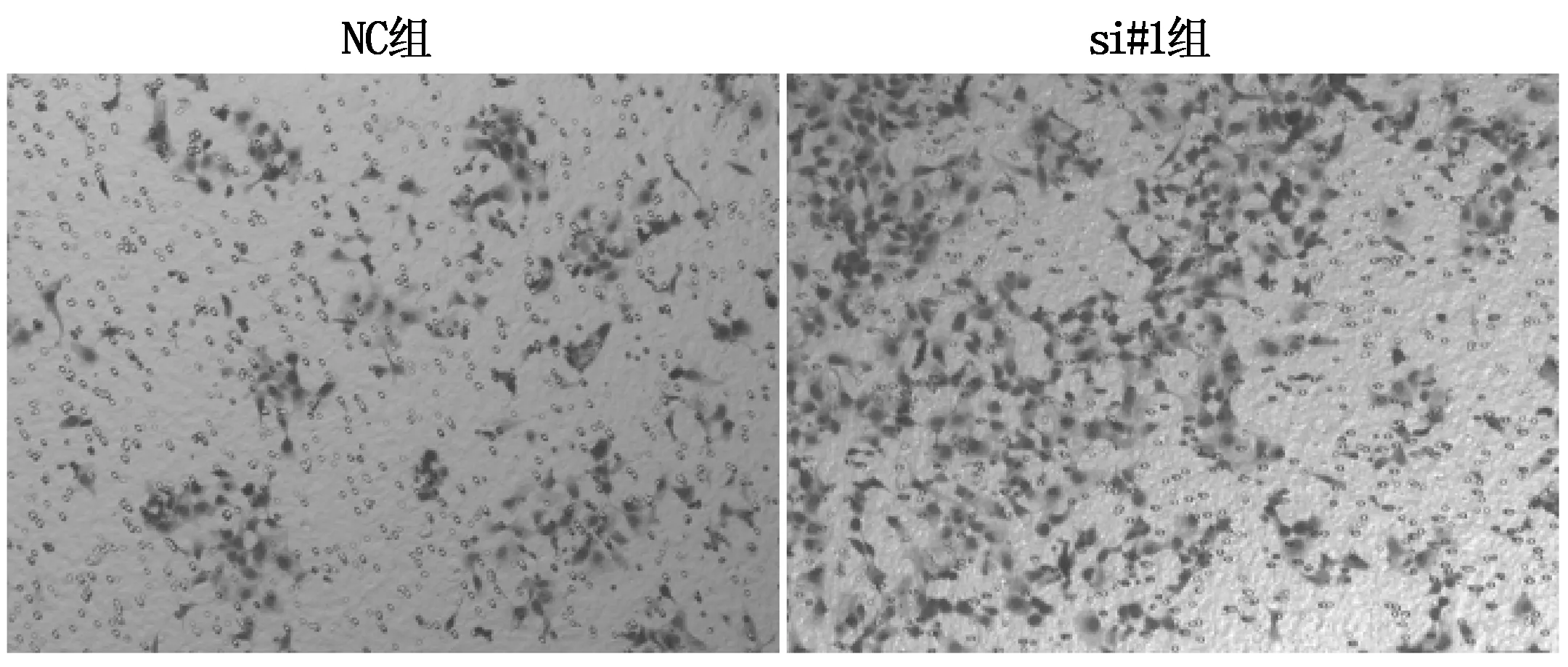
图5 沉默ADAMTS19后Ishikawa细胞侵袭情况(400×)
2.8 沉默ADAMTS19后p-STAT3蛋白表达明显增高
si#1组细胞中p-STAT3蛋白表达水平较NC组明显上调,差异有统计学意义(P<0.05,图6)。
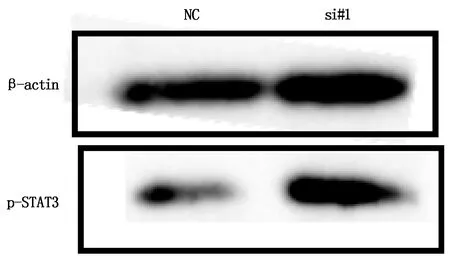
图6 沉默ADAMTS19后细胞中p-STAT3蛋白表达情况
3 讨论
研究表明[11],ADAMTS的家族成员由19个分泌型多结构域锌指金属蛋白酶组成,能参与机体多种过程,如凝血、关节炎和肿瘤发生发展等。已有文献报道[12-13],ADAMTS家族成员可以参与多种实体肿瘤的发生发展。ADAMTS家族的成员可作为癌症抑制因子或启动子,该家族已成为肿瘤研究的热点方向。研究证实:在结直肠癌中,ADAMTS的表达下调,且与不良预后相关[14];ADAMTS18的低表达与子宫内膜癌不良预后密切相关,且在体外具有抗肿瘤增生能力[15];ADAMTS5在口腔鳞状细胞癌中呈高表达,且与肿瘤病例分化程度有关,是潜在的口腔鳞癌治疗靶点[16]。然而,迄今为止,子宫内膜癌中ADAMTS19的表达情况及机制仍是未知的。
已有不少研究证实,多个表观遗传学相关分子与子宫内膜癌有关,相应的靶向药物也为治疗提供新的方法和手段,同时研究新的生物学标志物和探索靶点对子宫内膜癌的治疗有一定的指导意义。本文拟研究ADAMTS19在子宫内膜癌中的表达、生物学作用及其意义。通过qRT-PCR和免疫组化方法对临床样本分析结果证实:在子宫内膜癌组织中的ADAMTS19表达较癌旁组织中明显降低,提示低表达的ADAMTS19可能与子宫内膜癌密切相关;且通过分析发现ADAMTS19的低表达与子宫内膜癌患者FIGO分期、淋巴结转移和肿瘤组织的分化程度密切相关。体外实验表明:沉默ADAMTS19后Ishikawa细胞的增殖、迁移和侵袭能力明显增强,表明ADAMTS19在子宫内膜癌的形成与演变过程中起重要作用,参与了子宫内膜的恶性转化、侵袭和转移过程;提示ADAMTS19有望成为预测子宫内膜癌及监测肿瘤疾病进展的生物标志物,并为靶向治疗提供新思路。
细胞质中转录激活因子(STAT)蛋白家族包括七个转录因子,其中STAT3被认为是肿瘤发生发展的关键因素之一[17]。STAT3有两种存在形式,一种是以二聚体的形式存在,稳定且难以降解,另一种是磷酸化的STAT3(p-STAT3)[18]。在细胞质中,STAT3可以被Janus磷酸化为p-STAT3。p-STAT3进入细胞核后可以促进肿瘤细胞增殖,耐药,或抑制肿瘤细胞凋亡[19]。已经有研究证实,p-STAT3过表达与胃癌[20]、直肠癌[21]等患者的不良预后有关。本研究中,沉默ADAMTS19后p-STAT3蛋白表达明显上调,推测ADAMTS19可能是通过激活p-STAT3信号通路,引起p-STAT3蛋白表达增多,引起子宫内膜癌细胞的增殖与转移,从而促进子宫内膜癌的发展。
综上所述,本研究首次探讨ADAMTS19在子宫内膜癌中的表达及其意义,证实ADAMTS19在子宫内膜癌组织中呈低表达,沉默ADAMTS19可以促进Ishikawa细胞的体外增殖、侵袭和迁移;且ADAMTS19的低表达与子宫内膜癌患者FIGO分期、淋巴结转移和肿瘤组织的分化程度密切相关;提示ADAMTS19的表达下调与子宫内膜癌的发生与疾病进展密切相关。但本实验样本量相对较少,后续研究需加大样本量,并进一步从基因层面深入研究ADAMTS19在子宫内膜癌中的发病机制。
