脓毒症患者血清微小RNA-375和微小RNA-181b的变化及其与预后的关系
2023-06-14杨志勇刘维娜
杨志勇 刘维娜
脓毒症是由于宿主对感染的反应失调而引发的全身炎症反应综合征(SIRS),进一步会导致肾脓肿、肝脓肿或多器官功能衰竭,严重者会造成脓毒症休克甚至死亡[1-2]。目前临床多采用降钙素原(PCT)、超敏C反应蛋白(hs-CRP)或WBC计数等指标来评估脓毒症进展和预后,但这些指标不能兼顾脓毒症预后评估的敏感度及特异度,且对真菌、病毒等微生物引发脓毒症的诊断准确率较低[3-5]。因此,积极寻找脓毒症预后相关的分子标志物有利于临床医生制订合适的治疗方案和评价体系,可有效防止脓毒症患者的病情恶化。微小RNA(miRNA,miR)是一类内源性的保守非编码RNA,在转录后其水平通过与靶基因3’非翻译区(3’UTR)结合抑制其表达,调控细胞增殖、细胞凋亡、炎症反应等各项生命活动[6-8]。miRNA在脓毒症患者中的表达情况及其在脓毒症发生中的作用也有报道[9-10]。既往研究发现miR-181b和miR-375可参与炎症反应和炎性因子表达的调控[11-12],但其在脓毒症患者中的表达情况及对脓毒症的诊断和预后预测价值目前报道较少。本研究主要探讨脓毒症患者血清miR-375和miR-181b的变化及其与患者预后的关系。
对象与方法
1.对象:2020年1月~2021年6月在我科治疗的脓毒症患者118例作为试验组,其中肺部感染51例,腹腔感染37例,颅内感染23例,泌尿系统感染7例。另选择同期在我院体检的健康志愿者87例作为对照组。试验组纳入标准:(1)符合《中国脓毒症/脓毒症休克急诊治疗指南(2018)》[13]中脓毒症诊断标准;(2)年龄≥18岁。排除标准:(1)严重脓毒症伴器官功能不全;(2)年龄<18岁;(3)恶性肿瘤、急性冠状动脉综合征或脑梗死;(4)免疫功能缺陷或半年内使用免疫抑制剂;(5)妊娠或哺乳期;(6)合并其他恶性血液病或血液传染病。其中试验组男65例、女53例,年龄19~76岁,平均年龄(58.38±13.29)岁;对照组男45例、女42例,年龄18~74岁,平均年龄(56.92±10.78)岁。两组受试者性别、年龄比较差异均无统计学意义(P>0.05),具有可比性。根据脓毒症诊断标准将试验组患者分为一般脓毒症组(32例)、严重脓毒症组(47例)和脓毒症休克组(29例)。一般脓毒症:患者出现因感染导致的全身炎症反应综合征,伴高热、寒战、咳痰等症状,进而引起水电解质紊乱、酸碱度失衡等;严重脓毒症:脓毒症伴器官功能障碍,出现脓毒症导致的低血压、乳酸水平升高、凝血障碍等症状;脓毒症休克:伴有因脓毒症导致的低血压,且经液体治疗后无法逆转。本研究通过我院伦理委员会审核批准,所有受试者或家属均签署知情同意书。
2.方法:收集所有受试者年龄、性别等一般资料。采用逆转录聚合酶链反应(RT-PCR)检测miR-375和miR-181b的表达水平:采集受试者清晨空腹静脉血5 ml,以3 000 r/min离心10 min,提取血清,于-80 ℃冰箱保存或立即采用TRIzol试剂提取总RNA,当RNA纯度处于1.8~2.1时反转录为cDNA;取1 μg总RNA反转录为cDNA。采用RT-PCR检测miR-375和miR-181b表达,严格按照SYBR Green PCR试剂盒说明操作。以U6为标准采用2-ΔΔCt计算miR-375和miR-181b的表达水平。
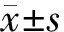
结 果
1.试验组和对照组受试者血清miR-375和miR-181b表达水平比较:试验组患者血清miR-375和miR-181b表达水平均低于对照组(0.71±0.18比1.25±0.29,0.63±0.16比1.13±0.21,t=10.062、9.129,P均<0.001)。
2.不同严重程度脓毒症组患者血清miR-375和miR-181b表达水平比较:3组患者血清miR-375和miR-181b表达水平比较差异均有统计学意义(P<0.001)。严重脓毒症组患者血清miR-181b表达水平低于一般脓毒症组,脓毒症休克组患者血清miR-375和miR-181b表达水平均低于一般脓毒症组和严重脓毒症组(P<0.05)。见表2。
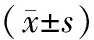
表2 不同严重程度脓毒症组患者血清miR-375和miR-181b表达水平比较
3.血清miR-375和miR-181b对脓毒症患者预后的预测价值:ROC曲线分析结果显示,miR-375预测脓毒症预后ROC曲线下面积(AUC)为0.819,最佳截断值为0.653,对应敏感度、特异度分别为75.0%、81.6%;miR-181b预测脓毒症预后AUC为0.849,最佳截断值为0.681,对应敏感度、特异度分别为91.3%、76.3%;二者联合预测脓毒症预后AUC为0.867,对应敏感度、特异度分别为82.5%、84.2%(P<0.001)。见图1。
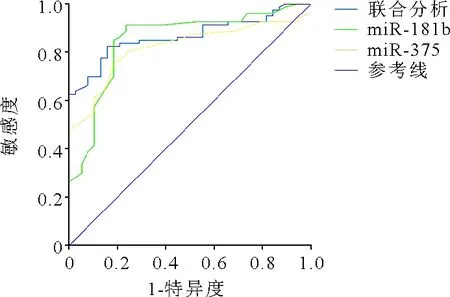
图1 血清miR-375和miR-181b评估脓毒症患者预后的ROC曲线
4.血清miR-375和miR-181b与脓毒症患者28 d生存率的关系:根据血清miR-375和miR-181b的中位数(0.67、0.69)将试验组患者分别分为miR-375高表达组(67例)和miR-375低表达组(51例)、miR-181b高表达组(69例)和miR-181b低表达组(49例)。miR-375高表达组累积生存率显著高于miR-375低表达组(83.59%比47.06%;χ2=17.693,P<0.001);miR-181b高表达组累积生存率显著高于miR-181b低表达组(82.61%比46.94%;χ2=16.698,P<0.001)。
讨 论
miRNA与靶基因mRNA的3’UTR不完全结合,在转录后水平抑制靶基因表达,参与调控细胞增殖、细胞分化、细胞凋亡和炎症反应等,与肿瘤、心力衰竭、心肌肥大、糖尿病及各种炎症反应性疾病密切相关[14-16]。Li等[16]研究发现脓毒症患者的miR-218表达水平明显低于健康对照组,并随着症状的恶化而逐渐降低;因脓毒症死亡患者的miR-218表达水平最低;从晚期脓毒症患者的Treg细胞中发现miR-218表达水平显著下降。Li等[17]研究发现miR-186可通过PTEN/PI3K/AKT/P53信号通路改善脓毒症引起的肾损伤。周巧等[18]研究结果发现miR-21在脓毒症患者血清中表达水平显著上调,且与急性生理学和慢性健康状况评分系统Ⅱ(APACHEⅡ)评分呈显著正相关,该结果表明miR-21与脓毒症严重程度有一定相关性。miRNA对于脓毒症的调控作用可通过直接靶向细胞炎性因子如IL-6、肿瘤坏死因子(TNF)-α、IL-12等,或通过介导信号通路调控炎症反应而影响脓毒症进展等。
MiR-181b作为miR-181家族成员,参与机体各项生命活动,如其可通过靶向a1-岩藻糖转移酶(FUT1)基因影响结直肠癌的增殖、迁移、侵袭和血管生成[19];其既可作为各种肿瘤的早期诊断指标[20],也可作为不同疾病预后的分子标志物[21]。目前有多项研究证实miR-181b参与炎症反应进程:Lu等[22]发现miR-181b-5p mimic可抑制脂多糖(LPS)刺激的BV2小胶质细胞中促炎介质的mRNA和蛋白表达,包括TNF-α、IL-1β和单核细胞趋化蛋白(MCP)-1。miR-181b-5p通过抑制小鼠海马神经炎症来减弱早期术后认知功能障碍(POCD)。徐媛等[23]发现miR-181b在脓毒症急性肺损伤大鼠肺组织中的表达水平下调,且与炎性因子表达呈负相关。综上,miR-181b在炎症组织中低表达,其表达下降可促进炎症反应。本研究结果发现与对照组相比,试验组患者血清miR-181b表达水平下降,且其表达水平与脓毒症的严重程度有一定的相关性。
同样,miR-375也参与调节机体包括炎症反应的各项生命活动。Sheng等[24]发现脓毒症患者miR-375表达水平下降,但miR-21表达水平升高,且二者呈负相关。miR-375异位表达可减少小鼠中败血症粒细胞标记的CD11b+髓源性抑制细胞(Gr1+CD11b+MDSC)数量;分子生物学研究显示,miR-375可阻断JAK2-STAT3通路,从而调节参与调控晚期脓毒症的miR-21水平。本研究发现脓毒症患者血清miR-375表达水平下降,且与脓毒症的严重程度有关,与Sheng等[24]的研究结果相符。我们进一步探究血清miR-181b和miR-375对脓毒症患者预后的预测价值,结果发现血清miR-375、miR-181b及二者联合预测脓毒症预后的AUC分别为0.819、0.849、0.867。生存曲线分析结果显示miR-375、miR-181b高表达组的累积生存率显著高于对应的低表达组。综上,miR-375、miR-181b在脓毒症患者血清中低表达,且可作为脓毒症患者预后的预测指标。
