微生物电解池CO2电甲烷化的影响因素及电子中介体角色探究
2023-06-13甄广印王佳懿陆雪琴邱博然
甄广印,王 娜,王佳懿,陆雪琴, 5,邱博然
(1. 华东师范大学 生态与环境科学学院, 上海市城市化生态过程与生态恢复重点实验室, 上海 200241; 2. 上海有机固废生物转化工程技术研究中心, 上海 200241;3. 上海污染控制与生态安全研究院, 上海 200092;4. 自然资源部大都市区国土空间生态修复工程技术创新中心, 上海 200062;5. 崇明生态研究院, 上海 200062)
0 引 言
工业革命以来,各国政府为大力推动社会经济发展,主动通过限价、税收减免或直接补贴等市场干预手段或财政激励措施推动煤炭、石油等化石燃料的生产和使用[1],然而,化石燃料的燃烧产生了大量的二氧化碳(CO2)等温室气体,加剧温室效应,导致全球气候变化。2021年全球碳排放总量大约102.85亿t,中国排放27.77亿t占了27%,我国作为CO2排放大国,提出了更加有力的政策和措施,CO2排放力争于2030年前达到峰值,2060年前实现碳中和[2]。因此,优化能源结构体系,探索CO2的转化、再利用和清洁能源生产的新技术,受到了研究者们的广泛关注。
近年来,微生物电解池(Microbial Electrolysis Cell, MEC)作为一种有效利用CO2进行回收能源和资源的新兴技术,已经先后到全世界的普遍关注,并展现出巨大的、广阔的发展潜力[3-4]。CO2电甲烷化是MEC应用中的一个重要方向,使用可再生的电力驱动,将CO2还原成高附加值的燃料甲烷(CH4)[5]。本文对MEC的基本原理、构造及性能影响因素展开讨论,并简单阐述了电子穿梭体在其中的重要作用,以期实现CO2的高效甲烷转化,并为“双碳计划”提供理论基础。
1 CO2的捕获与高值资源利用
CO2的捕集、利用和封存技术是实现温室气体减排的重要技术之一,也是践行低碳发展战略的重要技术选择[3]。作为一种稳定的化合物,CO2反应活性很低。在一定条件下,可以借助外力并引入适宜的催化剂,打破CO2的反应惰性,对CO2分子中唯一的碳氧双键进行断键活化,将CO2转化为可被利用的有机质或高附加值的含碳化合物,变“废”为“宝”[3-4]。目前,转化利用CO2的技术方法种类繁多(图1),根据催化剂种类的不同归纳为两大类,化学法和生物法。实际工程应用中,从处理效果、成本、可持续性等多角度出发,往往需要两种或两种以上技术方法结合使用[4]。
近年来,MEC作为一种有效回收能源和资源的新兴技术,已经先后到全世界的普遍关注,并展现出巨大的、广阔的发展潜力[3-4]。1911年,首次发现了电活性微生物具有传递电子的能力,生物电能和生物电子等基础概念的提出,促进了微生物电解池技术的发展[7],其作为一项崭新的技术,以生物学、电化学、生物物理学等基础学科为基石,兼顾环境与能源需求,将CO2转化为经济可行的燃料和原料[3-4, 7]。随着研究的不断深入,科学技术的创造性发展,越来越多的研究学者将MEC与其他技术耦合,大大扩展了MEC的应用范围,如污水处理、沉积物产电、产品生物合成、污染生物修复等[8-9]。
MEC是通过对其施加外电压,打破某些反应的热力学限制,并以微生物作催化剂,驱动不可自发反应的发生,生成有价值的燃料或原料[3-4]。通常情况下,根据操作条件和底物的不同,阳极主要发生有机物的降解或水解,同时释放电子和游离的质子(H+),电子通过外电路流向阴极,微生物则是从固体阴极上捕获电子,一部分用于维持自身新陈代谢,另一部分则被传递至最终电子受体(如CO2、硝基苯和对氯苯酚等),发生还原反应生成目标产物(H2、CH4、甲酸和已醇等)[3-4, 9-10]。MEC体系中,阳极发生氧化反应释放电子,阴极则获得电子发生还原反应[9]。在整个反应进行的过程中,基质中的微生物及氧化还原活性物质充当电子载体,将电子从电子供体传递给电子受体,形成闭路循环产生电流[4-5]。MEC的高效资源回收过程主要包括电产氢(Electrohydrogenesis)和电产甲烷(Electromethanogenesis)[8, 11]。其中,电产甲烷是借助外电压提供的能量,富集在阴极的微生物将有机污染物或CO2还原成甲烷的新技术[12](图2)。以阳极电解水为例,产甲烷时阳极和阴极发生的氧化还原半反应分别如式(1)和(2)。
阳极:

Ean=0.820 Vvs. SHE
(1)
阴极:

Ecat=-0.244 Vvs. SHE
(2)
由上述反应式可以看出,该反应并不能自发进行。通过计算得出,在中性条件下,需提供大于-0.244 Vvs.SHE的阴极电势,打破能量壁垒,激发反应的进行。
CO2电甲烷化是MEC应用中的一个重要方向,使用可再生的电力驱动,将CO2还原成高附加值的燃料甲烷(CH4)[5]。与电产氢技术的终产物氢气相比,甲烷的热值更高。目前,运输、储存甲烷的相关基础设施的也更加健全[3, 8]。这项技术既充分利用了空气中过剩的CO2,又合成了清洁的高热值能源,为全球实现“零碳经济”开辟新道路。不过,相比于传统的借助重金属电极电化学还原CO2产甲烷,利用MEC还原CO2产甲烷具有可再生、环保等特性;但一直存在的效率过低的技术瓶颈,也限制了该技术的规模化应用[5, 13]。在此背景下,进一步开展CO2电甲烷化的相关基础理论研究,阐明CO2电甲烷化过程中的相关机制过程,以及对可能影响CO2电甲烷化效率的相关因素进行探索都是十分有必要的[14-16]。
2 影响MEC进行CO2电甲烷化的基本因素
CO2电甲烷化的系统运行性能受很多因素影响,主要包括接种物、反应器构型、外加电压、电极材料等[9, 12, 20](见表1)。
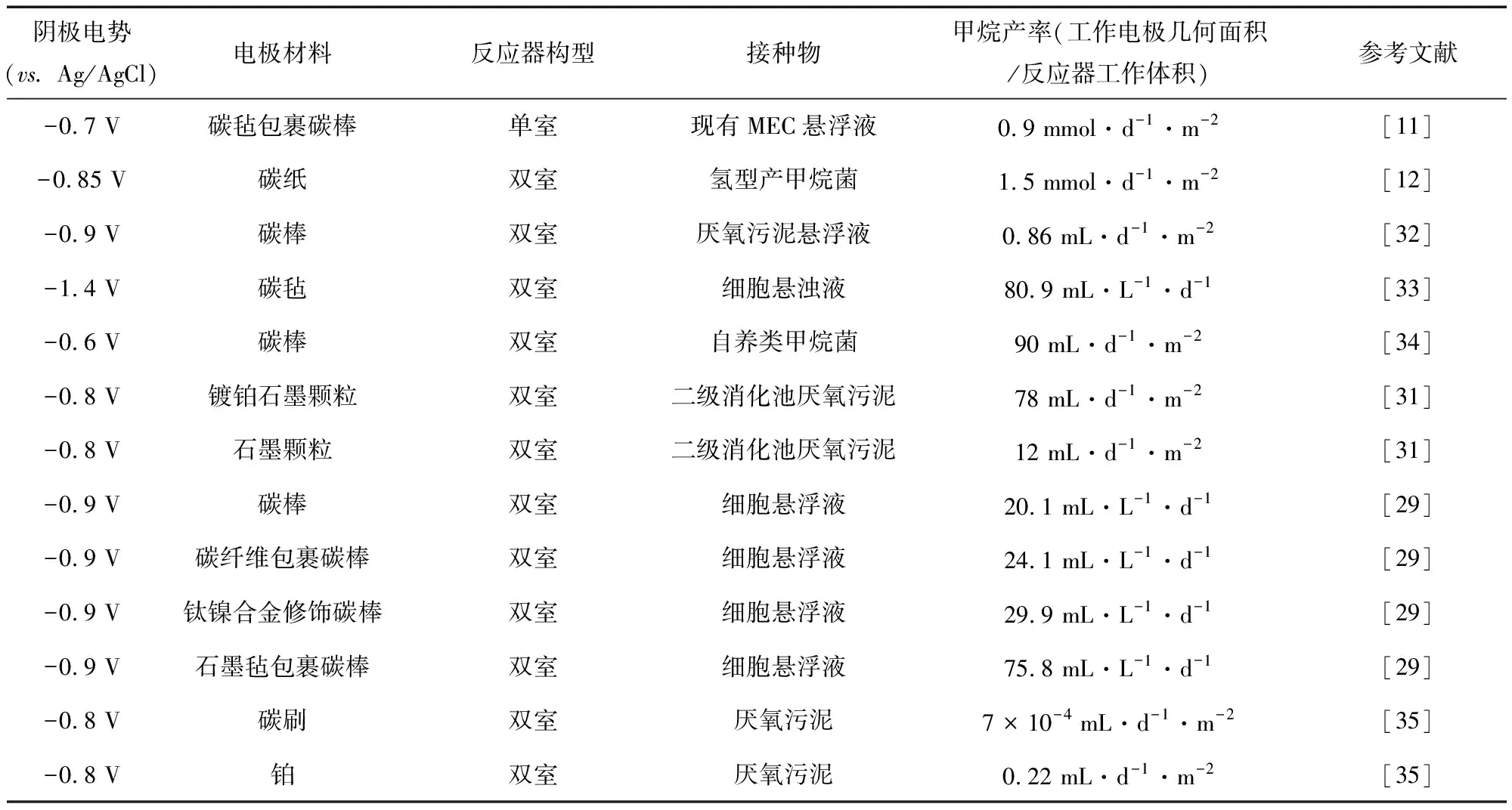
表1 产甲烷阴极电极材料性能综述Table 1 Overview of the performance for methane-producing in terms of cathodes electrode material
2.1 接种物来源
接种物的来源、活性及富集驯化方法对MEC系统的启动、运行及能量回收具有重要影响[4-5, 11, 19]。一般情况下,可以准确定位纯菌的关键酶、细胞色素,有利于机理研究,如胞外电子传递机制等[21-22]。与纯菌相比,混菌含有更复杂的菌群种类以及更稳定的微生态系统,对实际污水的复杂体系适应性更强,生命周期也相对较长,此外,混菌的驯化培养成本也相对较低[10]。对MEC来说,接种物的来源非常广泛,包括运行稳定的MFC,上流式厌氧污泥床、厌氧污泥、底泥或者从运行结束的MEC中去取出的生物阴极等,接种物的活性将直接影响CO2电甲烷化的效率[5, 20, 23]。
2.2 反应器构型
根据有无交换膜分隔阳极室和阴极室,MEC的构型被分为双室MEC和单室MEC两大类,双室MEC与单室MEC相比,多了交换膜将两个腔室分开[3, 24],不同的反应器构型将会影响CO2电甲烷化的效率。其中,常用的交换膜种类包括阴离子交换膜(Anion Exchange Membrane,AEM)、阳离子交换膜(Cation Exchange Membrane,CEM)和质子交换膜(Proton Exchange Membrane,PEM)[22, 24]。然而Rozendal等[24]研究发现,相较于阳离子交换膜存在的双室MEC系统,使用单室MEC,可大幅度减小pH的跨膜梯度差,电势损失更低,故而相比双室MEC,单室MEC的构型不仅可以节省成本,而且两腔室高效地基质交换,可以有效减小电解池的欧姆电阻、提高转化率,从而使得CO2电甲烷化的效率更高。
不过单室MEC的阳极会通过电解水或氧化有机物释放大量H+,导致阳极周围基质酸化,若没有离子交换膜的分隔,两腔室电解液之间的交换,将破坏产甲烷菌的生长环境,导致体系的崩溃,故而单室MEC-CO2电甲烷化长期的运行性能不如单室MEC更加稳定,而双室MEC中离子交换膜的选择透过性也有效避免了阳极室和阴极室的气体扩散,更加容易获得成分简单的混合气,如甲烷[5, 14]。单双室MEC各有特点,应根据实际需要加以选择。
2.3 外加电压
外加电压作为整个系统运行的驱动力,一般由恒电位仪或稳压器提供[25]。CO2转化为甲烷的反应在常温常压条件下,并不能自发进行,需要提供至少-0.244 Vvs.SHE电压[8]。然而,实际中的反应器系统的内阻仍十分显著,包括电荷转移内阻、欧姆电阻、扩散内阻及电流流动过程中的电阻等。因此,提供给CO2电甲烷化的外加电压一般大于-0.244 Vvs.SHE,但这并不意味着电压值越高反应器性能越好,较高的电压值会促进其他并不需要的副反应发生,甚至导致微生物细胞破裂、新陈代谢活性降低从而衰落至死亡[3, 25]。Choi等研究在厌氧环境下,改变外加电压(0.5、0.7、1.0、1.5 Vvs.SHE)对甲烷产量的影响,并发现当外电压从-0.5 Vvs.SHE升高到-1.0 Vvs.SHE时,甲烷产量从368.6 mL CH4/g COD葡萄糖升至 408.3 mL CH4/g COD葡萄糖;而当电压继续升高到-1.5 V时,甲烷产量却随之降到371.0 mL CH4/g COD葡萄糖,讨论分析认为-1.0 Vvs.SHE是电活性菌生长繁殖最适宜的电压条件[26]。
此外,有研究表明外加电压通过加速挥发性脂肪酸的转化,改变电解液的pH,为产甲烷菌提供适宜的生长环境[27]。此外,Florian等综述分析得出阴极电位是影响胞外电子传递机制的重要因素,然而,实际上在CO2电甲烷化过程中,产甲烷的相关机制相互影响的内在机理目前还不清楚[28]。以氢型产甲烷菌(Hydrogenophilicmethanogenic)为接种菌,研究生物阴极产甲烷的性能和机制得出,阴极施加电压小于-0.65 Vvs.SHE时,直接电子传递和以氢气为中介体的间接电子传递传递都会参与CH4的生成,但随着外加电压增大,间接电子传递逐渐趋于主导地位[11, 22, 28]。
2.4 电极材料特性
阴极和阳极是MEC中不可或缺的两部分,电极材料的性能及成本直接影响反应器的运行效果和规模[29]。在CO2电甲烷化系统中,阳极充当辅助电极,阴极则是工作电极,外加测量电池电动势的参比电极,构成三电极体系。其中,辅助电极的主要作用是与工作电极形成电流通路,对电极材料的一般要求是电阻小,不易发生极化,化学性质稳定;通常选用铂电极、碳电极等做辅助电极[30]。工作电极作为产甲烷菌生长附着的载体,既要符合生物相容性易于微生物富集生长,又要同时兼顾电极材料本身的特性对甲烷回收效率的影响。目前,金属电极和碳基电极因导电性高、电阻小等特性被广泛应用于MEC电产氢和电产甲烷的研究[29]。Luo等研究发现,与纯石墨刷电极相比,采用镀铂不锈钢网做电极时,体系的甲烷产量提高了近1.7倍,电子回收效率和能量回收效率也都大幅提高[15]。
惰性贵金属的化学性质不活泼、电阻小及其导电性好,使其成为一类理想的电极材料,但高昂的生产成本限制了这类电极材料的推广使用[27]。与之相比,碳基材料的优点:生物兼容性好、比表面积高、化学性质稳定、成本低廉,也使其一直是MEC研究中电极材料的首选。然而,有研究发现,以纯的碳基材料作阴极,即使在开路情况下也有电流产生,甚至库伦效率超过100%[25, 27]。由于传统碳基材料存在电阻大等缺陷,这也促使新型高导电极材料的研发与应用,特别是金属-碳基耦合材料的研发。Siegert等团队开展的几组研究阴极电极材料的实验表明,将石墨电极设为对照组,镀铂石墨电极的甲烷产量将达到了峰值(250±90) nmol·cm-3·d-1[31]。
3 电子穿梭体在MEC电甲烷化中的重要角色
3.1 电子穿梭体的分类
根据是否由微生物自身分泌,电子穿梭体被分为内源性电子穿梭体和外源性电子穿梭体[36-37]。目前,许多由微生物自身分泌的内源性电子穿梭体被人们所熟知,有γ变形假单胞菌属分泌的吩嗪类物质[38]、希瓦氏菌属分泌的黄素类物质[39]、假单胞菌属分泌醌类物质[40]、地杆菌属分泌的溶解酶和胞外细胞色素等[41]。这些内源性穿梭体多数是根据其分泌物或聚集物推断而来,对于MEC电甲烷化体系中内源性电子穿梭体的含量,目前的技术手段还无法做出准确的鉴定,因此,外源性电子穿梭体引起了研究者们的广泛关注,通过人为调控其在反应器中的添加量、添加方式及添加周期等达到最优的促进效果[36]。
常见的外源性电子穿梭体分为人造介体和天然的氧化还原介体[38-39]。人造电子穿梭体的最大优势在于它的非特异性,通过有效的分子设计几乎可以使所有的革兰氏阴性菌接受电子,但人造电子穿梭体的设计生产成本过高,以及用完后在环境中的积累、扩散等风险,使得当下有关人造介体的研究寥寥无几[38]。天然的氧化还原介体多数是从环境中运行的MEC中发现的,这些环境特点通常是有机碳浓度较低,而且被复杂的有机物、腐殖酸及大量含硫化合物围绕着,这些氧化还原介体明显加速了细菌与电极之间的电子传递效率[16]。腐殖酸、半胱氨酸是目前发现的两种较为典型的天然氧化还原介体,但两种物质发挥作用的机理还需进一步的研究分析[37]。
3.2 核黄素在胞外电子传递中的作用
近年来,基于对希瓦菌属(Shewanellasp.)这种模式菌属的生理学和遗传学的认知,并结合其在MEC电甲烷化中的行为表现,研究证实黄素(图3(a))是一类非常重要的内源性电子中介体,并在MEC电甲烷过程中发挥了促进作用,影响微生物之间的直接电子传递。其中,Von Canstein等研究发现,很多希瓦氏菌能利用黄素单核苷酸(FMN)和核黄素(Riboflavin,RF)来介导不溶性三价铁氧化物还原[39]。Marsili等发现在培养不同菌株的希瓦氏菌的过程中均有不同量的黄素积累,并以黄素为电子介体将胞外电子传递至电极表面[22]。黄素腺嘌呤二核苷酸(FAD)和黄素单核苷酸是黄素酶的辅助因子,能够从各种各样的官能团接受电子对,在生物系统中催化许多氧化还原反应[42]。核黄素是黄素酶中起氧化还原作用的主要活性成分(图3(b)),可以在电子供体和受体之间双向传递电子[43]。在核黄素作为S.oneidensisMR-1呼吸链中的电子传递介质,参与了70%~90%的电子传递过程,特别是在远离电极和其他可溶性电子受体的细胞中[22]。更多的研究也证明,将核黄素作为一种高效的外源性电子穿梭体加入到生物膜反应器中,扩散后与细胞色素c结合表现出较高的电化学活性,提高体系的电子传递效率[44]。通常情况下,在MEC中,微生物首先从电极上捕获电子,经过微生物本身的代谢后再释放电子给CO2,将CO2还原成CH4,完成一次电子传递;核黄素被加入电解液后,将在电极与微生物间,微生物与CO2之间充当电子载体,发生可逆的氧化还原反应,大大降低远距离传输造成的能量损失,节约生产成本[36-37, 43](图4)。
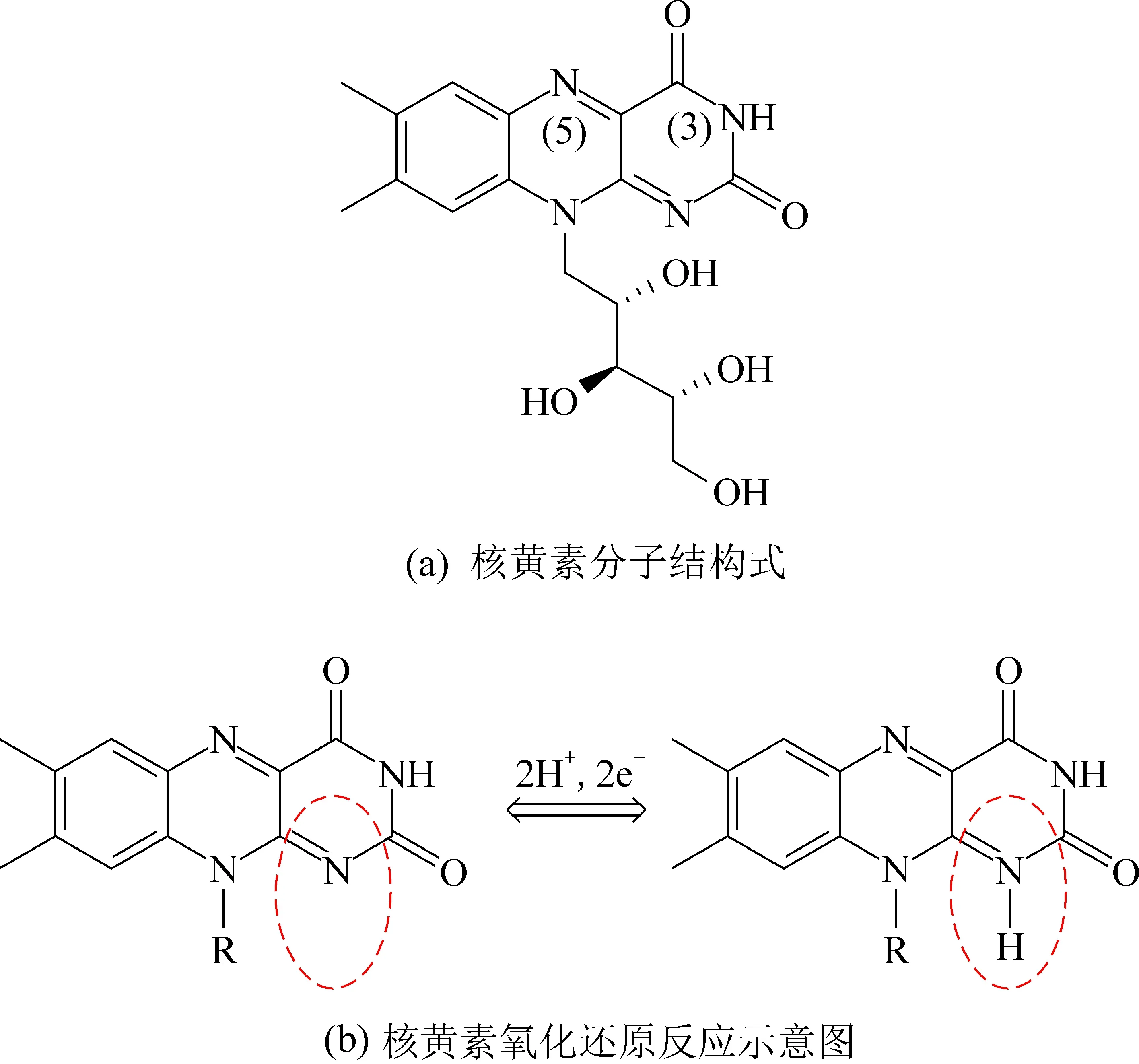
图3 核黄素分子结构式及氧化还原反应示意图Fig. 3 Structural formula of riboflavin molecule and redox reaction diagram
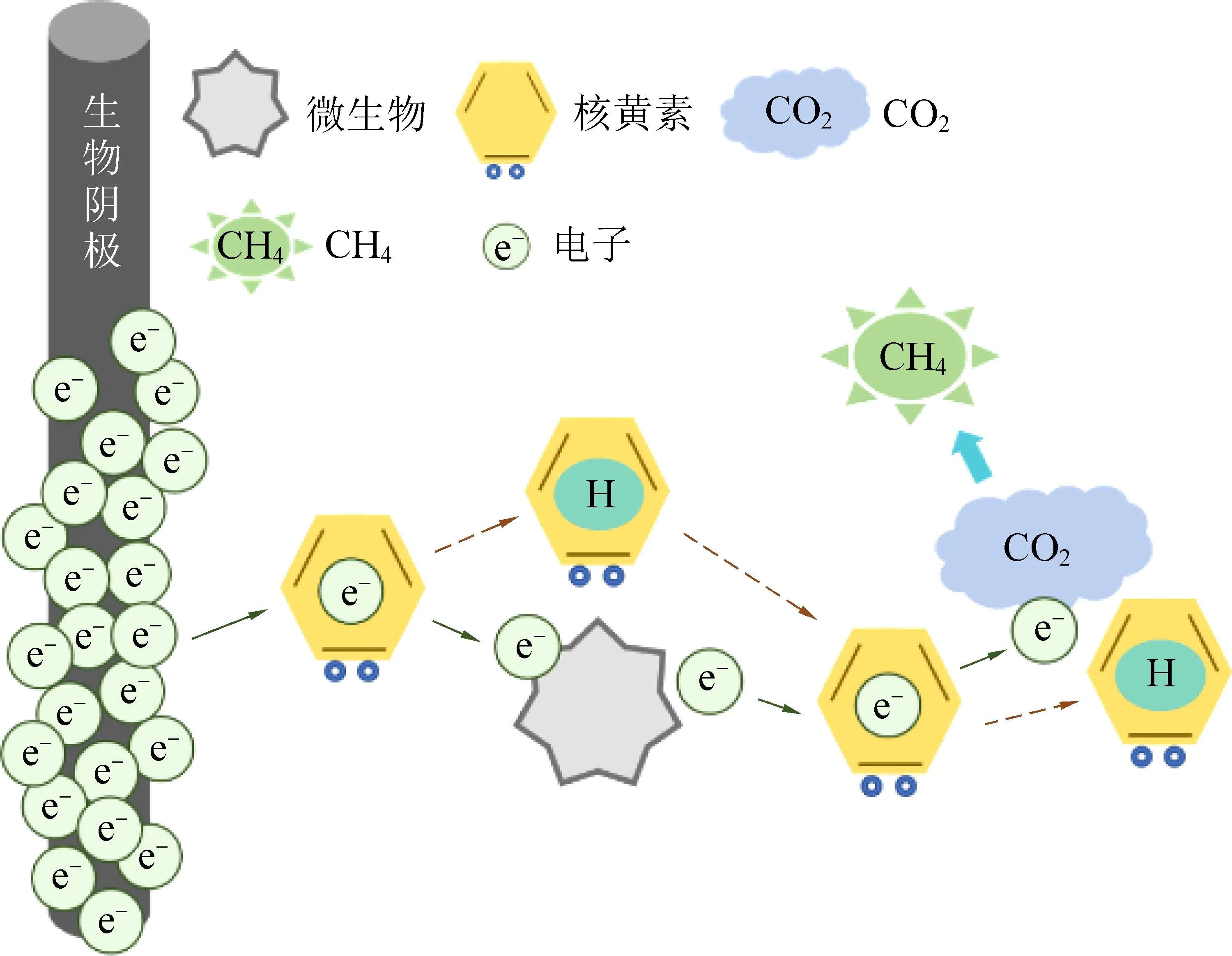
图4 核黄素介导电子传递示意图Fig. 4 Schematic diagram of riboflavin as shuttle to mediate electron
3.3 核黄素在生物膜形成过程中的作用
与单个浮游的细胞或微生物相比,成熟的生物膜对外界环境变化的适应性更强、对高浓度的污染物的耐受性更高,生命周期也相对更长,因此大部分微生物都以生物膜的形式存在[45]。生物膜是由微生物及其自身分泌的胞外聚合物组成的一种结构和形态上稳定的微型生态系统。微生物镶嵌在聚合物的基质中,随后在电极材料表面逐渐形成生物膜[39, 45]。核黄素是电甲烷菌生长发育的重要影响因素,可以极大程度上促进电甲烷菌生物膜的快速生长发育,其发育形成过程大致可分为[46]:(1)细胞或微生物聚集,吸附在材料表面;(2)形成微生物群落,分泌胞外聚合物;(3)群落向外扩展,结构变复杂;(4)生物膜成熟;(5)成熟生物膜脱落。在生物膜反应器中,生物膜的形态结构、理化性质、抗性等是影响反应器运行效能的关键因素[37, 44]。微生物自身的代谢途径及微生物间的相互作用方式决定了生物膜的特性,已有研究证明核黄素作为氧化还原穿梭体参与调控微生物代谢途径,胞外聚合物的分泌受到影响[36-37, 47]。Hoffman等曾在发表的一篇文章中指出,保持妥布霉素在亚抑制浓度,能有效促进铜绿假单胞菌生物膜的发育成熟[47],进一步探索核黄素的浓度对生物膜的影响研究发现,浓度较低时,促进微生物之间复杂的相互作用,有利于生物膜的形成;过高的浓度将起到破坏作用,阻碍生物膜的发育成熟[48]。
4 结语与展望
化石燃料大肆燃烧及温室气体的大量排放,导致了全球生态环境恶化与能源危机,MEC-CO2电甲烷化作为一种降碳技术被广为研究。迄今为止,有关优化关MEC-CO2电甲烷化各项实验参数的研究也层出不穷,外加电压、阴极材料、反应器大小及形状等也在实验中不断完善。不过MEC-CO2电甲烷化依然面临较多的技术瓶颈,如电产甲烷微生物的驯化时间较长、胞外电子传递机制尚不明确和电极材料的成本较贵等,且现阶段利用MEC-CO2电甲烷化的技术仍然局限在理论研究阶段,并多以实验室概念研究为主,故亟需进行长期、大规模实验来模拟真实的工业化生产过程。同时,需要对MEC系统中CO2电产甲烷过程中的微观原理进行进一步解释,如胞外电子传递机制、电子穿梭体如何影响微生物的电子传递效率,进而优化整个MEC-CO2电甲烷的反应过程,为其工业化与大规模生产提供理论支持与技术突破。
