太阳能热催化二氧化碳转化机理研究进展
2023-06-13马丹妮颜天天GUENELOUGOUBachirou
帅 永, 马丹妮, 颜天天, 张 烁, GUENE LOUGOU Bachirou, 张 昊, 王 伟
(1. 哈尔滨工业大学 能源科学与工程学院, 黑龙江 哈尔滨 150001; 2. 哈尔滨工业大学 电气工程及自动化学院, 黑龙江 哈尔滨 150001)
0 引 言
随着社会工业化程度和生活水平的显著提升,大气中的二氧化碳浓度也随之逐年攀升。将大气环境中的二氧化碳重新转化为高品位的可再生能源是可持续和环境友好技术的重要发展方向,在近年来获得了世界各国的广泛关注。太阳光可直接或间接地用于打破二氧化碳分子中的化学键,从而得到H2和CO的混合气(即合成气)以生产高能量密度的燃料[1-4],并进一步转化为20%~26%的电能和74%~80%的热量[5]。太阳能热催化过程直接利用太阳能来驱动储量丰富且廉价易得的金属氧化物材料还原二氧化碳,其灵感来自于自然光合作用[6-7]。如图1所示,与自然光合作用相比,人工光合作用侧重于利用高倍聚光的太阳辐射能流,将工业二氧化碳排放物转化为高品位燃料,这与日益发展的绿色环保理念相一致。二氧化碳排放控制、储存和再利用的研究趋势表明,大规模二氧化碳减排与利用目标的实现仍需一系列技术准备。
地质埋存二氧化碳似乎是最有效的二氧化碳封存途径之一,但二氧化碳的化学转化是更具应用价值的碳基能源再利用方式,其目的是合成液态碳氢化合物燃料或其他化学产品[8-9]。二氧化碳的理论存量约为11 000 Gt,其中9 000~10 000 Gt封存在深盐水层中,1 000 Gt封存在天然气和石油储层中作为石油被开采,这导致了大量低成本和不可持续的碳基能源利用[10]。尽管相对于二氧化碳封存量而言,二氧化碳再利用产生的影响几乎可以忽略不计,但其化学转化技术已经引起了较大的关注,因为它可以提供可持续的碳基能源产品和可再生燃料[11],并有利于长期的二氧化碳减排与控制。一项关于利用二氧化碳开发潜在燃料的全球调查报告表明,相关技术的发展在未来可有效减少50%的碳排放[12],包括长途运输、航空和生产性行业的化石燃料消费,贡献了约92亿t二氧化碳(占全球二氧化碳排放量的27%)[13],其中如图1所示的工业二氧化碳排放控制的替代方式主要包括:地下二氧化碳储存(每年可吸收超过1 500万m3的二氧化碳)[14]、二氧化碳运输和海洋储存[15]、二氧化碳光化学转化[16-17]、二氧化碳热化学转化[18-20]、二氧化碳光热转化[7, 21]、太阳能二氧化碳还原为燃料和化学品[12, 22]。
如图1所示,太阳能驱动的CO2、H2O和CH4化学催化分解所得到合成气产品可作为燃料或相关化工生产的原料。在能源环境科学领域,开发可靠的二氧化碳裂解技术对于处理大气中的3 200 Gt二氧化碳以及解决化石燃料危机具有重要意义[15, 23-24]。发展太阳能燃料转化技术的主要挑战是向目前占全球排放量27%的难以实现脱碳化的能源部门提供零排放的碳氢化合物燃料[13]。最近的研究表明,太阳能燃料能够在相关运输部门发挥关键作用,例如航空、航运和重型卡车运输,这些部门所需燃料共占运输燃料需求的40%[25]。
基于相关研究和技术的快速进步,开发有效的CO2转化技术,特别是以太阳能为驱动源的CO2催化转化技术已成为目前的迫切需要。本综述介绍了目前太阳能热催化技术的研究现状、技术发展动态以及潜在的太阳能CO2转化合成燃料和其他化学产品的相关示例,并从热力学原理、反应机制和动力学、基本方法和技术路线的角度,解析了能够驱动CO2转化的热催化系统集成方法,以获得高效催化系统设计和先进反应器工程的新视角。本文重点阐述了与高温热化学CO2转化有关的科学问题和关键限制因素,以揭示将热化学系统升级为更合理和高效的CO2转化系统的前沿手段。此外,讨论了该领域的关键工作和成就,并总结了目前研究现状的最新观点和主要见解,包括高效太阳能驱动CO2催化转化系统进一步优化的技术路线。
1 化学热力学
1.1 基于铁氧体的化学热力学
根据热力学原理,CO2直接热分解为CO和O2的温度在3 065 ℃以上,显然不利于大规模太阳能热化学技术的实现。因此,热化学过程通常采用金属氧载体氧化还原循环的方法。太阳能热化学转化CO2过程中制约化学热力学的主要问题是,如何降低热化学氧化还原循环温度并提高太阳能到燃料的转化效率。热化学反应的热力学平衡作为封闭的热接收器/反应器中温度的函数,经常被用于分析反应的稳定性、反应度和优势特征。以Fe3O4/FeO为循环工质对的热力学分析表明,400 ℃以下的低温反应条件容易导致FeO被CO2完全氧化成Fe3O4,同时产生碳沉积[26-28]。Abanades等[29]的研究表明,在500 ℃以上能够观察到稳定的CO产量,但最大转化率仅为10%~15%,在热力学上是不利的。如图2(a)所示,该温度下非致密的Fe0.945O和Fe0.947O显著增加。在高温热还原过程中,氧分压的降低导致热力学平衡向燃料合成方向转移,从而使反应温度降低,同时材料还原速率有所增加。

图2 热力学计算Fig. 2 Thermodynamic calculation
热力学限制与金属氧化物的热特性和化学特性密切相关。近年来,铁氧体材料一直受氧化还原热力学的制约而未实现真正的技术应用。Zhai等[6]近期证明了以Fe0.35Ni0.65Ox为代表的、贫铁氧体相对于传统Fe2MO4尖晶石结构的铁氧体,在1 300 ℃和800 ℃的热还原和氧化温度下可以表现出更高的二氧化碳转化率,最高可达10倍。如图2(b)所示,与CeO2-x相比,调控铁、镁、钴和镍在铁氧体纳米材料中的含量可以将二氧化碳分裂的热力学极限提高至10倍。热化学活性和CO产量在很大程度上取决于热还原热力学。CO2裂解会受到热力学氧化的影响,导致在相对较低的还原温度下CO产量不高。表1给出了克服氧化还原热力学限制的反应条件及其对应的CO产量,并展示了先进热化学储能材料及其CO2热催化还原活性。由于有利的热力学条件和相关的高活性化学组分,合理的操作条件有利于提升CO产量,因而在本文中作为参考反应条件进行展示,以方便未来研究的推进。
Nair等[30]的研究表明,在LaCoO3和LaNiO3的B位上取代Fe或Mn可以使氧化热力学向有利于CO2裂解的方向转变。图2(c)的结果表明,在相同的氧化还原材料制备方法下,在Fe0.35Ni0.65Ox中加入80%质量分数的ZrO2,其CO2裂解活性增强且CO产量增加。Zhai[31]指出将ZrO2掺杂于Fe0.35Ni0.65Ox以及NiFe2O4中可以改善热化学反应动力学,而使用Al2O3作为基底材料则可以提高热稳定性。如图2(d)和(e)所示,Zr纳米粒子反应面积较大,添加Ni、Fe基氧化物导致在高温下产生孔隙,可以促进化学反应介质内的热量和质量传输[32-34]。
1.2 基于钙钛矿的化学热力学
钙钛矿由于其在反应温度变化过程中的可调控化学特性,通常能够采用合理的设计方法来克服热力学限制,因此成为了最近热化学研究的热点材料。Bork等[35]通过考虑图3所示的热力学限制,设计并合成了先进的金属氧化物材料La0.6Sr0.4Cr1-xCoxO3-d,用于将H2O和CO2高效转化为太阳能燃料。在较低的温度下具有较高O2释放特性和CO2氧化性能的材料设计策略可以大大促进太阳能热化学燃料的合成。如图3所示,考虑到材料的化学组成,包括最先进的Ce0.8Zr0.2O2-d、La0.7Sr0.3Cr3-d和La0.7Sr0.3CoO3-d,Co纳米颗粒显示出较大程度的平衡氧分压。材料的热力学约束由以下公式计算。
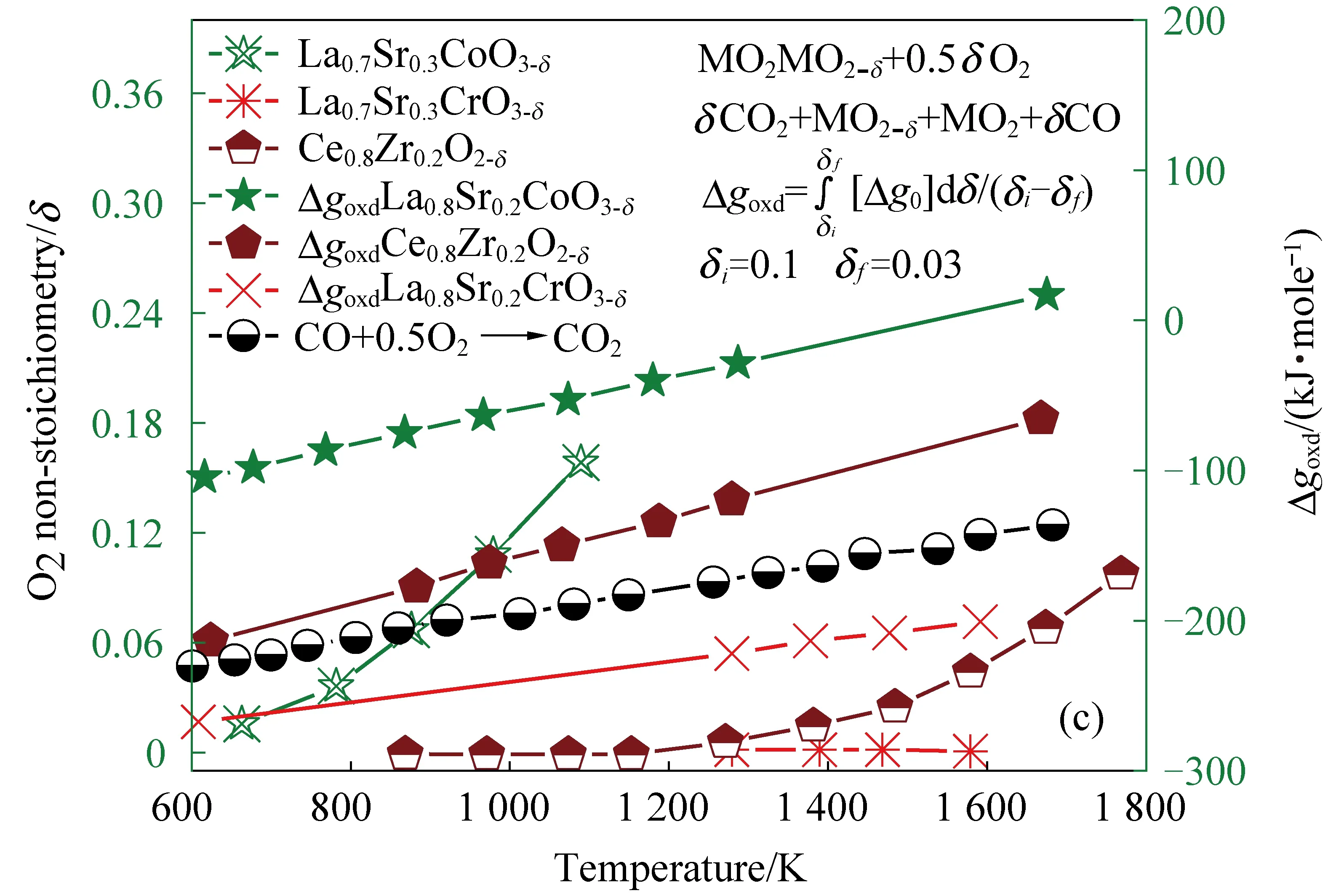
图3 太阳能热化学循环燃料转化的热力学性能[35]Fig. 3 Thermodynamic properties of solar thermochemical cycle fuel conversion[35]
(1)
(2)
(3)
其中:Δgox为材料氧化吉布斯自由能变化,kJ/mol;Δg0作为温度和pO2的函数,表示材料摩尔自由能变化;δi和δf分别为热还原阶段的非化学计量量和氧化后获得的非化学计量量;msample为样品质量,mg;Δmloss为减少的质量,mg;Δmgain为增加的质量,mg;MO和MO2分别为O和O2的分子量。
考虑到二氧化碳热催化转化的热力学基础理论,金属氧化物材料所呈现较大的Δgox负值对CO2裂解更有利。通过调控氧化还原材料的化学成分以克服热力学限制,以便在相对较低的反应温度下既能提供更高的O2释放量,又能达到更大的Δgox值以提升CO2裂解能力,如图2(c)所示。材料热化学裂解CO2循环的热力学能力可以用材料在不同反应温度和操作压力下的O2吸收/释放量来衡量。表现出更优还原性的材料,每摩尔氧载体产生的燃料比率更高,因此在热力学上对热化学过程是有利的[36, 46]。应该指出的是,热化学反应循环受到氧化还原热力学的极大制约。先进的钙钛矿材料往往比其他材料表现出更有利的热力学性能。Demont等[38]证明,在设计钙钛矿晶体时,用La3+代替Y3+可以使材料的氧化还原热力学特性得到改善。与CeO2相比,其还原热力学更高,氧化热力学更低。
太阳能热化学CO2还原的热力学极限与材料的化学成分、选择性和掺杂物有关。在A和B位点进行适当掺杂的钙钛矿材料在还原温度、O2释放/吸收的灵活性和氧化还原热力学方面比最先进的CO2热化学转化材料(如CeO2)表现出更多的优势[47]。选择最有利的氧化还原热力学材料可以实现高效的太阳能热化学转化,也可以提高太阳能燃料的合成效率。关于热力学的限制,氧化还原材料的设计策略应考虑到表现出较低热还原温度的具有更高O2交换和原位CO2分裂可能性的储能材料。目前,热重分析(TGA)通常用于材料的设计,以研究高效太阳能燃料合成的材料氧化还原热力学。
2 二氧化碳热催化还原机制和动力学
2.1 热活化的二氧化碳催化转化机制
利用氧化还原催化剂材料在高温下催化转化CO2以进行太阳能燃料合成相关技术的可行性在实验室规模和中试规模下已经得到证实。在化学活性方面,深入理解CO2热化学循环转化的反应机制和动力学仍然是一项挑战。高温热化学过程的典型特征是活性O-微粒从材料的主体迁移到其辐照表面,在还原氧化物的表面形成低价的Mx+活化纳米颗粒。Zhao等[39]报告了CeO2的还原性试验,并指出Ce4+在高温下首先转化为Ce3+,随后释放出活性O-。基于TGA方法的实验测试中,在相对较低的温度下(~800 ℃)加入CO2会引起材料质量的轻微变化。这表明材料在反应过程中,从CO2中吸收晶格氧导致质量逐渐升高。实验研究表明,热化学氧化还原循环反应动力学的特点是,在达到平衡之前反应材料的质量迅速下降,随后由于CO2反应气的供给,材料的质量迅速增加直至下一个平衡。较高的质量增加和较强的CO2裂解活性归因于快速的表面反应导致反应初期发生高效CO2催化转化。
CO2裂解可以通过适当地调整加热速率、气体流量、氧化温度和还原温度来控制。提高还原温度可显著提高氧交换能力和CO产量,但同时将氧化温度限制在高于800 ℃时并不利于CO2裂解反应动力学。通过将CO2通入反应器前的温度降低至100 ℃,可以改善太阳能燃料的产量[43]。此外,适当提高样品的加热速度可以加强热还原动力学,从而形成更高的CO2氧化动力学。Wang[40]的研究结果表明,加热速率从10 ℃/min增加到20 ℃/min,然后再增加到30 ℃/min,会使CO产量增加2倍。图4(b)、(c)展示了CO2转化为CO的机制,其中,F族由表面的氧交换反应组成,D族由O(离子或阳离子)在材料主体外的扩散机制组成,R族由通过材料界面的再氧化和还原过程中的氧释放/吸收组成[48],除了由于活性材料提供的高活性表面引起的CO2裂解外,在一定的操作温度下CO2也可以被辐照反应器的腔壁催化还原。例如,在1 280~1 420 ℃时,通过氧化铝的催化作用可以增加CO产量和O2释放量[48]。CO2的气-固热转化机制较为复杂,需要考虑指前因子等相关因素,这与CO2裂解动力学和CO产率有较大关系[49-50]。
如图4(d)所示,Fu[49]证明了在LaMnO3(010)O缺陷表面上的CO2裂解生成CO可以由一个激活的CO2裂解过渡态来描述,然后CO在充满O空位的表面上解吸。如图4(e)所示,最终的CO产率归因于表面的材料组成和化学活性,因为CO2裂解在受到辐照的活性表面上较为明显。因此,在CO2氧化反应初期观察到较高的CO产率可以归因于比扩散过程更具主导性的表面反应过程。
2.2 二氧化碳裂解反应动力学
根据Arrhenius表达式计算的等温固态反应动力学中,随温度变化的热化学氧化还原反应速率,可由如下方程定义:
(4)
(5)
(6)

根据Arrhenius动力学模型理论,活化能较低的材料具有较高的还原度,这可能符合热化学燃料合成过程的需要。迄今为止,研究中具有高达1 066.6 μmol/g[40]最高CO产量的材料为LaCo0.7Zr0.3O3,其活化能为107.1 kJ/mol,指前因子低于268.89 s-1。热化学反应动力学的特点是表面反应和固态扩散。在循环初期,较强的CO2裂解活性导致了大量的CO形成,这归因于表面反应动力学。Nair[30]的研究表明,由于氧载体层的致密化,限制了反应介质中的微观-宏观传质并使得载氧体失活,导致CO产量下降,CO2裂解反应速率降低[51-54]。在Ce-Ni双金属的协同效应下,将CeO2改性为CeO2-NiFe2O4混合固体氧化物材料能够加强热化学氧化反应动力学。Ma等[55]证明了在NiFe2O4中加入CeO2会产生微米级孔隙,进而促进晶格中O2的迁移,限制Fex+在NiFe2O4晶格中的向外迁移,并使得铁氧体纳米材料发生相分离。从同样的角度来看,扩散驱动的反应动力学可以在后期通过适当的活性氧化还原催化剂材料改性来提升性能[36],如(质量分数30% MgFe2O4/[Mg, Fe]锈铁矿)[57]、ZrO2和CeZrO2[58],表现出了极强的热稳定性和化学反应性且在高温下失活程度较低。在热化学氧化还原反应器中,高温传热传质是氧化反应循环中O2释放和CO产生反应动力学的控制因素。根据McDaniel的研究[1],氧化反应动力学可分为两种机制,包括基于反应级数的反应速率和扩散。
在高温CO2环境下,晶格氧交换和材料缺氧特性的机制已经得到充分研究,其被氧空位所形成的自由能和过渡态的氧能量传导所支配[59]。Muhich等[48]发现,在CoFe2O4/Al2O3铁素体类材料上提高CO产率会伴随着热还原温度和pCO2的升高。材料在越高的还原温度下进行反应,其CO2裂解活性越高[43, 60-61]。在研究CO2的热化学转化时考虑到气固CO2氧化反应、热活化CO2催化裂解以及活性材料与反应器壁的再氧化动力学模型可分别用以下公式定义[42, 48]:
(7)
(8)
(9)
其中:k1是材料与CO2活性氧化的动力学速率系数;Y是介质中CO2浓度,mol/L;γ是反应阶数;f1(α)是CO2-活性固体材料反应模型函数;k2是无氧载体时催化裂解CO2的动力学速率系数;α3是活性材料与反应器壁面中O2的氧化速率k3是O2氧化速率系数;YO2是O2氧化速率系数;f3(α)O2氧化反应模型函数。
2.3 掺杂强化的CO2裂解动力学
通过掺杂一些元素(Si、Ti、V、Hf、Ta、Cr、Nb、Rh、Pr、La、Zr和Tb),或将不同的金属氧化物进行混合,可以提高氧化物材料的还原性和晶格固有空位中O2的产生率。掺杂物的氧交换和CO2裂解性能取决于掺杂物的热稳定性、基材形成活性空位的能力,以及在它们协同作用下的热化学活性[44, 62-63]。Takalkar等[41]的研究表明,控制Pr浓度降低到0.4~0.2以及Sr的摩尔浓度提高到0.6~0.8所合成的PrxSr(1-x)MnO3-δ材料,可以在提高氧交换能力的同时提高CO产量。在1 100~1 400 ℃温度范围内对掺杂Ce0.9M0.1O2的CO2催化转化相关研究中,在掺杂Zr(M=Zr、Y、V、Cr、W、La、Ti)的情况下获得了显著的CO产量[64]。相对于未掺杂的氧化物CeO2,通过将其与Zr0.2Ce0.8O2-δ和Hf0.2Ce0.8O2-δ[44]掺杂,可使太阳能燃料的产率增加一倍[44]。包括Ti4+、Sn4+、Hf4+和Zr4+的四价阳离子掺杂物,相比于如La3+、Y3+和Sm3+等的三价阳离子掺杂物,能够更大地提升CeO2的热化学活性以更多地释放O2和CO。Jiang等[42]的研究表明,与Hf4+和Zr4+掺杂物相比,掺杂CeO2热还原所形成的Ce2Ti2O7和Ce2Sn2O7氧化物限制了Ti4+和Sn4+的掺杂。使用原位拉曼光谱[65]进行的缺陷化学分析表明,由四价元素掺杂引起的内在O型空位是燃料产量的决定因素,而三价掺杂情况下的外在O型空位大幅度增强了O2的传输并改善了燃料生成动力学。多数研究发现,Zr纳米颗粒可以被选择作为候选掺杂物。然而,Wang[40]的报告指出,当Co纳米颗粒部分替代Zr进行掺杂时,Zr的热还原活性可能会降低。图5展示了在Psolar=4.1 kW,还原温度Tred=1 500 ℃,Ar流速VAr=0.625 L/min,还原压力Ptotal=10 mbar,氧化开始温度Tox,start=1 000 ℃,氧化结束温度Tox,end=750 ℃,CO2流速VCO2=7 L/min,氧化压力Ptotal=1 bar下,氧化还原热化学反应裂解CO2的过程[66]。考虑到如图5所示过程的有效性,对CO2裂解机制和动力学机理的探究可以促进工业太阳能燃料生产,顺应全球经济趋势并实现绿色环保。结合具有较高表面反应活性的氧化还原材料,可以设计出一种热化学储能材料,它可以表现出更优的CO2裂解活性和更高密度的化学能量通量。
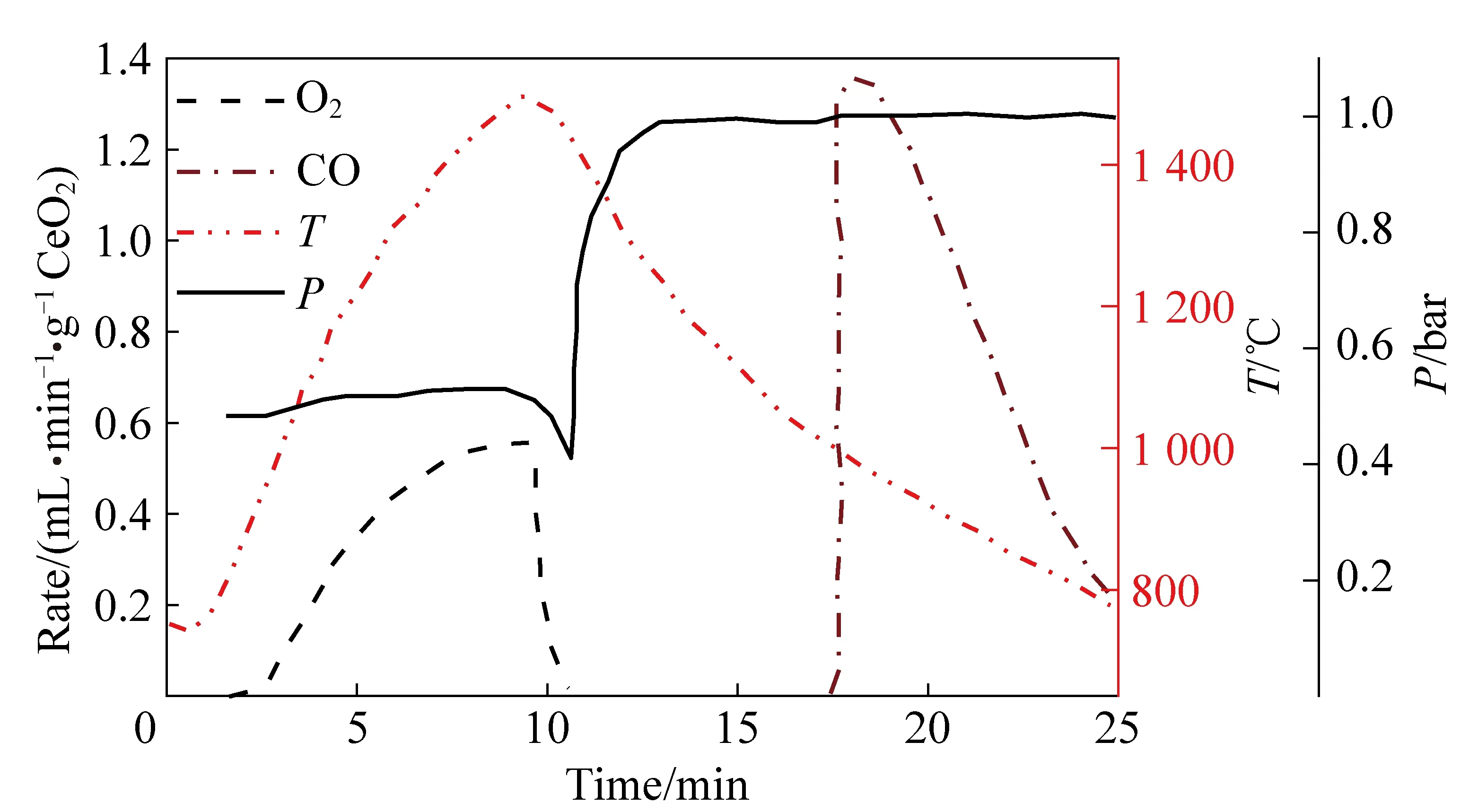
图5 氧化还原热化学反应裂解CO2[65]Fig. 5 Redox thermochemical reaction for CO2 splitting[65]
3 总结与展望
利用太阳能将CO2转化为可持续高附加值燃料技术的可靠性和有效性已得到证明,有望成为一种低成本的可再生和零碳排放工业原料合成技术。虽然相关研究呈指数增长趋势,但由于缺乏成熟的催化剂、反应器研制技术,这项新技术无法充分发挥其工程应用潜力。总结分析太阳能热催化二氧化碳转化机理可知,单一热化学和光化学转化效率提升成了关键的科学问题,而光诱导的热电子和热力系统则同时受到高效光热材料的选择性以及系统构成和能量转化效率的影响。热催化转换过程可通过调整原材料的化学成分和掺杂物等材料设计策略实现更高的O2交换和还原速率。在低温下将反应所需的自由能降至负值,是通过克服热力学限制改进CO2还原速率的最有效方法。与快速氧交换和预先CO2裂解有关的化学活性在很大程度上可归因于表面化学过程。通过适当地掺入主要的氧化物催化剂,晶格氧空位的产生和二氧化碳裂解活性可以提高10倍。影响热化学反应动力学的主要因素是热还原温度、氧化温度、加热速率、受辐照氧化物微米孔内的质量传输和腔壁化学成分。
