芪黄益肾方对糖尿病视网膜病变大鼠视网膜组织病理形态和血-视网膜屏障功能的影响
2023-06-13袁丽莎张宁任秋月杨荣禄刘世巍柳诗意石凯峰孟祥飞于芳宁
袁丽莎,张宁 ,任秋月 ,杨荣禄 ,刘世巍 ,柳诗意 ,石凯峰 ,孟祥飞 ,于芳宁
1.中国中医科学院望京医院,北京 100102;2.北京中医药大学,北京 100029
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最主要的微血管并发症之一,约占糖尿病患者的三分之一,是全球范围内视力丧失和失明的主要原因[1-2]。早期非增殖性DR(NPDR)以视网膜血管扩张、迂曲,毛细血管闭塞及血管通透性增加为特征[3]。血-视网膜屏障(blood-retinal barrier,BRB)破坏是导致DR血管通透性增加、黄斑水肿的病理生理学基础,是DR患者视力丧失的重要原因[4]。细胞间屏障连接如ZO-1 的表达在维持BRB 正常功能中发挥重要作用,ZO-1表达降低直接导致BRB完整性破坏,使毛细血管通透性增加、水液渗漏,组织水肿。
目前尚缺乏针对DR的特异性治疗方案,较高的糖化血红蛋白(HbA1c)和血压被认为是视力障碍的危险因素[5],西医治疗早期以控制血糖、血压为主,抗血管内皮生长因子药物和全视网膜激光光凝术仅适用于晚期增殖性DR(PDR)患者,且反复玻璃体注射给患者带来极大痛苦,增加感染风险[6]。
中医学认为,DR是由消渴病日久,阴虚燥热发展为气阴两伤,气虚致瘀,导致瘀血阻于目络,病机以气阴两虚为本,络脉瘀阻为标。本团队前期基于临床实践,以益气养阴、活血通络为核心治法,拟芪黄益肾方用于糖尿病并发症的治疗,在治疗糖尿病肾病方面有保护肾小球屏障功能、保护足细胞、降低尿蛋白、延缓肾功能进展的作用[7-9]。本实验通过观察芪黄益肾方对DR模型大鼠HbA1c水平、视网膜组织病理形态、视网膜微血管形态、血-视网膜屏障功能及视网膜组织ZO-1蛋白表达的影响,探讨其干预DR的作用和潜在机制。
1 实验材料
1.1 动物
6周龄SPF级雄性SD大鼠48只,购于北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2021-0006。饲养于北京中医药大学北京中医药研究院动物实验中心,温度(23±2)℃,相对湿度(55±5)%,12 h/12 h光暗循环,自由摄食饮水。高脂高糖饲料,购于斯贝福(北京)生物技术有限公司,生产许可证号SCXK(京)2019-0010。本实验经北京中医药大学学术委员会实验动物伦理分委员会批准(BUCM-4-2021092303-3174)。
1.2 药物及制备
芪黄益肾方由黄芪、太子参、生地黄、山萸肉、丹参、当归等组成[10],饮片购自中国中医科学院望京医院中药房,由北京首儿药厂加工为颗粒剂,1剂原方相当于颗粒剂24 g,用蒸馏水配制成0.5 g/mL药液,临用前稀释为0.125、0.25 g/mL。羟苯磺酸钙胶囊,Klocke Pharma Service,批号0607699,0.5 g/粒,使用前用蒸馏水配制成0.015 g/mL混悬液。
1.3 主要试剂与仪器
链脲佐菌素(STZ,德国Sigma 公司,货号S0130),柠檬酸/柠檬酸钠缓冲液(北京普利莱,货号B1213-1),2%伊文斯蓝染色液(北京酷来博,货号SL7203),FAS 眼球固定液(武汉Servicebio,货号G1109-100ML),HbA1c检测试剂盒(武汉云克隆,货号CEA190Ra),ZO-1 抗体(美国Proteintech,货号21773-1-AP),GAPDH抗体(美国Proteintech,货号60004-1-1g),HE 染液(武汉Servicebio,货号G1003),胰蛋白酶消化液(武汉Servicebio,货号G4004),PAS染色液(武汉Servicebio,货号G1008)。脱水机(意大利DIAPATH,型号Donatello),包埋机(武汉俊杰电子有限公司,型号JB-P5),病理切片机(上海徕卡仪器有限公司,型号RM2016),染色机(意大利DIAPATH,型号Giotto),正置光学显微镜(日本尼康,型号Eclipse E100),成像系统(日本尼康,型号NIKON DS-U3),酶标仪(美国Thermo,型号muLISKANMK3),荧光扫描仪(匈牙利3DHISTECH,型号Pannoramic MIDI)。
2 实验方法
2.1 造模及分组
48只大鼠随机取8只大鼠作为正常组,其余大鼠采用高脂高糖饲料喂养联合STZ腹腔注射建立DR模型[11]。高脂高糖饲料喂养8周后,大鼠禁食12 h,予1%STZ溶液(以柠檬酸/柠檬酸钠缓冲液pH=4.2配制,现用现配)30 mg/kg(3 mL/kg)低温、避光腹腔注射。72 h后,3次检测尾静脉随机血糖,≥16.7 mmol/L即为DR模型建立成功。正常组大鼠予普通饲料喂养及等体积柠檬酸/柠檬酸钠缓冲液腹腔注射。将40只成模大鼠随机分为模型组、羟苯磺酸钙组和芪黄益肾方低、中、高剂量组(中药低、中、高剂量组),每组8只。
2.2 给药
中药中剂量按照人与大鼠等效剂量(1∶6.25)换算,低、中、高剂量按1∶2∶4比例计算,即中药低、中、高剂量组每日灌胃1.25、2.5、5 g/kg芪黄益肾方药液,羟苯磺酸钙组按人与大鼠等效剂量0.15 g/kg灌胃,灌胃体积1 mL/100 g,正常组和模型组灌胃等体积蒸馏水。连续12周。
2.3 糖化血红蛋白检测
干预结束后,腹腔注射3%戊巴比妥钠麻醉大鼠,腹主动脉取全血2 mL,室温静置20 min,2 000×g离心15 min,取上层血清,置于-20 ℃冰箱保存,按照试剂盒说明书检测HbA1c含量。
2.4 HE染色
取大鼠眼球组织,置于FAS眼球固定液中固定,石蜡包埋,制备3 μm石蜡切片,常规HE染色,采用CaseViewer 2.1软件观察视网膜组织形态变化。每组取3张切片,每张切片随机取3个视野,测量视网膜总厚度。
2.5 PAS染色
视网膜胰蛋白酶消化血管网铺片PAS染色可直接观察视网膜毛细血管网形态。取大鼠眼球组织,置于4%多聚甲醛中固定48 h以上。取出固定的眼球,洗去固定液,用细针头沿锯齿缘扎破,使房水流出,用眼科剪沿锯齿缘环形剪开虹膜,剥离角膜和晶状体,浸入PBS中洗掉玻璃体,以视神经乳头为中心,将杯状眼球壁均匀分成3~4份,用尖头镊子轻轻剥离内壁的视网膜层,在PBS溶液中浸洗0.5~12 h,放入胰蛋白酶消化液中,37 ℃烤箱消化过夜。吸管吸出视网膜,放入纯水中反复吹打,直至视网膜血管网呈现透明状,吸取视网膜血管网,放置于载玻片上,自然晾干,常规PAS染色。
2.6 视网膜屏障功能检测
大鼠麻醉后,尾静脉注射2%伊文思蓝(40 mg/kg),大鼠全身变蓝后,脱颈处死,摘除眼球,4%多聚甲醛固定48 h以上。沿角巩膜缘平分剪开眼球,轻轻剥离晶状体和玻璃体,以视神经乳头为中心,将杯状眼球壁均匀分成3~4份,用尖头镊子轻轻剥离内壁的视网膜层,平铺到载玻片上,抗荧光淬灭剂封片,荧光显微镜扫描。
2.7 Western blot检测
取出大鼠眼球后,用细针头沿锯齿缘扎破角膜,环形剪开,剥离晶状体和玻璃体,取出视网膜,液氮速冻,-80 ℃冰箱冻存。取视网膜组织,加入裂解液,冰上裂解,4 ℃、12 000 r/min离心15 min,取上清液,BCA法测定蛋白浓度。将蛋白样品与上样缓冲液混合,100 ℃变性处理5 min后上样,进行凝胶电泳,4 ℃下将蛋白转至PVDF膜,5%脱脂奶粉室温封闭2 h。加入ZO-1一抗(1∶2 000),4 ℃孵育过夜。TBST充分洗膜,加入二抗,37 ℃摇床孵育2 h。加入显影剂,全自动化学发光仪曝光拍照。采用Image J 1.8软件分析条带灰度值,以GAPDH为内参,计算ZO-1蛋白相对表达量。
3 统计学方法
4 结果
4.1 芪黄益肾方对模型大鼠糖化血红蛋白含量的影响
与正常组比较,模型组大鼠HbA1c含量显著增加(P<0.001);与模型组比较,芪黄益肾方中剂量组大鼠HbA1c 含量显著减少(P<0.01);与羟苯磺酸钙组比较,芪黄益肾方中剂量组大鼠HbA1c 含量显著减少(P<0.01)。见表1。
表1 各组大鼠HbA1c含量比较(±s,%)

表1 各组大鼠HbA1c含量比较(±s,%)
注:与正常组比较,***P<0.001;与模型组比较,##P<0.01;与羟苯磺酸钙组比较,▲▲P<0.01
HbA1c 0.95±0.12 1.80±0.40***1.74±0.27 1.21±0.17##▲▲1.55±0.26 1.73±0.23组别正常组模型组中药低剂量组中药中剂量组中药高剂量组羟苯磺酸钙组只数555555
4.2 芪黄益肾方对模型大鼠视网膜病理形态的影响
正常组大鼠视网膜组织结构规则,层次清晰,各层细胞排列紧密规整;模型组大鼠视网膜结构紊乱,层次不清,各层细胞排列松散不规则;与模型组比较,中药各剂量组和羟苯磺酸钙组大鼠视网膜组织结构有不同程度改善。见图1。与正常组比较,模型组大鼠视网膜厚度显著降低(P<0.001);与模型组比较,中药中、高剂量组和羟苯磺酸钙组大鼠视网膜厚度显著增加(P<0.01)。见图2。

图1 各组大鼠视网膜组织形态(HE染色,×400)
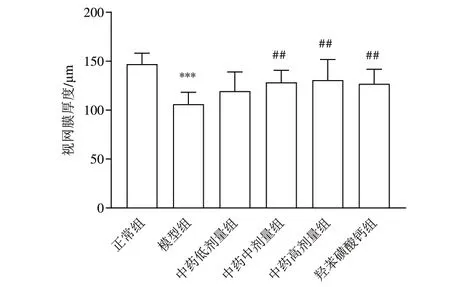
图2 各组大鼠视网膜厚度比较(±s,每组3只)
4.3 芪黄益肾方对模型大鼠视网膜微血管形态的影响
PAS染色结果显示,正常组大鼠视网膜血管走行规则,周细胞清晰完整,无闭塞毛细血管;模型组大鼠视网膜血管走行迂曲,周细胞减少,出现闭塞毛细血管;与模型组比较,中药各剂量组和羟苯磺酸钙组大鼠视网膜微血管形态有不同程度改善。见图3。
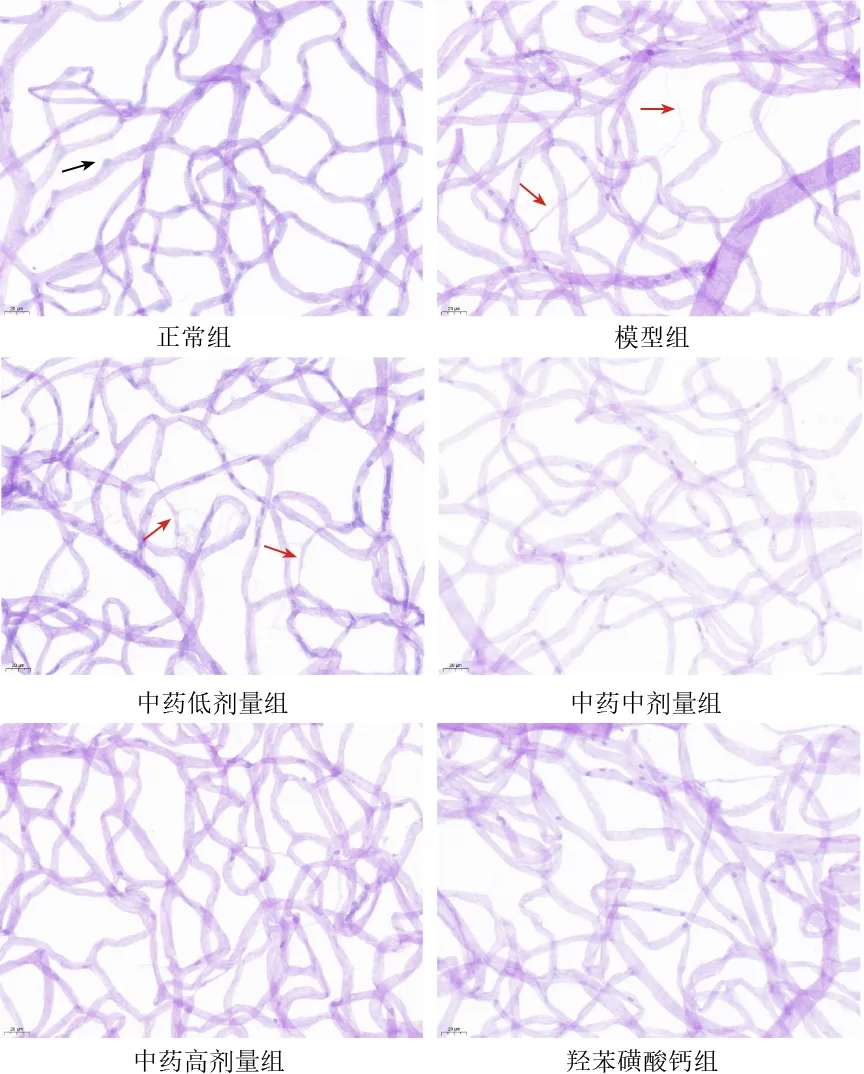
图3 各组大鼠视网膜血管网形态(PAS染色,×400)
4.4 芪黄益肾方对模型大鼠血-视网膜屏障功能的影响
伊文思蓝染色结果显示,正常组大鼠视网膜组织几乎无渗漏;模型组大鼠视网膜组织出现明显斑点、团片状、弥散性渗漏区域;与模型组比较,中药低、中、高剂量组和羟苯磺酸钙组大鼠视网膜组织渗漏明显减轻。见图4。

图4 各组大鼠视网膜组织渗漏检测(伊文思蓝染色,×100)
4.5 芪黄益肾方对模型大鼠视网膜组织ZO-1蛋白表达的影响
Western blot结果显示,与正常组比较,模型组大鼠视网膜组织ZO-1蛋白表达显著降低(P<0.001);与模型组比较,中药低、中、高剂量组和羟苯磺酸钙组大鼠视网膜组织ZO-1 蛋白表达显著升高(P<0.01,P<0.001);与羟苯磺酸钙组比较,中药中剂量组大鼠视网膜组织ZO-1 蛋白表达显著升高(P<0.001)。见图5、图6。

图5 各组大鼠视网膜组织ZO-1蛋白免疫印迹
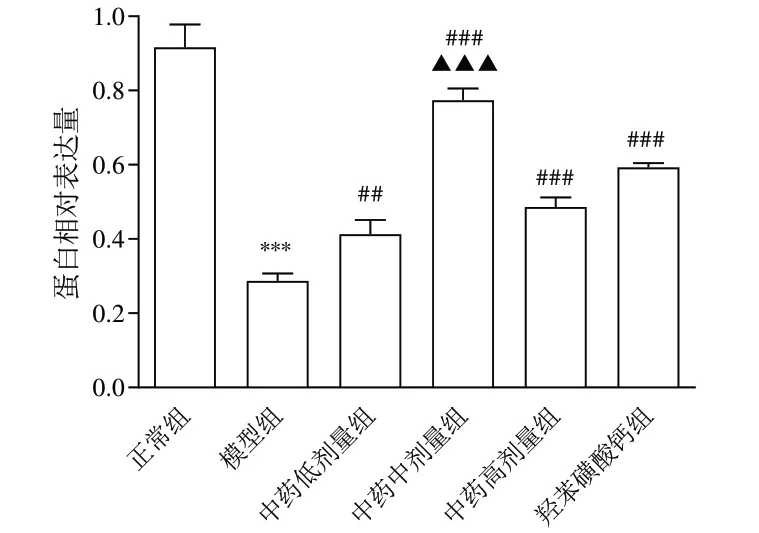
图6 各组大鼠视网膜组织ZO-1蛋白表达比较(±s,每组3只)
5 讨论
DR是糖尿病累及微血管的并发症,糖尿病病程较长,高血糖、高血压是明确的危险因素,较高的HbA1c水平与DR的进展显著相关[5],强化血糖控制可以降低DR发病率,延缓恶化。DR分为早期NPDR和晚期PDR 2个阶段,NPDR以血管内皮损伤、微动脉瘤和斑点状视网膜内出血为主要临床特征,BRB破坏是其主要的病理生理基础。
BRB是视网膜与体循环之间的保护屏障,是维持视网膜正常微环境的必要结构。BRB包括视网膜血管系统的内血-视网膜屏障(iBRB)及视网膜外层的外血-视网膜屏障(oBRB)。oBRB由脉络膜、Bruch's膜和视网膜色素上皮(RPE)细胞组成,作为脉络膜血管与视网膜之间的物质交换屏障;iBRB由视网膜微血管内皮细胞、周细胞和神经胶质细胞组成,是视网膜内部微血管系统与视网膜间的重要屏障。BRB破坏以周细胞丢失和细胞间连接破坏为特征。周细胞是iBRB的重要组成部分,围绕在视网膜毛细血管周围,主要作用是维持内皮细胞正常结构和iBRB的屏障功能。DR期间,高糖和高级糖基化终末产物(AGEs)会导致周细胞凋亡脱落,内皮细胞增殖失控,血管生成失调,损害iBRB[12]。通过视网膜胰蛋白酶消化PAS染色,可以直观地观察视网膜微血管网形态,包括血管走行、周细胞、内皮细胞、无细胞毛细血管、闭塞毛细血管等。内皮细胞间和RPE 细胞间的紧密连接蛋白,如ZO-1、occludin、Claudin-5,是维持iBRB和oBRB完整性的重要分子蛋白。在DR期间,AGEs和活性氧产生增加,诱导炎症因子和趋化因子上调,导致ZO-1和Claudin-5下调[13],同时,毛细血管收缩和闭塞导致视网膜缺血[14],血管内皮生长因子(VEGF)产生增加,导致ZO-1和occludin表达降低[15],BRB破坏,血管通透性增加,液体和蛋白质渗漏,从而出现黄斑水肿和出血。伊文思蓝染料是一种广泛使用的非放射性血管内示踪剂,在血液中不可逆与血浆白蛋白结合,当血浆蛋白从血管渗出时,伊文思蓝-白蛋白复合物就会渗入周围组织,可以通过荧光扫描直接观察,常用于血管通透性检查,被用于BRB功能的定性和定量评估[16]。羟苯磺酸钙具有抗氧化、抗自由基和血管保护作用,被用于糖尿病微血管并发症特别是DR的治疗,可以抑制毛细血管通透性,抑制炎性因子,改善微血管瘤、视网膜渗出和出血,保护BRB[17]。
本研究结果显示,与正常组比较,模型组大鼠HbA1c显著增加,表明模型组大鼠血糖显著升高;与模型组比较,中药中剂量组大鼠HbA1c显著减少,表明芪黄益肾方可以降低DR大鼠血糖。与正常组比较,模型组大鼠视网膜厚度显著减少,闭塞毛细血管增多,出现明显伊文思蓝渗漏;与模型组比较,中药中、高剂量组和羟苯磺酸钙组大鼠视网膜厚度有不同程度增加,闭塞毛细血管和伊文思蓝渗漏明显改善。Western blot结果显示,模型组大鼠视网膜组织ZO-1蛋白表达显著下调,提示模型大鼠视网膜紧密连接破坏,BRB分子结构受损,中药低、中、高剂量组和羟苯磺酸钙组大鼠视网膜组织ZO-1蛋白表达不同程度升高,以中药中剂量组升高最为明显,提示芪黄益肾方可以上调紧密连接蛋白表达,保护DR大鼠BRB功能。
根据临床症状,DR可归属中医学“雀目”“视瞻昏渺”“消渴目病”等范畴。中医学认为,DR病机以消渴病阴虚燥热为基础,逐渐发展为气阴两虚,中气亏虚,致精气不能升举于目,故视物不清。久病多瘀,且气虚致瘀,瘀血阻于目络,导致出现微血管瘤、视网膜出血和新生血管[18],故气阴两虚、血瘀阻络为关键病机。芪黄益肾方是本团队基于多年临床实践创制的治疗糖尿病微血管并发症的经验方,方中黄芪、太子参益气升提健脾,生地黄、山萸肉滋肾养阴填精,丹参、当归活血祛瘀通络。全方共奏益气养阴、活血通络之功。药理研究表明,黄芪甲苷可增加DR大鼠视网膜铺片周细胞数量,减轻DR大鼠氧化应激损伤[19];丹参具有显著抗氧化特性[20],丹参提取物可以抑制内皮细胞凋亡[21]和视网膜新生血管生成[22];当归提取物可以抑制VEGF产生[23]及视网膜新生血管形成[24]。
综上所述,芪黄益肾方可改善DR模型大鼠视网膜病理损害,改善微血管形态,减轻视网膜渗漏,可能通过上调紧密连接蛋白ZO-1表达发挥对BRB的保护作用。本研究可为芪黄益肾方治疗DR提供实验依据。
