基于网络药理学和实验验证探究芍药汤干预溃疡性结肠炎湿热内蕴证作用机制
2023-06-13芦易刘起立李嫣红刘星赐吴东升谢念佳阳玉婷曹晖
芦易 ,刘起立 ,李嫣红 ,刘星赐 ,吴东升 ,谢念佳 ,阳玉婷 ,曹晖
1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007
溃疡性结肠炎(ulcerative colitis,UC)是一种病因不明的直肠和结肠慢性非特异性炎症性疾病[1]。病变主要侵犯大肠黏膜及黏膜下层,呈连续弥漫性分布,主要临床表现为腹泻、黏液脓血便、腹痛等。其发病机制涉及多种因素,如环境因素、遗传易感性和肠道菌群功能障碍等。现代医学主要采用抗炎和免疫抑制剂治疗,包括美沙拉嗪、皮质类固醇、免疫抑制药物、肿瘤坏死因子(TNF)-α单克隆抗体等,但存在一些不良反应。探索低毒性和高质量的UC治疗方法具有重要意义。越来越多的研究表明,中医药在治疗UC中具有潜在优势[2-4]。
UC属中医学“痢疾”“久痢”“肠澼”等范畴[5],湿热蕴肠为UC基本病机,湿热之邪伏于肠中,气机不畅,传导失司,难以清解,形成“湿热伏邪”[6],致肠络受伤。芍药汤首载于《素问病机气宜保命集》,有清热燥湿、调气行血之功,后世医家皆推此方为治疗湿热痢之主方。临床研究表明,采用芍药汤治疗UC湿热证效果显著[7]。前期研究显示,芍药汤可有效改善UC湿热内蕴证便血、腹痛、腹泻等主要表现,减轻黏膜防御受损,促进黏膜细胞增殖,减少脱落的黏膜细胞增殖,并防止固有层水肿和中性粒细胞浸润[8-9]。
中药复方具有多成分、多靶点、多途径的作用特点,网络药理学在揭示中药复方的药理学规律上具有独特优势,其整体性、系统性与中医学整体观、辨证论治等基本理论趋于一致[10-11]。本研究运用网络药理学方法对芍药汤治疗UC的关键靶点及相关通路进行预测,并采用UC湿热内蕴证动物模型进行验证,探究芍药汤治疗UC湿热内蕴证可能的作用机制。
1 材料与方法
1.1 网络药理学预测
1.1.1 芍药汤活性成分筛选
应用TCMSP 数据库(https://old.tcmsp-e.com/tcmsp.php)检索芍药汤组方药物白芍、黄芩、黄连、当归、木香、槟榔、大黄、肉桂、甘草的化学成分,设定类药性(DL)≥0.18且口服生物利用度(OB)≥30%,筛选出芍药汤中9种药物的有效成分及其对应靶点。使用UniProt数据库(https://www.uniprot.org/)的UniProt KB搜索功能,限定基因来源为“Human”(人类),筛选“Reviewed”(已证实文件)进行靶点基因名称标准化。
1.1.2 疾病相关靶点及交集靶点获取
从GEO 数据库(https://www.ncbi.nlm.nih.gov/)下载成年中度至重度UC患者黏膜活检的基因表达谱GSE87466。利用R语言limma包对P<0.05且|log2|>0.5的样品进行筛选。获得UC相关靶基因并删除重复项,将其与芍药汤有效成分对应的靶点基因进行映射,交集基因即芍药汤治疗UC的靶基因。
1.1.3 药物-化合物-疾病靶点网络构建
将交集靶点导入Cytoscape3.7.0软件,构建药物-化合物-疾病靶点网络,并利用CentiScape插件计算有效成分度值,度值越高提示发挥主要功能的概率越大。
1.1.4 蛋白相互作用网络构建及拓扑分析
将交集靶基因导入STRING数据库(https://stringdb.org/cgi/input.pl),选择“智人”,互动分数>0.9,隐藏未参与互动的基因,构建蛋白相互作用(PPI)网络。将PPI 网络导入Cytoscape3.7.0 软件,下载插件CytoNCA,根据其网络中心度进行拓扑分析。
1.1.5 GO及KEGG通路富集分析
利用R语言程序包对交集基因进行GO富集分析及KEGG 通路富集分析,选择显著富集的生物过程(BP)、细胞组分(CC)、分子功能(MF)前10项条目绘制柱状图,显著富集的前30 条KEGG 通路绘制气泡图。
1.2 动物实验验证
1.2.1 药物
芍药汤(白芍30 g,黄芩15 g,黄连15 g,大黄9 g,当归15 g,槟榔6 g,木香6 g,肉桂5 g,炙甘草6 g),饮片购于湖南中医药大学第一附属医院中药房,湖南三湘中药饮片公司生产,批号依次为2021071607、2021071104、202107011、2021042501、2021062710、2021032605、2021070201、2021041341、2021062103,经湖南中医药大学第一附属医院邓桂明副主任药师鉴定,均符合2020年版《中华人民共和国药典》规定。将饮片混匀后用双蒸水浸泡2 h,先煮沸后,再用小火煎煮30 min,煎煮提取2次,经浓缩、过滤等处理,制成每1 mL含原药材4.44 g的药液,置于4 ℃冰箱保存备用。美沙拉嗪肠溶片,黑龙江天宏药业股份有限公司,批号20160316。精密称取美沙拉嗪肠溶片4.2 g研磨成粉末,溶于10 mL蒸馏水中,配制成0.42 g/mL的溶液。
1.2.2 动物、试剂与仪器
健康雄性SD大鼠60只,SPF级,体质量(160±10)g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号SCXK(湘)2019-0004,动物合格证号430727211101842621,饲养于湖南中医药大学第一附属医院SPF级动物房,温度35 ℃,湿度95%,每日6 h光照,自由摄食饮水,普通饲料适应性喂养3 d。动物实验由湖南中医药大学第一附属医院实验动物伦理委员会审核通过(ZYFY20210615)。
2,4,6-三硝基苯磺酸(TNBS,美国Sigma 公司,批号SLCG2384),HE染色试剂盒(上海碧云天生物公司,批号C0105),NF-κBp65鼠单抗(Immunoway公司,批号YM3111),MMP9 兔单抗、STAT3 兔单抗(艾方生物公司,批号分别为AF300248、AF300329),白细胞介素(IL)-6、IL-1β ELISA试剂盒(武汉基因美生物科技有限公司,批号201803),GAPDH鼠单抗(武汉赛维尔生物公司,批号GB15002),PV-9000通用型二步法检测试剂盒(北京中杉金桥生物技术有限公司,批号ZB2306),粪便隐血试剂(珠海贝索生物技术有限公司,批号B210501)。
RT-6100型酶标仪(深圳雷杜生命科学股份有限公司),KZ-Ⅱ型研磨仪(武汉赛维尔生物公司),D3024R型台式高速冷冻离心机(北京大龙兴创实验仪器公司),TG16W型微量高速离心机(长沙湘智离心机仪器有限公司),998洗板机(北京天石天力医疗器械技术开发中心),KD-BM、BL型组织包埋机(浙江金华科迪仪器设备有限公司),WD-9405C 型电泳仪(北京六一仪器厂)。
1.2.3 分组、造模、给药及取材
采用随机数字表法将60只大鼠分为空白组、模型组、美沙拉嗪组及芍药汤低、中、高剂量组,每组10只。参照课题组前期研究[8-9],除空白组外,其余各组采用复合病因方法制备UC湿热内蕴证大鼠模型。造模大鼠交替灌服油脂15 g/kg、52%白酒20 mL/kg,连续20 d,同时以200 g/L蜂蜜水代替蒸馏水自由饮用。第6、20日于大鼠腹股沟、背部及双侧侧足跖皮下注射40 mg/kg抗原乳化液(大鼠IgG抗原与完全弗氏佐剂按1∶1比例配制)。造模第21日大鼠禁食不禁水24 h,用3%戊巴比妥钠(30 mg/kg)腹腔注射麻醉大鼠后,将石蜡油润滑的直径0.4 mm聚乙烯软管插入大鼠肛门内8 cm处,注入5%TNBS 75 mg/kg+50%乙醇0.25 mL,随后将大鼠提尾倒置1 min,使药液充分停留于结直肠内。7 d后,空白组及造模大鼠各随机抽取2只进行观察和解剖,从证候学评价及结肠病理表现等方面提示造模成功[12]。
按人体用药量换算成大鼠等效剂量,芍药汤低、中、高剂量组分别予11.1、22.2、44.4 g/(kg·d)芍药汤药液灌胃,美沙拉嗪组予0.42 g/kg美沙拉嗪溶液灌胃,体积均为10 mL/kg,空白组和模型组予等体积生理盐水灌胃,连续7 d。末次给药后大鼠禁食禁水24 h,腹腔注射麻醉,腹主动脉采血后脱颈处死大鼠,剖开腹部,选取距离肛门约8 cm处病变结肠组织约2 cm,用PBS反复清洗后保存。
1.2.4 疾病活动指数评分
观察大鼠一般状态,分别从体质量、粪便性状、粪便隐血三方面进行疾病活动指数(DAI)评分:体质量不变计0分,下降1%~5%计1分,下降6%~10%计2分,下降11%~15%计3分,下降15%以上计4分;粪便性状正常计0分,粪便成形但易黏附计1分,半成形或软便计2分,粪便呈泥浆状计3分,腹泻、粪便黏附于肛门计4分;粪便隐血阴性计0分,弱阳性计1分,阳性计2 分,强阳性计3 分,肉眼可见便血计4 分。DAI评分=(体质量分数+粪便性状分数+粪便隐血分数)÷3,评分越高表示炎症越重。
1.2.5 HE染色观察结肠组织病理学变化
用4%多聚甲醛固定结肠组织,经脱钙,脱水,透化,石蜡包埋,切片4~5 μm,将切片用二甲苯脱蜡,无水乙醇水合,并用HE染色固定,在显微镜下观察组织学变化,并进行病理评分。
1.2.6 ELISA检测血清炎症因子含量
取大鼠抗凝全血,4 ℃、3 000 r/min离心20 min,取上清液,按ELISA 试剂盒说明书操作,于酶标仪450 nm波长测定吸光度(OD值),通过标准曲线计算IL-6、IL-1β含量。
1.2.7 Western blot 检测结肠组织NF-κBp65、MMP9、STAT3蛋白表达
结肠组织剪切成细小碎片,4 ℃、12 000 r/min离心5 min,取上清液,测定蛋白浓度。制备SDS-PAGE凝胶,利用转膜槽,在恒定电压下将凝胶中的蛋白转移至PVDF 膜上,用TBST 逐渐浸润;加NF-κBp65、MMP9、STAT3一抗(均为1∶1 000),4 ℃孵育过夜;用TBST洗涤PVDF膜3次去掉一抗,配制二抗稀释液并添加到保鲜膜上,室温孵育2 h,用TBST洗3次,每次10 min;进行化学发光反应。利用图像分析系统分析凝胶图像灰度值。
1.2.8 免疫组化法检测结肠组织NF-κBp65蛋白表达
结肠切片在二甲苯溶液中脱蜡,并在梯度递减的乙醇溶液中水化。然后用柠檬酸盐抗原修复溶液处理切片,用0.5%Triton X-100 溶液透化20 min,用3%H2O2溶液孵育,用5%牛血清白蛋白封闭切片20 min。再与NF-κBp65一抗(1∶500)于37 ℃温育1 h,PBS洗涤后,将切片与羊抗兔IgG(1∶1 000)于37 ℃温育20 min,经DAB显色、复染、脱水、透化、固定后,显微镜下观察,使用Image Pro Plus 软件计算平均OD值。
1.2.9 统计学方法
2 结果
2.1 药物活性成分及潜在靶点
检索TCMSP并根据OB与DL进行筛选并去除重复,得到芍药汤活性成分共197种,其中白芍13种、黄芩36种、黄连14种、当归2种、木香6种、槟榔8种、大黄16种、肉桂10种、甘草92种。利用UniProt数据库预测活性成分对应的靶点,选择基因型来源为“人类”且已被证实的数据进行基因名称标准化,共得到2 597个靶点,其中白芍104个、黄芩417个、黄连248个、当归55个、木香38个、槟榔36个、大黄88个、肉桂111个、甘草1 500个。
2.2 疾病靶点及交集靶点
GEO数据库中UC患者基因表达谱GSE87466包含108例黏膜活检样品,其中UC样品87例,正常样品21例。对P<0.05且|log2|>0.5的样品进行筛选,共获得有统计学意义的差异基因3 020个,其中上调基因1 681个、下调基因1 339个。将药物靶点与疾病靶点取交集,得到交集靶点69个,对应有效成分14种。
2.3 药物-化合物-疾病靶点网络
将交集靶点导入Cytoscape3.7.0软件,构建药物-化合物-疾病靶点网络,其中节点类型包括药物、有效成分、疾病和交集靶点,利用CentiScape插件计算有效成分的度值,度值越高提示该成分发挥主要功能的概率越大。将网络中的有效成分节点按度值排序,其中槲皮素(MOL000098)潜在靶点44个,其余为山柰酚(MOL000422)17个,油酸(MOL000675)16个,黄芩素(MOL002714)12 个,汉黄芩素(MOL000173)10 个,柚皮素(MOL004328)8 个,芦荟大黄素(MOL000471)、鳞叶甘草素A(MOL004828)、刺芒柄花素(MOL000392)、7-甲氧基-2- 甲基异黄酮(MOL003896)、木蝴蝶素(MOL002928)各7个,表明这些成分可能在芍药汤治疗UC中发挥较大作用。
2.4 蛋白相互作用网络及其拓扑分析
通过STRING数据库获得芍药汤治疗UC靶点PPI网络(见图1),该网络包括64个蛋白质节点和550条边。利用Cytoscape插件CytoNCA进行拓扑分析,选择介度中心性(betweenness centrality,BC)、接近中心性(closeness centrality,CC)、度中心性(degree centrality,DC)、特征向量中心性(eigenvector centrality,EC)、局部边连通性(localaverage connectivity,LAC)和网络中心性(network centrality,NC)为指标对基因进行筛选,选择所有指标大于其中位数的基因进行后续分析,经过2次筛选,最终获得核心基因10个,分别为IL1B、SPP1、CCL2、ICAM1、STAT3、MMP9、IL6、TNF、PPARG 和PTGS2,见图2。

图1 芍药汤治疗UC靶点PPI网络

图2 芍药汤治疗UC靶点网络拓扑分析
2.5 GO和KEGG通路富集分析结果
GO富集分析结果显示,芍药汤干预UC主要有脂多糖反应、细菌来源分子反应、药物反应等生物过程,主要涉及质膜外侧面、膜筏、膜微结构域等细胞组分,以及细胞因子受体结合、细胞因子活性、趋化因子受体结合等分子功能(见图3A)。KEGG通路富集分析结果显示,芍药汤干预UC主要集中在脂质和动脉粥样硬化、流体剪切应力与动脉粥样硬化、IL-17信号通路、TNF 信号通路、Th17 细胞分化、NF-κB 信号通路等(见图3B)。

图3 芍药汤治疗UC交集基因GO及KEGG通路富集分析
2.6 芍药汤对模型大鼠一般情况及疾病活动指数评分的影响
空白组大鼠精神良好,反应灵活,毛发有光泽,体质量自然增加,饮食及大便性状正常。造模大鼠于造模第3~5日开始出现精神不振,反应迟钝,毛发凌乱晦黯,饮食减少,体质量明显下降,大便不成形并伴有不同程度的黏液便、血便。与空白组比较,模型组DAI评分显著升高(P<0.01),提示造模成功。美沙拉嗪组及不同剂量芍药汤组大鼠精神状况、反应活动、毛发光泽、饮水摄食、体质量、大便性状及便血情况均有不同程度好转。与模型组比较,美沙拉嗪组和芍药汤各剂量组大鼠DAI 评分明显下降(P<0.01),见图4。

图4 各组大鼠DAI评分比较(±s,每组7~8只)
2.7 芍药汤对模型大鼠结肠组织病理形态的影响
空白组大鼠结肠组织结构正常,呈现出排列完整的腺体,可见隐窝与杯状细胞,未见明显炎性细胞浸润。与空白组比较,模型组大鼠结肠黏膜可见溃疡病灶,周围腺体缺损且分布杂乱,部分结肠与周围组织有粘连,肠黏膜充血、水肿明显且有广泛炎性细胞浸润。与模型组比较,美沙拉嗪组和芍药汤各剂量组结肠黏膜轻度充血水肿,炎性细胞浸润减少,部分结肠溃疡周围可见新生的腺体。随着芍药汤剂量增加,结肠的病理特征逐渐减弱。见图5。

图5 各组大鼠肠黏膜病理形态(HE染色,×100)
2.8 芍药汤对模型大鼠血清炎症因子含量的影响
与空白组比较,模型组血清炎症因子IL-6、IL-1β含量明显升高(P<0.01);与模型组比较,美沙拉嗪组及芍药汤低、中、高剂量组IL-6、IL-1β 含量明显降低,差异有统计学意义(P<0.01)。见表1。
表1 各组大鼠血清IL-6、IL-1β含量比较(±s,ng/L)
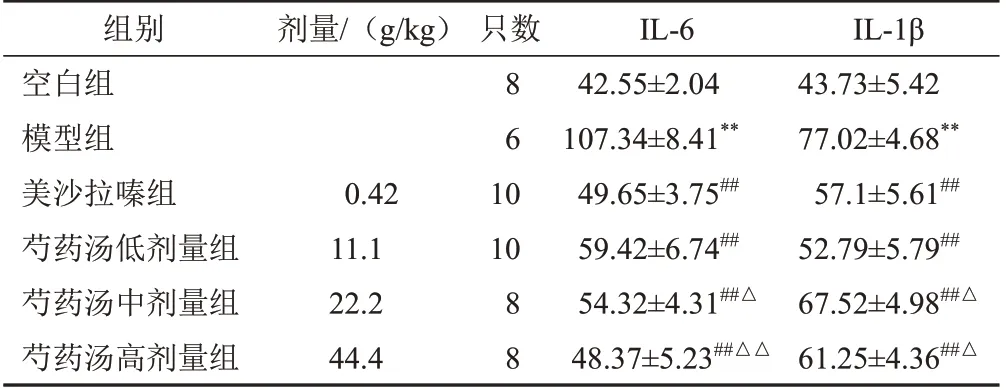
表1 各组大鼠血清IL-6、IL-1β含量比较(±s,ng/L)
注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与美沙拉嗪组比较,△P<0.05,△△P<0.01
组别空白组模型组美沙拉嗪组芍药汤低剂量组芍药汤中剂量组芍药汤高剂量组IL-1β 43.73±5.42 77.02±4.68**57.1±5.61##52.79±5.79##67.52±4.98##△61.25±4.36##△剂量/(g/kg)只数86 0.42 11.1 22.2 44.4 10 10 88 IL-6 42.55±2.04 107.34±8.41**49.65±3.75##59.42±6.74##54.32±4.31##△48.37±5.23##△△
2.9 芍药汤对模型大鼠结肠组织NF-κBp65、MMP9、STAT3蛋白表达的影响
选择关键靶点MMP9、STAT3进行Western blot实验,对关键通路NF-κB 中的NF-κBp65 表达进行Western blot和免疫组化检测,从蛋白水平观察芍药汤对关键靶点的影响。与空白组比较,模型组大鼠结肠组织NF-κBp65、MMP9、STAT3蛋白表达均明显上升(P<0.01);与模型组比较,芍药汤各剂量组NF-κBp65、MMP9、STAT3蛋白表达降低(P<0.01),表明芍药汤可通过抑制MMP9、STAT3 等关键靶点表达及干预NF-κB通路发挥作用。见图6、表2、图7、表3。
表2 各组大鼠结肠组织NF-κBp65、MMP9、STAT3蛋白表达比较(±s,/GAPDH,每组4只)

表2 各组大鼠结肠组织NF-κBp65、MMP9、STAT3蛋白表达比较(±s,/GAPDH,每组4只)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与美沙拉嗪组比较,△P<0.05,△△P<0.01
组别空白组模型组美沙拉嗪组芍药汤低剂量组芍药汤中剂量组芍药汤高剂量组剂量/(g/kg)STAT3 0.308±0.062 1.003±0.108**0.808±0.104##0.650±0.115##△0.528±0.079##△△0.715±0.065##△0.42 11.1 22.2 44.4 NF-κBp65 0.160±0.076 0.838±0.043**0.693±0.013##0.520±0.048##△△0.375±0.097##△△0.558±0.038##△MMP9 0.145±0.019 0.888±0.092**0.728±0.082#0.595±0.092##0.453±0.071##0.618±0.019##
表3 各组大鼠结肠组织NF-κBp65蛋白表达比较(±s,平均OD值)

表3 各组大鼠结肠组织NF-κBp65蛋白表达比较(±s,平均OD值)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与美沙拉嗪组比较,△△P<0.01
组别空白组模型组美沙拉嗪组芍药汤低剂量组芍药汤中剂量组芍药汤高剂量组NF-κBp65 0.007 0±0.001 3 0.013 2±0.001 9**0.010 4±0.001 8#0.011 4±0.001 3#0.005 8±0.001 6##△△0.006 2±0.001 4##△△剂量/(g/kg)只数0.42 11.1 22.2 44.4 455555
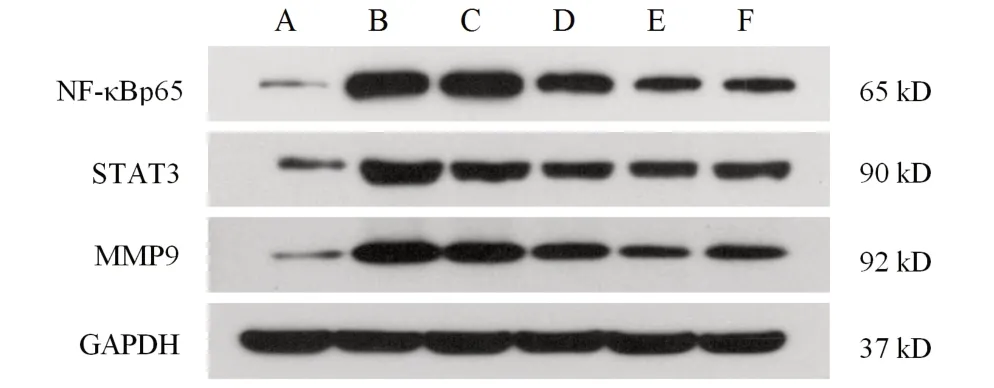
图6 各组大鼠结肠组织NF-κBp65、MMP9、STAT3蛋白免疫印迹
3 讨论
芍药汤为治疗UC湿热内蕴证的主方。药理研究表明,芍药汤可减少IL-1β、IL-18 含量,通过调控TXNIP/NLRP3信号通路改善肠上皮组织炎症[13],也可通过抑制MKP1/NF-κB/NLRP3通路减轻细胞焦亡,达到治疗UC的作用[14]。本研究基于多成分、多靶点作用的研究思路,应用网络药理学和生物信息学方法对芍药汤的有效成分进行筛选,预测其治疗UC的关键靶点和信号通路,并通过UC湿热内蕴证动物模型对关键靶点及相关通路进行验证,探讨芍药汤治疗UC湿热内蕴证可能的机制。
本研究通过构建药物-成分-靶点网络,筛选出芍药汤治疗UC的有效成分141种,高频有效成分包括槲皮素、山柰酚、油酸、黄芩素和柚皮素等,槲皮素具有抗氧化作用,通过抑制促炎介质释放和炎性蛋白表达,从而降低肠上皮炎症[15]。山柰酚是来源于多种药用植物的抗炎和抗氧化类黄酮,能抑制肠屏障破坏,并降低IL-1β、IL-6和TNF-α水平,下调一系列炎症信号分子转录,亦可下调TLR4-NF-κB信号传导[16],与本研究结果一致。动物实验表明,喂食含高水平油酸的食物能使大鼠肠道菌群发生变化,抗炎细菌属显著富集,从而改善肠上皮细胞炎症反应[17]。黄芩素在代谢过程中迅速转化为黄芩苷和其他黄酮类,并可能作用于PI3K-Akt、AMPK通路[18]。研究表明,黄芩苷可抑制IL-33和NF-κBp65表达,提高IκB-α水平,调节Th17/Treg平衡和肠道微生物菌群,从而发挥抗炎作用[19-20],木蝴蝶素可降低UC小鼠炎症细胞因子IL-6、IL-1β表达,从而抑制IL-6/STAT3信号通路[21]。柚皮素为二氢黄酮类化合物,具有抗菌、抗炎、抗氧化和抗肿瘤作用[22-23],可通过抑制炎症和氧化生物标志物治疗UC。以上研究支持网络药理学预测结果,即这些关键化合物可能在芍药汤对UC的治疗中发挥重要作用。
本研究获得芍药汤治疗UC的可能作用靶点69个,通过PPI网络筛选及拓扑分析最终获得IL-1B、SPP1、CCL2、ICAM1、STAT3、MMP9、IL6、TNF、PPARG和PTGS2共10个核心基因。IL-1β是IL-1分子家族的亚型之一,有研究显示,在TNF非依赖性UC小鼠模型中,IL-1β阻断剂可减少肠道炎症[24]。IL-6在诸多炎症中表达,本研究进一步动物实验结果显示,芍药汤能下调IL-6表达,进而减轻肠上皮炎症,促进肠黏膜修复。在UC相关癌变中,IL-6作为一种关键的NF-κB调节因子,受上游转录因子STAT3的调控[25]。有研究表明,白头翁汤和加味黄芩汤均可以通过下调STAT3-IL6-NF-κB轴,进而治疗UC[26-27]。MMP9在炎症性肠病中同样具有重要意义,在活动性UC中表达明显升高[28]。本研究实验验证表明,芍药汤能下调这些靶点,IL-1β、IL-6、STAT3、MMP9在UC发生发展中发挥关键作用,下调其表达有望改善UC预后。NF-κB是一种在炎症和免疫反应中起重要调节作用的核转录因子,具有多种生物功能,如参与调控体内细胞转化、增殖和凋亡,炎症和免疫反应,病毒感染等。NF-κB通路在UC患者细胞因子的释放中起核心调控作用,并参与UC肠道炎症和免疫反应[29]。促炎细胞因子分泌过多和抗炎细胞因子分泌相对不足之间的失衡与肠道非特异性炎症反应的发展有关[30]。NF-κBp65在UC患者肠黏膜上皮、隐窝上皮细胞和固有层单核细胞中高表达,其通过阻断NF-κB通路,下调NF-κB依赖的IL-1β和IL-8 mRNA表达,从而抑制UC患者促炎细胞因子的产生[31]。总之,NF-κB作为一种极为重要的转录因子,参与调节炎症反应、细胞凋亡等过程,可以调控UC中的细胞因子释放。因此,调控NF-κB通路或可成为UC治疗的重要策略。
综上,本研究以网络药理学预测为基础,通过数据挖掘,系统地对芍药汤有效成分进行研究,揭示中药复方与疾病之间的关联性,阐述了芍药汤治疗UC湿热内蕴证的相关机制,可为临床指导用药提供理论支持,同时,通过动物实验验证了网络药理学的部分预测结果,可为深入探究其药效物质基础与分子机制提供参考。
