褪黑素对胰岛β细胞增殖与功能及p38 MAPK蛋白表达的影响
2023-06-12王伟业李泽同
王伟业,尹 威,李泽同
(井冈山大学医学部,江西吉安 343009)
糖尿病患病率高、并发症多且危害严重,是当前全球面临的重要公共卫生问题之一[1]。近年来,有研究[2,3]发现褪黑素与糖尿病显著相关,但研究结论不一致。我们推测褪黑素与血糖水平间的关系并非线性,这需要相应的实验来验证。研究[4]发现,丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)通路中的p38通路被抑制时,可导致机体内胰岛素的分泌减少,致使糖尿病的发生。已有研究[5]在结肠癌RKO细胞中观察到了褪黑素对p38 MAPK通路的抑制作用。目前仍不明确褪黑素是否对胰岛β细胞p38 MAPK信号通路的激活产生抑制。本研究拟观察不同浓度褪黑素对胰岛β细胞的数量和功能的影响,并验证褪黑素抑制p38 MAPK信号通路的激活,旨在为糖尿病的发病机制提供新线索。
1 材料与方法
1.1 材料
INS-1大鼠胰岛素瘤细胞株购自易泽生物科技有限公司。SB203580购自碧云天生物技术有限公司;兔抗p38 MAPK多克隆抗体购自Signalway Antibody公司,兔抗p-p38多克隆抗体购自Proteintech公司,羊抗兔IgG购自诺莱生物医学科技有限公司。主要实验材料还包括RPMI-1640培养基(Gibco)、胎牛血清(Gibco)、磷酸盐缓冲液(Biosharp)、二甲基亚砜(MP Biomedicals)、褪黑素(Sangon Biotech)、胰蛋白酶消化液(Gibco)、β-巯基乙醇(MP Biomedicals)、CCK-8试剂盒(Dojindo)、MTT试剂盒(Yeasen)、小鼠胰岛素ELISA试剂盒(Bio-Swamp)、克-林二氏重碳酸盐缓冲(kleinberg bicarbonate buffer,KRBB)溶液(Coolaber)。
1.2 方法
1.2.1 细胞培养与实验分组 细胞采用10%胎牛血清RPMI-1640完全培养液,在37℃、饱和湿度、体积分数5%的CO2培养箱中进行静置培养。探讨褪黑素对INS-1细胞增殖和葡萄糖刺激胰岛素分泌(glucose-stimulated insulin secretion, GSIS)功能的影响设置以下分组:6个处理组(加100 nmol/L、50 nmol/L、25 nmol/L、10 nmol/L、5 nmol/L、1 nmol/L的褪黑素溶液)、对照组(无褪黑素处理)和本底组(空白调零)。探讨褪黑素对p38 MAPK蛋白表达的影响设置以下分组:褪黑素组(根据细胞增殖实验结果选定浓度10 nmol/L褪黑素处理)、SB203580(p38 MAPK抑制剂)组、联合组(褪黑素联合SB203580处理)和对照组。
1.2.2 CCK-8法检测细胞增殖 采用CCK-8法检测INS-1细胞增殖水平。实验严格按照CCK-8试剂盒说明书进行操作,主要实验步骤为细胞铺板、加药处理、细胞染毒、检测光密度(optical density,OD)值,检测波长设置为490nm。细胞增殖率计算公式为:(处理组OD-本底OD)/(对照组OD-本底OD)×100%。实验重复9次。
1.2.3 ELISA法检测GSIS功能 采用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法测定细胞GSIS功能。收集指数增长期的INS-1细胞,用含0.1%牛血清白蛋白的KRBB溶液缓慢冲洗2遍,再分别用含3 mmol/L和27.8 mmol/L葡萄糖的KRBB溶液孵育30min,收集细胞的上清液,用鼠源胰岛素ELISA测定试剂盒检测胰岛素浓度。各处理组和对照组细胞在检测前均在细胞板显微镜下进行计数标化。实验重复3次。
1.2.4 Western blot法检测蛋白表达水平 采用Western blot法检测胰岛细胞p38 MAPK和磷酸化p38(p-p38)MAPK蛋白的表达水平。细胞加药处理后加入裂解液,提取总蛋白。采用BCA法蛋白质定量试剂盒测定蛋白浓度,每组取等量样本进行SDS-PAGE凝胶电泳,电泳后转膜,封闭2 h,加一抗4 ℃过夜,所用一抗分别为1:2000兔抗p38 MAPK和兔抗p-p38多克隆抗体。TBST洗膜,加二抗(羊抗兔IgG 1:10000),室温孵育2 h,TBST洗膜3次,10 min/次。采用增强化学发光法,最后曝光、显影和定影。采用凝胶成像系统照相并进行定量分析,目的条带与内参GAPDH条带灰度值之比为目的蛋白的表达水平。实验重复3次。
1.3 统计学分析
采用SPSS软件25.0版本对数据作统计学分析,使用GraphPad Prism 软件9.0版本绘制图像。计量资料的统计描述采用均数±标准差()表示,2组总体均数的比较采用t检验,多组总体均数的比较采用单因素方差分析。检验水准α=0.05,P<0.05即为差异具有统计学意义。
2 结果
2.1 细胞形态
本研究在细胞培养过程中INS-1细胞状态正常,细胞聚集生长,生长速度快,密度达到一半时便出现细胞紧密连接成片生长的趋势。倒置显微镜下观察,细胞折光形较好。
2.2 褪黑素对INS-1细胞增殖率的影响
与对照组相比较,各处理组增殖率均显著下降,且随着褪黑素浓度的上升,增殖率呈现倒U型,即随着褪黑素浓度的升高INS-1细胞增殖率先升后降,以10 nmol/L褪黑素组的增殖率最高,见表1。
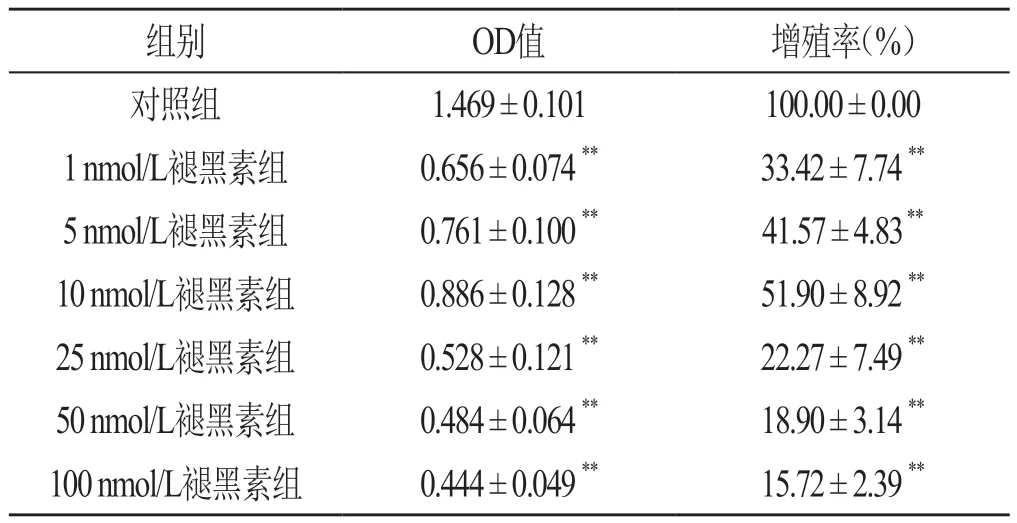
表1 褪黑素对INS-1细胞增殖的影响 (n=9,)
2.3 褪黑素对INS-1细胞GSIS功能的影响
分别采用3 mmol/L和27.8 mmol/L浓度葡萄糖刺激的GSIS功能试验结果显示,与对照组相比较,1 nmol/L、5 nmol/L、25 nmol/L、50 nmol/L和100 nmol/L褪黑素组的胰岛素浓度均显著下降,差异均有统计学意义(均P<0.05),且随着褪黑素浓度的上升,GSIS功能呈现倒U型,即随着褪黑素浓度的升高胰岛素水平先升后降,以10 nmol/L褪黑素组最高,见表2。
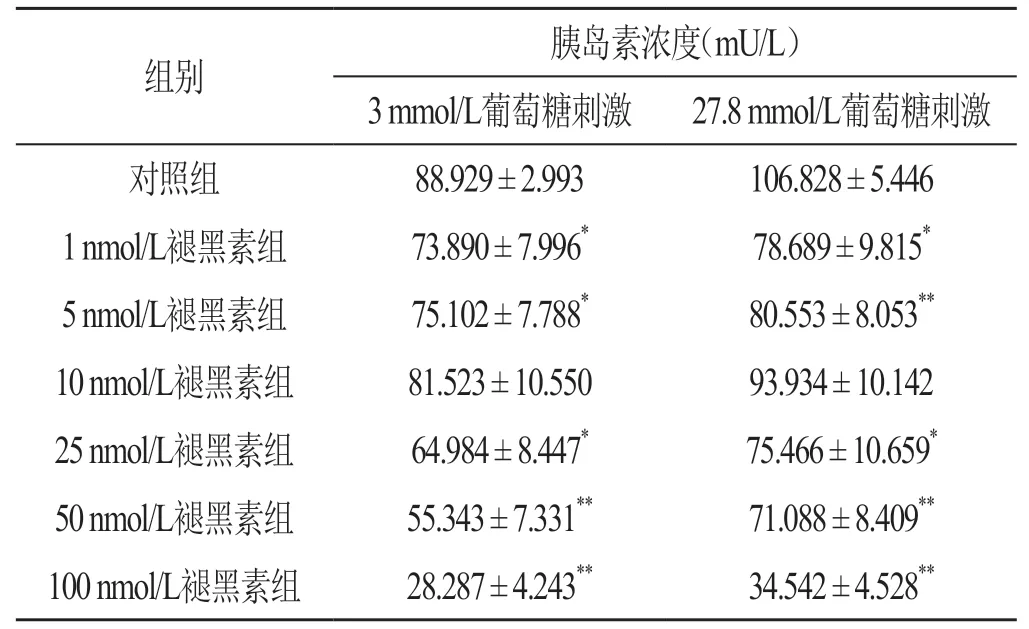
表2 褪黑素对INS-1细胞GSIS功能的影响 (n=9,)
2.4 褪黑素对INS-1细胞中p38和p-p38表达的影响
与对照组相比,褪黑素组和SB203580组均能显著降低p38 MAPK和p-p38 MAPK蛋白的表达水平(均P<0.05);与褪黑素组或SB203580组相比,褪黑素联合SB203580组p38 MAPK和p-p38 MAPK蛋白的表达水平均显著降低(均P<0.05),见图1、图2。
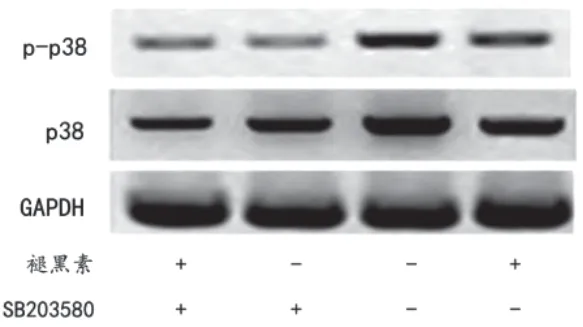
图1 各组中p38 MAPK和p-p38 MAPK蛋白表达水平
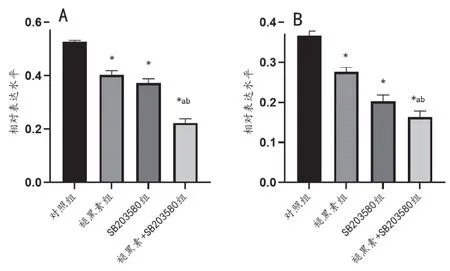
图2 各组中p38 MAPK和p-p38 MAPK蛋白表达水平的比较
3 讨论
由于人原代胰岛β细胞不易获取,且无法连续传代,多选用大鼠或小鼠的胰岛β细胞开展体外实验。实验常用的体外胰岛β细胞主要源于胰岛素瘤衍生和转基因技术构建所产生的两类细胞系。与其它胰岛β细胞相比,INS-1细胞包含的胰岛素分泌颗粒数量更多,能够更持续稳定地分泌胰岛素,且INS-1细胞更具GSIS反应性,更适用于GSIS相关研究[6]。此外,常用的体外胰岛β细胞会受胰高血糖素和生长抑素的影响,进而对实验结果产生干扰,而INS-1由于本身不合成以上两类激素而更适用于GSIS研究[6]。基于细胞的以上特点,本研究最终采用了INS-1细胞作为实验对象。
胰岛素的合成及分泌是胰岛β细胞的主要功能,胰岛β细胞数量的减少程度与糖代谢异常严重程度和胰岛素分泌量密切相关[7]。研究发现,褪黑素在与MT1、MT2受体结合后,将抑制胰岛β细胞的生长和分泌胰岛素功能,继而引起血糖水平的上升,机体的褪黑素水平与胰岛素释放水平间存在显著的负相关[8]。然而,另一些研究有着相反的结论。巴西开展的一项研究[3]显示,怀孕期间褪黑素的缺失会损害葡萄糖代谢;此外,他们发现在缺乏褪黑素的情况下,内分泌胰腺的功能和重塑都受到损害,褪黑素具有保护胰岛β细胞增殖和功能的作用。Sahar等[9]通过构建肾缺血再灌注后远端胰腺损伤大鼠模型,发现褪黑素可显著减轻远端胰腺的损伤情况,提高胰岛β细胞的数量。Shadia等[10]也发现褪黑素对糖尿病大鼠的β细胞功能具有改善作用。本研究观察到不同浓度褪黑素对INS-1细胞的增殖和GSIS功能有一定抑制作用,然而这种作用是非线性的,浓度过高或过低的褪黑素对INS-1细胞的损害作用最大,而中间浓度褪黑素损害作用相对较小。本研究的发现能较好地解释褪黑素对胰岛β细胞影响的有关实验研究结论不一致甚至完全相反的现象,其可能原因是不同研究褪黑素浓度不同。
经查阅文献,本研究首个探讨了褪黑素与胰岛β细胞p38 MAPK通路蛋白表达间的关系,发现褪黑素可抑制胰岛β细胞p38 MAPK信号通路。MAPK是一组能被G蛋白偶联受体(G-protein-coupled receptors,GPCRs)等细胞外刺激所激活的丝氨酸-苏氨酸蛋白激酶,是信号从细胞表面传导到细胞核内部的重要传递者。p38 MAPK广泛分布于各种组织细胞的细胞质内,在受到有关因素刺激后发生磷酸化从而被激活,然后进入细胞核并作用于AP-1等转录因子,促进基因的转录和表达,参与细胞的增殖和分化[11]。褪黑素对胰岛β细胞p38 MAPK信号通路的抑制作用可能由以下途径所致。第一,GPCRs可激活p38 MAPK信号转导途径,其可通过转激活受体酪氨酸激酶、负性调节器β抑制蛋白的介导和泛素发挥用,使得胰岛β细胞中p38 MAPK蛋白发生磷酸化,继而激活p38 MAPK通路并促进有关细胞的增殖;而褪黑素在与GPCRs结合后,会削弱GPCRs对p38 MAPK的活化作用[12,13]。第二,褪黑素与MT2受体结合会促进环磷酸腺苷的合成,而p38 MAPK是环磷酸腺苷作用的重要目标之一,环磷酸腺苷可通过细胞特异性方式对p38 MAPK通路进行激活或抑制[8,14]。褪黑素会对胰岛β细胞p38 MAPK信号通路的激活产生抑制作用,继而抑制了胰岛β细胞的增殖,这可能是褪黑素引起血糖异常的生物学机制之一。
综上所述,本研究观察到不同浓度褪黑素对INS-1细胞的增殖和GSIS功能有一定抑制作用,且这种作用是非线性的,而是呈倒U型,即浓度过高或过低的褪黑素对INS-1细胞的损害作用最大,而中间浓度的损害作用相对较小。此外,我们还发现褪黑素能抑制胰岛β细胞p38 MAPK信号通路。本研究结果或可为糖尿病的发病机制提供新线索。
