山楂叶提取物对庆大霉素诱导大鼠急性肾损伤的影响及机制研究
2023-06-12丰姝姝高旭杰张珂郭雪丽陈雯艳范双双李国玉王航宇王金辉
丰姝姝,高旭杰,张珂,郭雪丽,陈雯艳,范双双,李国玉,王航宇*,王金辉, 2
(1 石河子大学药学院/新疆植物药资源利用教育部重点实验室,新疆 石河子 832002;2 哈尔滨医科大学药学院,黑龙江,哈尔滨 150081;3 深圳弘汇医药科技有限公司,广东 深圳 518000)
急性肾损伤(Acute kidney injury,AKI)是一种急性炎症反应疾病,其特征是肾功能在7天或更短的时间内突然下降,是导致病情进展为慢性肾病的危险因素,具有高发生率和死亡率[1]。许多病因与AKI的病理生理过程有关,包括缺血再灌注损害、肾毒性药物、内源性毒素或感染[2-3]。近年来,AKI的发病率呈逐年上升趋势。据调查显示,全世界每年大约有1300万急性肾损伤患者,死亡人数也达到了170万[4-5]。然而,迄今为止,还没有针对AKI的特效药物,因此,寻找有效的AKI治疗方法备受关注。
山楂叶为蔷薇科(Rasaceae)山楂属(CrataegusL.)植物山楂(CrataeguspinnatifidaBge.)的干燥叶。现代药理学研究表明,山楂叶提取物有降糖、降脂、抗炎、抗氧化等多种药理活性[6-8]。近年来,研究者们对山楂叶的关注大多集中于心血管疾病方面,但在肾损伤方面的研究很少[9-10]。周其其等[11]研究发现山楂叶类黄酮可通过抗氧化和抗炎作用缓解高脂血症造成的肾损伤。因此,本研究探讨山楂叶提取物对庆大霉素所致AKI大鼠的影响及作用机制,为山楂叶治疗AKI的药用前景提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
健康清洁级雄性Sprague-Dawley(SD)大鼠48只,购自郑州市惠济区华兴实验动物养殖场,体重220±20 g,动物质量合格证号:SCXK(豫)2019-0002。本实验由石河子大学医学院第一附属医院实验动物伦理委员会批准。
1.1.2 实验仪器
N-1100旋转蒸发仪(上海爱朗仪器有限公司),TGL-16台式低速离心机(上海安亭科学仪器厂),Therrno 3001全自动多功能酶标仪(美国Thermo),Axio Imager A蔡司正置荧光显微镜(北京博瑞斯科技有限公司),DYY-6C电泳仪(北京六一生物科技有限公司),EC3510化学发光检测成像系统(美国UVP公司)。
1.1.3 实验试剂
山楂叶:采集于新疆林业科学院,盐酸维拉帕米缓释片(1127762):AbbVie Deutschland GmbH& Co.KG,硫酸庆大霉素注射液(01Y06011 C2):宜昌人福药业,一氧化氮合成酶(Nitric Oxide Synthase,NOS,20210604)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-PX,20210608)、丙二醛(Malondialdehyde,MDA,20210609)、总蛋白定量测定试剂盒(The total protein assay kit,20210610)、总超氧化物歧化酶(Superoxide Dismutase,SOD,20210609)、一氧化氮(Nitric Oxide,NO,20210531)、溶菌酶(Lysozyme,LZM,20210604)、β-N-乙酰氨基葡萄糖苷酶(β-N-acetyl-glucosaminidase,NAG,20210416)试剂盒:南京建成生物工程研究所,P-ERK1/2抗体(BM5446):武汉博士德公司,P-p38 MAPK(4631S)、P-JNK(4668S)抗体:Cell Signaling technology公司,β-actin(TA-09)、山羊抗小鼠(127655)、山羊抗兔(129256)抗体:北京中杉金桥生物技术有限公司。
1.2 实验方法
1.2.1 山楂叶提取物的制备
干燥山楂叶分别加入10倍量与8倍量的95%乙醇进行回流提取,每次提取时间为2 h,滤液浓缩成浸膏备用。
1.2.2 AKI动物模型
大鼠腹腔注射庆大霉素(100 mg·kg-1),连续7 d,于末次注射24 h后,大鼠眼眶静脉丛取血,血清测定SCR和BUN含量,然后收集大鼠24 h内的尿液,测定LZM和NAG含量,判断AKI模型是否建立成功。
1.2.3 动物分组及给药
将AKI大鼠随机分为模型组,山楂叶提取物低剂量组(0.5 g·kg-1),山楂叶提取物中剂量组(1 g·kg-1),山楂叶提取物高剂量组(2 g·kg-1)及阳性药组(维拉帕米,15 mg·kg-1),空白组和模型组给予生理盐水口服,其余组大鼠给予相应药物溶液口服,连续14 d。
1.3 观察指标及方法
1.3.1 肾体指数
实验动物末次口服给药24 h后,收集大鼠两侧肾组织,用生理盐水冲去表面血渍,滤纸擦干,记录重量,并计算肾体指数。
1.3.2 肾组织病理学
将固定于10%甲醛溶液48 h的肾组织浸入石蜡中,切片后,进行HE染色,使用光学显微镜拍照并观察。
1.3.3 肾功能指标
实验动物末次口服给药24 h后,腹主动脉取血,离心制备血清,测定SCR和BUN含量。
1.3.4 炎症因子
取大鼠右肾适量组织剪碎,加入预冷的生理盐水,制成10%肾组织匀浆。在4 ℃下离心得上清液,按ELISA试剂盒操作说明书,测定IL-1β、IL-6、TNF-α及KIM-1的含量。
1.3.5 氧化应激水平
10%肾组织匀浆上清用于大鼠NO、MDA、SOD、NOS及GSH-PX含量的测定。
1.3.6 肾组织P-p38 MAPK、P-ERK、P-JNK蛋白的表达
用RIPA裂解缓冲液(含0.1% PMSF)提取肾组织蛋白质。通过SDS-PAGE分离等量的蛋白样品,并将目的蛋白电转到PVDF膜上。经封闭液封闭1.5 h,和P-p38(1∶800)、P-ERK(1∶1 000)、P-JNK(1∶1 000)的抗体在4 ℃下孵育过夜,然后与山羊抗兔抗体孵育1.5 h,滴加ECL试剂,UVP拍照,Image J软件计算灰度值。
1.3.7 统计学分析

2 结果
2.1 大鼠AKI模型的建立
与空白组大鼠相比,AKI大鼠尿液中LZM和NAG酶活性显著升高(P<0.01),血清中BUN和SCR含量显著升高(P<0.01)。表明已成功建立大鼠AKI模型(图1)。
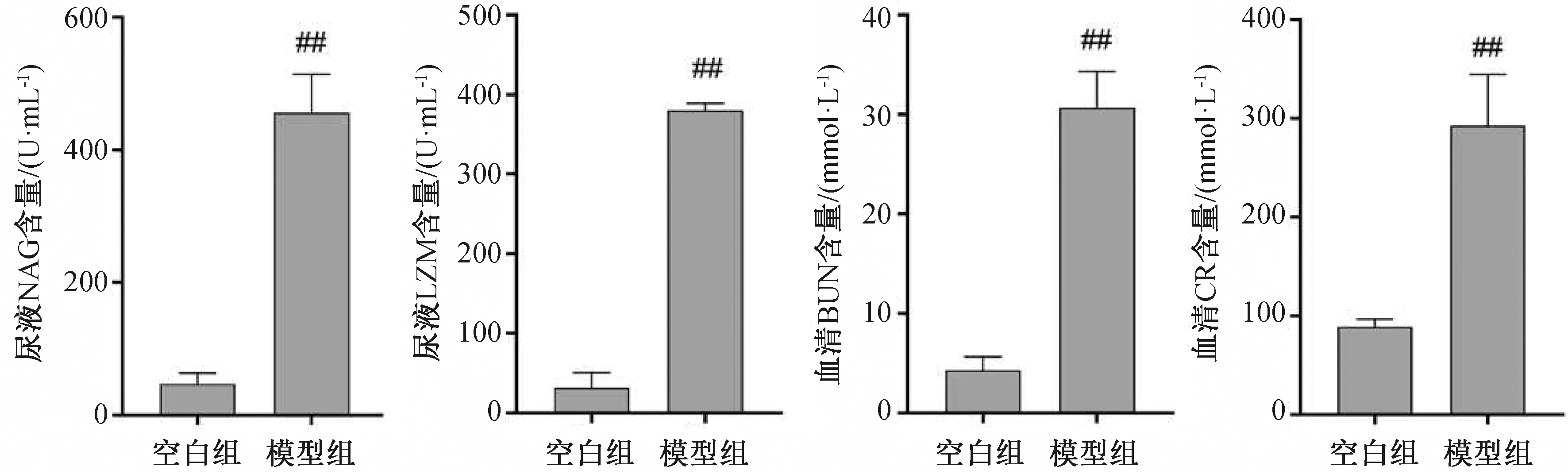
与空白组相比##P<0.01。图1 AKI模型组大鼠尿液NAG、LZM水平及血清BUN、SCR水平
2.2 山楂叶提取物对AKI大鼠肾外观和肾体指数的影响
实验动物解剖取材后,观察大鼠肾组织的外观。模型组大鼠肾脏组织明显肿大,并且泛白,经山楂叶提取物的处理后,肾肿大现象有所改善,并且颜色逐渐鲜红。计算肾脏系数,如图2所示,与空白组相比,模型组大鼠肾脏系数升高显著(P<0.01),山楂叶提取物呈剂量依赖性地降低这种上升趋势。以上结果说明,山楂叶提取物能够改善AKI大鼠肾脏的肿大情况,从而保护肾脏。
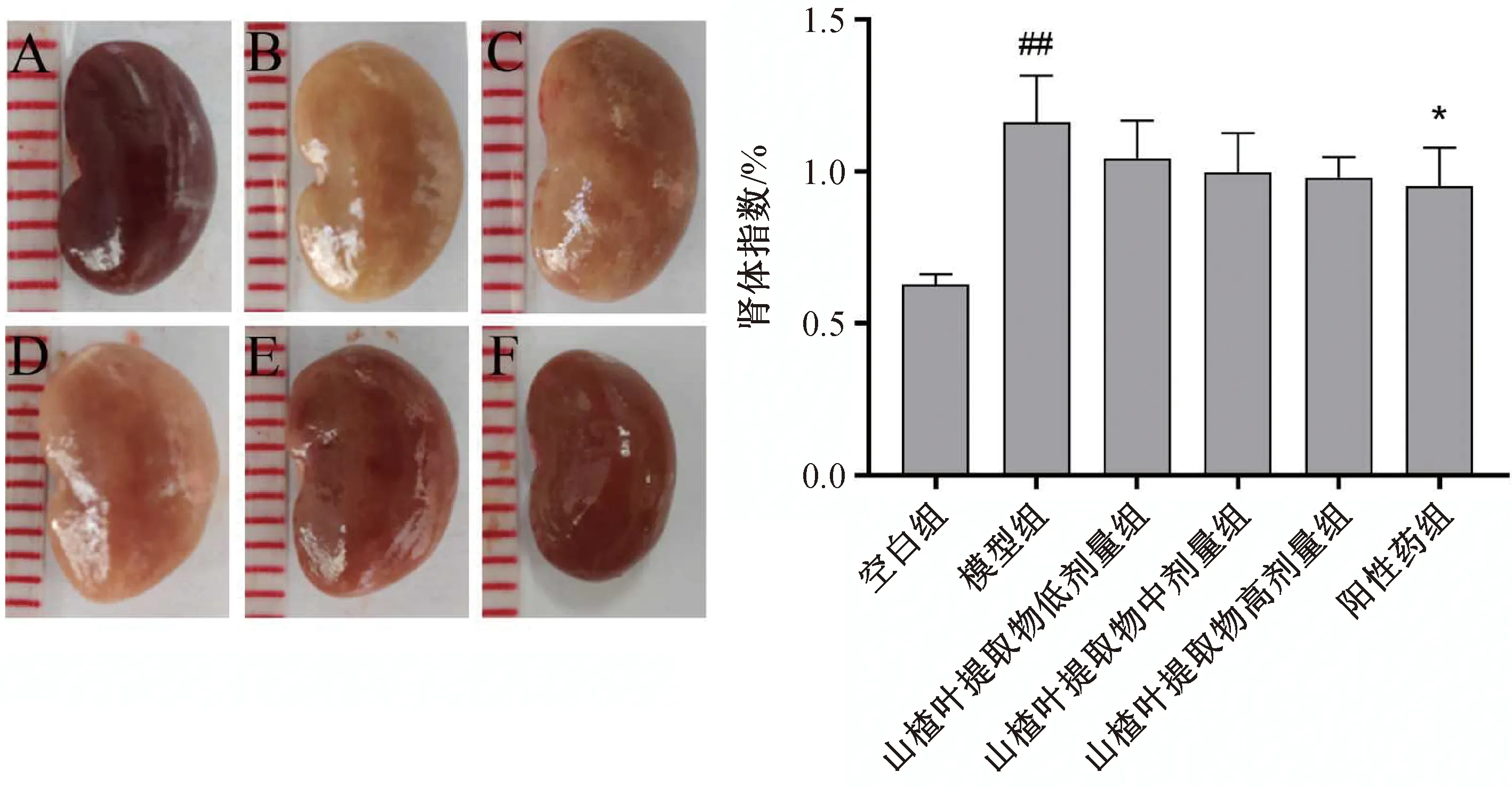
A: 空白组;B: 模型组;C: 山楂叶提取物低剂量组;D: 山楂叶提取物中剂量组;E: 山楂叶提取物高剂量组;F: 维拉帕米组;与空白组相比##P<0.01;与模型组相比*P<0.05。图2 山楂叶提取物对AKI大鼠肾外观及肾体指数的影响
2.3 山楂叶提取物对AKI大鼠肾组织损伤程度的影响
为了确定山楂叶提取物是否对庆大霉素诱导的AKI有保护作用,我们检查了大鼠肾脏组织的病理改变,结果如图3所示。空白组大鼠肾小管细胞摆列紧密,肾小球、肾小管形态正常;模型组大鼠肾脏结构明显被破坏,空泡增多,肾小管扩张,肾小管排列紊乱;与模型组相比,山楂叶提取物治疗后大鼠肾损伤的组织学特征逐渐改善,其中山楂叶提取物高剂量组效果最好。
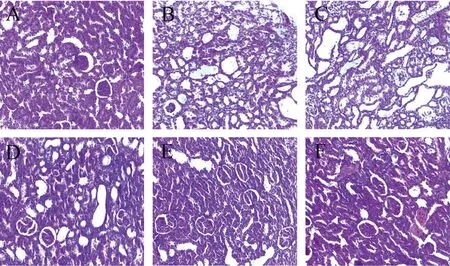
A: 空白组;B: 模型组;C: 山楂叶提取物低剂量组;D: 山楂叶提取物中剂量组;E: 山楂叶提取物高剂量组;F: 维拉帕米组。图3 肾组织H&E染色(200×)
2.4 山楂叶提取物对AKI大鼠血清BUN和SCR的影响
通过测量大鼠血清BUN和SCR含量评估肾功能。结果如图4所示,与空白组相比,模型组大鼠血清BUN和SCR含量升高,差异具有显著性(P<0.01);与模型组相比,山楂叶提取物能呈剂量依赖性地降低BUN和SCR的含量,且中剂量和高剂量组效果显著(P<0.05或P<0.01)。

与空白组相比##P<0.01;与模型组相比*P<0.05,**P<0.01。图4 山楂叶提取物对AKI大鼠血清中BUN(图A)和SCR(图B)的影响
2.5 山楂叶提取物对AKI大鼠肾组织IL-1β、IL-6、TNF-α及KIM-1的影响
AKI与全身和肾内炎症有关,炎症反应会降低肾功能,并促进晚期慢性肾病的发展。因此我们测定了炎症因子的表达。结果如图5所示,与空白组相比,模型组大鼠肾组织IL-1β、IL-6、TNF-α及KIM-1的含量显著升高(P<0.05或P<0.01);与模型组相比,治疗组大鼠肾组织IL-1β、IL-6、TNF-α及KIM-1的含量均有不同程度的降低(P<0.05或P<0.01),其中山楂叶提取物高剂量组显著降低(P<0.01)。说明山楂叶提取物可以降低AKI大鼠炎症因子水平,改善肾损伤。

与空白组相比##P<0.01;与模型组相比*P<0.05,**P<0.01。图5 山楂叶提取物对AKI大鼠肾组织中IL-1β、IL-6、TNF-α及KIM-1的影响
2.6 山楂叶提取物对AKI大鼠肾组织NO、MDA、SOD、NOS及GSH-PX含量的影响
结果如图6所示,模型组大鼠肾组织NO、MDA、NOS含量显著上升(P<0.01),SOD和GSH-PX含量显著下降(P<0.01)。而山楂叶提取物治疗后,与模型组大鼠比较,肾组织NO、MDA、NOS含量显著下降(P<0.05或P<0.01),SOD和GSH-PX含量上升,高剂量组效果显著(P<0.05或P<0.01)。因此,山楂叶提取物能够通过抗氧化途径来抑制AKI引起的氧化/抗氧化失衡。
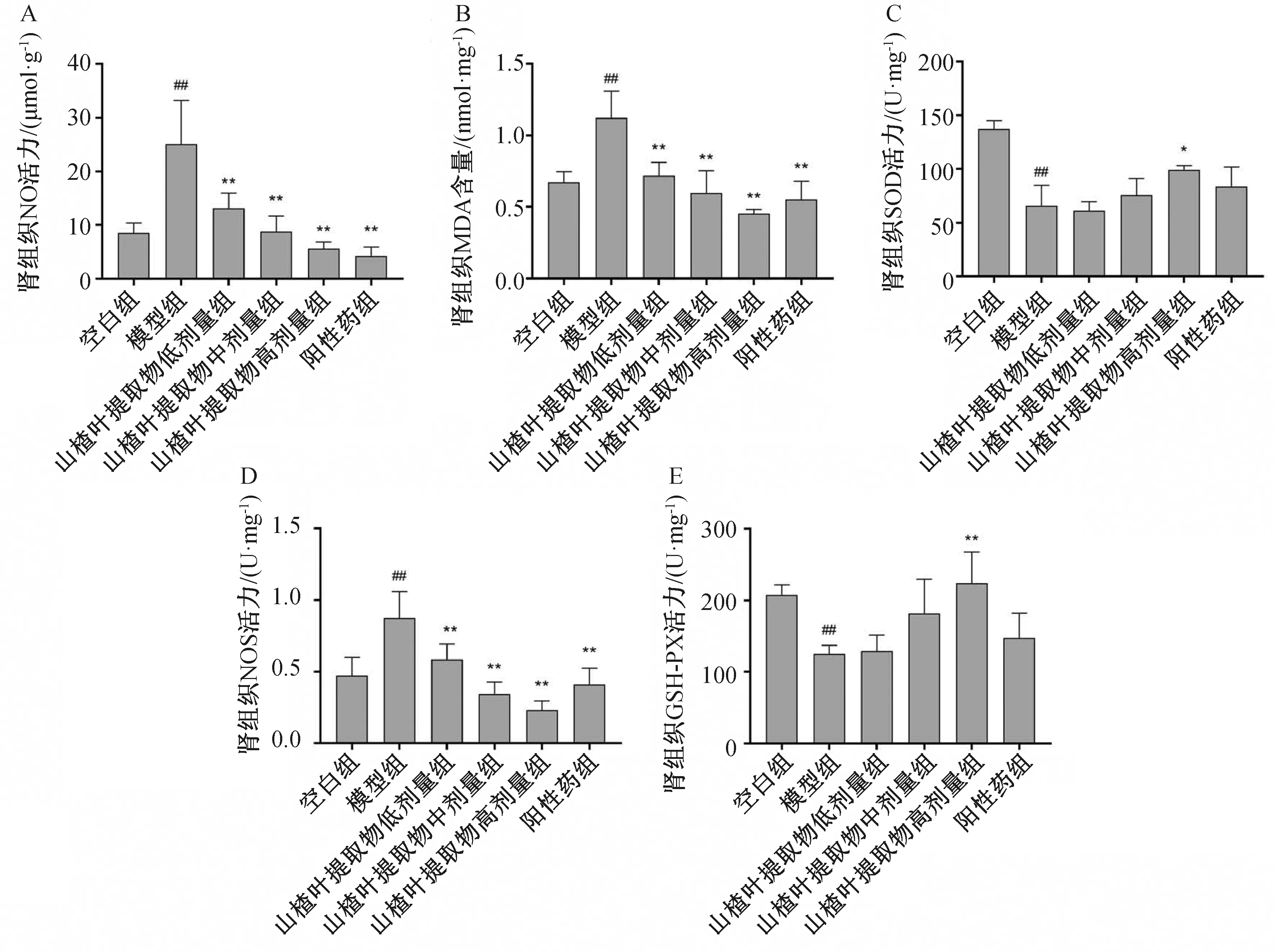
与空白组相比##P<0.01;与模型组相比*P<0.05,**P<0.01。图6 山楂叶提取物对AKI大鼠肾组织中NO、MDA、SOD、NOS、GSH-PX含量的影响
2.7 山楂叶提取物对大鼠肾脏P-p38 MAPK、P-ERK1/2、P-JNK蛋白表达的影响
为了进一步探索山楂叶提取物在AKI中的作用机制,使用Western Blot试验方法对P-p38 MAPK、P-ERK1/2、P-JNK蛋白表达含量进行检测。结果如图7所示,与空白组相比,模型组大鼠肾组织P-p38 MAPK、P-ERK1/2、P-JNK蛋白表达水平显著增加(P<0.05或P<0.01);与模型组相比,山楂叶提取物组大鼠肾组织P-p38 MAPK、P-ERK1/2、P-JNK蛋白表达水平降低(P<0.05或P<0.01),且山楂叶提取物高剂量组和阳性药组的蛋白表达量接近空白组。
3 讨论
庆大霉素是一种强效氨基糖苷类抗生素,在临床上主要用于治疗革兰氏阴性菌感染,但因为其能导致严重的肾毒性,因此限制了庆大霉素的临床应用[12-13]。黄酮类化合物是山楂叶中的主要成分,对肝、肾损伤及心肌缺血具有保护作用,具有极高的研究价值[14]。本实验通过建立AKI模型后给予山楂叶提取物口服给药,以探讨山楂叶提取物对庆大霉素所致AKI的影响。
庆大霉素引起的肾功能恶化表现为BUN和CR水平升高超过正常范围,KIM-1和NAG的含量发生显著变化。BUN主要经肾小球滤过,BUN的升高在一定程度上可以反应肾小球滤过功能的降低;实验结果显示,注射庆大霉素7 d后的大鼠尿液NAG、LZM含量及血清BUN、SCR水平较空白组相比,均显著性升高,提示成功建立AKI大鼠模型,这与先前的研究一致。随后AKI大鼠给予山楂叶提取物进行干预,病理学观察显示,空白组大鼠肾小管、肾小球形态正常;模型组大鼠肾小管扩张,肾组织结构破坏,损伤严重,且模型组大鼠血清BUN、CR含量较空白组显著上升;山楂叶提取物低、中、高剂量组大鼠较模型组相比,肾组织损伤有所减轻,BUN和SCR含量降低,说明山楂叶提取物能够改善肾组织病变,减轻庆大霉素导致的大鼠急性肾损伤。
氧化应激与庆大霉素诱导的肾毒性的发病机制密切相关。活性氧(ROS)的增加在庆大霉素引起的肾小管损伤的病理过程中扮演着重要的角色。当机体内氧化应激反应过强,不在机体的可调控范围内时,过多的氧化物质会蓄积,导致各器官发生损伤。SOD和GSH是机体内重要的抗氧化防御系统成员,对机体维持氧化平衡有重要意义;而MDA是脂质过氧化代谢产物,可以间接反映机体的氧化应激水平[15-16]。同时,ROS的过度产生会导致炎性细胞因子包括IL-1β、IL-6、TNF-α的表达增加[17]。与空白组相比,注射庆大霉素的大鼠肾脏中的MDA水平,NO和NOS含量显著增加,而抗氧化酶(GSH、SOD)含量显著降低。山楂叶提取物可拮抗这些改变,表明山楂叶提取物可改善庆大霉素诱导的氧化应激与炎症反应。
先前的研究已表明MAPK通路与氧化应激、细胞凋亡和炎症的调节显著相关,且氧化应激可能会诱导MAPK信号通路的激活[18-19]。因此,抑制氧化应激和MAPK通路的药物对AKI具有治疗潜力。MAPK信号通路是细胞内信号传导的重要途径,参与调控了细胞的增殖、分化和凋亡等生理病理学过程,主要相关效应蛋白包括p38、ERK和JNK[20]。本研究发现,山楂叶提取物可以抑制p38、ERK和JNK蛋白的磷酸化水平来减少细胞因子的产生,从而减弱庆大霉素诱导的炎症损伤。
综上所述,本研究表明山楂叶提取物能有效降低庆大霉素诱导的AKI大鼠的SCR和BUN水平,明显减轻其肾脏病理损伤,通过抑制肾脏中IL-1β、IL-6、TNF-α的含量来达到抗炎的作用,其保护机制可能与改善氧化应激,调控MAPK信号通路,下调P-p38 MAPK、P-ERK1/2和P-JNK的表达,从而减轻炎症反应,改善肾损伤,但其具体分子作用机制需后续进一步研究。
