冬凌草甲素抑制脂多糖诱导小鼠肺泡巨噬细胞炎症反应
2023-06-12郭民张瑞虎景志杰庞文彪陈朝阳
郭民,张瑞虎,景志杰,庞文彪,陈朝阳
(山西医科大学实验动物中心,山西 太原 030001)
革兰阴性菌细胞壁的主要成分脂多糖(lipopolysaccharide,LPS)是诱导炎症发生的重要物质[1]。炎症反应可以促进机体克服不利刺激、修复受损组织并恢复到稳态[2]。然而,它也可能产生不良后果,包括免疫失衡、进一步的组织损伤、败血症、器官衰竭等[3]。因此,寻求抗炎制剂来克服炎症的不良反应尤为重要。冬凌草甲素是从冬凌草中提取的一种具有多种生物活性的有效成分,具有抗炎、抗肿瘤等活性[4-5]。文献报道冬凌草甲素可以通过核因子κB(NF-κB)、核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)等信号通路抑制炎症反应[6-7],然而,其在不同的炎症诱导剂、不同的靶细胞发挥抗炎作用的机制不尽相同,对其抗炎机制仍有必要进行深入研究。
郎旭宇等[8]研究发现,冬凌草甲素通过NF-κB通路抑制脂多糖诱导的小鼠肺泡上皮细胞肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6和IL-1β表达而发挥抗炎作用;米伟等[9]研究发现冬凌草甲素通过下调TLR4、MyD88和p-P65表达进而抑制TNF-α、IL-6、IL-1β含量发挥抵抗高糖诱导的人肾小球系膜细胞炎症反应。然而冬凌草甲素对其他炎症介质如NO、COX-2和PGE2的抑制作用及可能机制研究较少。为进一步探究冬凌草甲素抗炎作用,本研究选择脂多糖(LPS)作为炎症诱导剂,以小鼠肺泡巨噬细胞(MH-S)为靶细胞,一氧化氮(NO)、环氧合酶-2 (COX-2)和前列腺素2(PGE2)为炎症介质,在基因和蛋白水平对冬凌草甲素的抗炎作用进行了研究,并进一步检测了丝裂原活化蛋白激酶的活力变化,以进一步揭示冬凌草甲素的抗炎作用及其作用机制。
1 材料与方法
1.1 试验药物
冬凌草甲素(美国Merck公司,批号:3239848,纯度≥94.2%),冬凌草甲素溶解于二甲基亚砜(DMSO)中,浓度为20 mg·mL-1,4 ℃避光保存,给药前用生理盐水稀释。脂多糖(LPS,美国Sigma-Aldrich公司,批号:L2880,纯度≥97%)。LPS用无菌生理盐水配置成1 mg·mL-1浓度,分装后-20 ℃保存,用时室温解冻。
1.2 细胞株
小鼠肺泡巨噬细胞株MH-S(山西医科大学实验动物中心保存,批号:QCE711)。
1.3 试剂
Trizol(批号:abs9331),反转录试剂盒(批号:abs601510),2×Real time PCR预混液(批号:abs601513),上海Absin公司;预染蛋白marker(批号:RTD6151),超敏ECL化学发光液(批号:EC2520),北京中科瑞泰生物科技有限公司;鼠抗ERK1/2单克隆抗体(批号:4696)、兔抗p-ERK1/2(Thr202/Tyr204)单克隆抗体(批号:4370)、兔抗JNK单克隆抗体(批号:9252)、鼠抗p-JNK(Thr183/Tyr185) 单克隆抗体(批号:9255)、兔抗 p38 单克隆抗体(批号:8690)、兔抗p-p38 (Thr180/Tyr182) 单克隆抗体(批号:4511)和鼠抗β-actin单克隆抗体(批号:3700),美国CST公司;HRP-羊抗兔IgG+HRP-羊抗小鼠IgG(武汉博士德有限公司,批号:BA1056);胎牛血清(武汉Procell有限公司,批号: 164210),RPMI-1640培养基(武汉博士德有限公司,批号:PYG0066);NO测定试剂盒(美国Thermo Fisher公司,批号:EMSNO),PGE2酶联免疫吸附试剂盒(上海通蔚科研生物科技有限公司,批号:TW8620),BCA蛋白定量试剂盒(上海碧云天生物技术公司,批号:P0012S)。
1.4 仪器
荧光定量PCR仪(美国ABI公司,型号:7500),超微量核酸检测仪(上海科器仪器设备有限公司,型号:Tnano-700),倒置显微镜(日本Olympus公司,型号:DSZ2000X),酶标仪(山东博科生物产业有限公司,型号:BK-EL10B),凝胶图像分析系统(北京天能有限公司,型号:Tanon 3500)。
1.5 方法
1.5.1 细胞培养
MH-S细胞培养于含10%胎牛血清的1640 培养基中,置于37℃、含5% CO2恒温无菌培养箱内培养,细胞融合度大于80% 时,用胰蛋白酶消化传代。
1.5.2 冬凌草甲素对细胞活性影响的台盼蓝实验
将细胞以每孔1×105个细胞的密度接种在24 孔板中,依文献[10]加入不同浓度冬凌草甲素(0.25、0.5、1.0、2.0 μg·mL-1),同时设置不加冬凌草甲素组(加入等体积生理盐水)作为对照组,分别作用24、48、72、96 h。室温1 500×g离心5 min,收集细胞后加入0.4% 台盼蓝对细胞进行染色。将染色后细胞加在血细胞计数板,光学显微镜下随机选取5个视野,计数100个细胞,计数活细胞(未染色)数量即为活细胞百分比,以评估冬凌草甲素对 MH-S 细胞的细胞毒性。
1.5.3 冬凌草甲素对脂多糖诱导的细胞炎症反应的影响
当MH-S 细胞生长至融合度约60%时,加入浓度分别为0.5、1.0、2.0 μg·mL-1的冬凌草甲素孵育2 h,同时设置不加冬凌草甲素组作为对照组,随后加入0.1 μg·mL-1脂多糖继续培养24 h[11],1 500×g离心5 min,分别收集细胞或细胞培养物上清液用于如下分析。
1.5.4 NO浓度的Griess测定
取1.2.3节中细胞培养上清液50 μL,置于96 孔板中,同时配置50 μL浓度分别为0、31.25、62.5、125、250、500、1 000 pg·mL-1的标准品。先后加入50 μL Griess A液 和G riess B 液,水平摇床轻摇混匀后室温孵育15 min,550 nm 处测定标准品和样品吸光度值,绘制标准曲线得出计算公式并计算样品中NO 浓度。
1.5.5 PGE2含量的ELISA法测定
取1.2.3节中细胞培养上清液100 μL,加入酶标板中,每个样品设2 个复孔,同时加入浓度分别为0、31.25、62.5、125、250、500、1 000、2 000 pg·mL-1的标准品。37 ℃孵育1 h,弃掉上清,洗涤3次,每次3 min;加入100 μL 生物素化抗体工作液,37 ℃ 孵育1 h,弃掉上清,洗涤3次,每次3 min;加入100 μL酶结合物工作液,37 ℃ 孵育30 min,弃掉上清,洗涤3次,每次3 min;加入90 μL 底物溶液,37 ℃ 避光孵育 15 min;加入50 μL 终止液,在450 nm 波长处检测吸光度值,绘制标准曲线得出计算公式并计算样品中PGE2含量。
1.5.6 iNOS和COX-2 mRNA表达量的qRT-PCR法检测
常规Trizol法提取1.2.3节收集的细胞总RNA,并用微量核酸检测仪检测RNA浓度及纯度(OD260/OD280值在2.0左右)。取1 μg总RNA作为模板进行反转录,依次加入2×反转录缓冲液(10 μL)、随机引物(0.5 μg·μL-1)1 μL、反转录酶(1 μL),最后加入无RNA酶水定容到20 μL,42℃温育15 min,85℃加热5 min以灭活反转录酶。以反转录得到的cDNA为模板构建PCR反应体系进行iNOS和COX-2基因的扩增,反应体系为2×qPCR 预混液(10 μL)、cDNA(1 μL)、上下游引物(10 μmol·L-1)分别0.5 μL,最后加水定容到20 μL,每个样品做3个复孔。同时扩增管家基因β-actin,记录每个基因扩增的Ct 值。
PCR反应条件为94 ℃变性30 s;94 ℃变性5 s,60 ℃退火延伸30 s,40个循环。
采用2-ΔΔCt法用来计算iNOS和COX-2 mRNA的相对表达水平,ΔΔCt=(实验组目的基因Ct值-实验组管家基因Ct值)-(对照组目的基因Ct值-对照组管家基因Ct值)。所有实验重复3次。引物序列见表1。
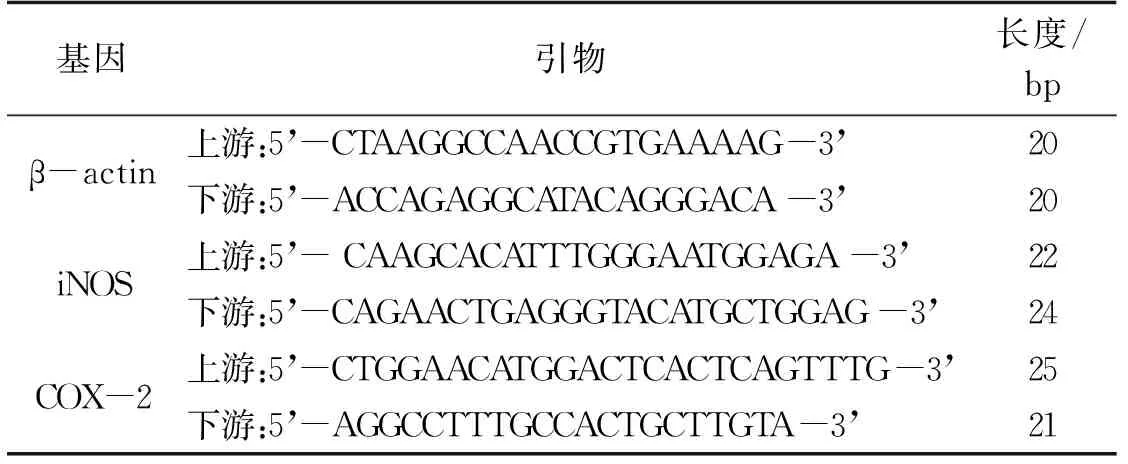
表1 β-actin、iNOS、COX-2的qRT-PCR引物序列
1.5.7 细胞ERK、JNK和p38及其磷酸化蛋白表达的Western blot法检测
在1.2.3节收集的细胞中加入100 μl SDS裂解缓冲液(50 mmol·L-1Tris 缓冲溶液(pH8.1),1% SDS),剧烈振荡后95℃煮沸10 min,室温13 000×g离心10 min,取上清进行BCA蛋白浓度定量,每样品取25 μg总蛋白进行SDS-PAGE,电泳结束后依次进行转模、5%脱脂奶粉封闭1 h、一抗4℃孵育过夜、辣根酶标记二抗室温孵育1 h和ECL显影,使用Tanon 3500凝胶图像分析系统分析蛋白条带灰度。β-actin为内参,目的蛋白条带灰度值与内参蛋白条带灰度值的比值表示目的蛋白表达水平;磷酸化蛋白条带灰度值与其对应的总蛋白条带灰度值的比值表示磷酸化蛋白表达水平。
1.5.8 统计分析
2 结果
2.1 冬凌草甲素对MH-2细胞活力的影响
台盼蓝染色法结果显示不同浓度的冬凌草甲素(0.25、0.5、1.0、2.0 μg·mL-1)处理组细胞活力与对照组差异无统计意义(P>0.05),见表2,表明在该浓度范围内冬凌草甲素对MH-S细胞没有明显细胞毒性。
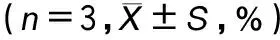
表2 不同浓度冬凌草甲素处理对MH-S细胞活力的影响
2.2 冬凌草甲素抑制LPS诱导的细胞iNOS及NO的生成
Griess 法结果显示,对照组MH-S细胞中NO含量为(0.903±0.16)pg·mL-1,脂多糖诱导组NO含量为(7.10±0.96)pg·mL-1,与对照组相比,脂多糖组NO含量显著升高,两组比较具有统计学意义(P<0.05),见表3。0.5、1.0、2.0 μg·mL-1冬凌草甲素组NO含量分别为(5.19±0.94)、(3.58±0.47)和(2.79±0.35)pg·mL-1,与脂多糖诱导组比较均降低(P<0.05),见表3,提示冬凌草甲素剂量依赖性地抑制LPS诱导的NO合成。荧光定量PCR结果显示与对照组iNOS mRNA(2-△△Ct为1.00±0.13)比较,脂多糖诱导组iNOS mRNA (2-△△Ct为14.34±0.09)表达显著升高(P<0.05),见表3;0.5、1.0和2.0 μg·mL-1冬凌草甲素组iNOS mRNA(2-△△Ct分别为10.56±0.48、6.49±0.22和3.41±0.53),与脂多糖诱导组比较,冬凌草甲素组iNOS mRNA 表达均降低(P<0.05),见表3,提示冬凌草甲素以浓度依赖性方式抑制iNOS mRNA 的表达。
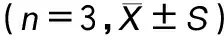
表3 不同浓度冬凌草甲素对LPS诱导MH-S细胞中NO的含量和iNOS mRNA表达水平影响
2.3 冬凌草甲素抑制LPS诱导的细胞COX2及PGE2的生成
RT-qPCR结果显示,与对照组COX-2 mRNA(2-△△Ct为1.00±0.13)比较,脂多糖诱导组COX-2 mRNA(2-△△Ct为25.34±2.09)表达显著升高(P<0.05)(表4);0.5、1.0和2.0 μg·mL-1冬凌草甲素组COX-2 mRNA(2-△△Ct分别为18.56±2.48、16.49±2.22和7.41±1.03),与脂多糖诱导组比较,冬凌草甲素组COX-2 mRNA 表达均降低(P<0.05),见表4。提示冬凌草甲素以浓度依赖性方式抑制COX-2 mRNA 的表达。ELISA法结果显示,对照组MH-S细胞中PGE2含量为(2.03±0.26)ng·mL-1,脂多糖诱导组PGE2含量为(7.58±0.41)ng·mL-1,与对照组相比,脂多糖组PGE2含量显著升高,两组比较具有统计学意义(P<0.05),见表4。0.5、1.0、2.0 μg·mL-1冬凌草甲素组PGE2含量分别为(6.37±0.34)、(5.58±0.61)和(3.84±0.75)ng·mL-1,与脂多糖诱导组比较均降低(P<0.05),见表4,提示冬凌草甲素剂量依赖性地抑制LPS诱导的PGE2合成。
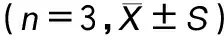
表4 不同浓度冬凌草甲素对LPS诱导MH-S细胞中COX-2 mRNA和PGE2的表达水平影响
2.4 冬凌草甲素抑制LPS诱导的MAPK蛋白的磷酸化
Western blot结果如图1和表5 所示,与对照组比较,脂多糖诱导组p38、ERK 和JNK 的磷酸化水平均明显升高(P<0.05);与脂多糖诱导组比较,冬凌草甲素组p38、ERK 和JNK 的磷酸化水平均均明显降低(P<0.05),而各组p38、ERK 和JNK 的总含量没有改变,提示冬凌草甲素以浓度依赖性方式降低其磷酸化。尽管冬凌草甲素对p-p38和p-ERK抑制效果优于对p-JNK的效果,但这些结果表明冬凌草甲素通过抑制MH-S 细胞中MAPK 活化来发挥抗炎作用。

1:对照组,2:LPS诱导组,3:0.5 μg·mL-1冬凌草甲素干预组,4:1.0 μg·mL-1冬凌草甲素干预组,5:2.0 μg·mL-1冬凌草甲素干预组。图1 冬凌草甲素抑制脂多糖诱导的p38、ERK和JNK磷酸化的Western blot检测
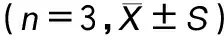
表5 冬凌草甲素对LPS诱导MH-S细胞p38、ERK 和JNK蛋白表达的影响
3 讨论
近年来,越来越多的中药提取物被报道具有体外和体内抗炎作用[12]。冬凌草甲素是1种从冬凌草中分离出来的天然物质,具有抗氧化、抗炎和抗肿瘤活性[4-5],然而其抗炎机制尚未完全阐明。
诱导剂、传感器、炎症介质和靶组织构成炎症通路。脂多糖作为革兰阴性菌外膜的基本成分,已被广泛用作炎症诱导剂[13]。肺泡巨噬细胞表达Toll样受体,后者在炎症发生中发挥传感器作用[14]。肺泡巨噬细胞作为靶组织细胞,在炎症发生中可以吞噬入侵的病原体并分泌炎症介质(如NO、COX-2和PEG2)。脂多糖是公认的巨噬细胞iNOS转录合成的最佳诱导剂,L-精氨酸在iNOS作用下生成NO,而NO可以进一步促进炎症因子如白细胞介素-1、肿瘤坏死因子和干扰素-γ的表达,加速炎症反应[15]。COX-2是1种在炎症因子刺激下生成的诱导性酶,其可以催化花生四烯酸生成前列腺素产物(如PGE2),而前列腺素产物为炎性介质,参与炎症的发生发展[16]。本研究中,观察到 LPS 处理显着增加了MH-S 细胞中 NO、COX-2 和 PGE2 的产生,而冬凌草甲素以浓度依赖性方式抑制了这些促炎介质,表明冬凌草甲素具有抗炎作用。
MAPK 信号通路包括ERK、p38 MAPK 和JNK,参与LPS、PM2.5等诱导的细胞炎症反应[17-18]。MAPK信号通路活化的标志是ERK、p38 MAPK 和JNK磷酸化水平升高,一旦MAPK 家族被激活,细胞内信号就会激活各种级联信号分子,促进炎症介质的表达,而抑制任何或所有三个MAPK信号分子就可以阻止炎症反应。本研究中,LPS 诱导的MH-S细胞中p38、ERK 和JNK 的磷酸化水平升高,而冬凌草甲素以剂量依赖性方式减弱其磷酸化。综上,本研究发现冬凌草甲素通过抑制MAPK 信号转导通路进而下调促炎介质 NO、COX-2 和 PGE2 的表达,发挥抗炎作用。
冬凌草甲素抗炎作用及机制在不同的炎症诱导细胞和动物模型中已有研究。宋沁岚等研究提示冬凌草甲素通过抑制核苷酸结合寡聚化结构域样受体3(NLRP3)通路减缓LPS诱导的小鼠Raw264.7巨噬细胞TNF-α、IL-6和IL-1β等炎症因子[19];郐一贺等研究发现冬凌草甲素通过抑制TLR4-NF-κB信号通路下调Raw264.7细胞促炎因子TNF-α、IL-1β、IL-6、IL-10进而发挥抗炎作用[20];Huahong Yang等研究显示冬凌草甲素通过抑制Nrf2和NF-κB信号通路减轻LPS诱导的急性肺损伤小鼠氧化应激和炎症反应[21],这些研究结果均提示冬凌草甲素可以通过多条信号通路降低LPS诱导的炎性细胞因子。而本研究采用LPS诱导小鼠肺泡巨噬细胞MH-S制备炎症模型,结果发现冬凌草甲素可以下调LPS诱导的炎症因子NO、COX-2 和 PGE2,机制研究显示冬凌草甲素可以抑制LPS激活的MAPK信号通路,尤其对p38和ERK通路的下调作用比较明显,而p38/ERK信号通路与NF-κB信号通路在炎症反应调控中常发生crosstalk[21],这也可以解释不同团队在冬凌草甲素抗炎机制研究得出不同信号通路的结论,其实它们之间相互关联,而我们的发现均是对冬凌草甲素抗炎作用及机制的有益补充。
