基于实验证据建构认知模型的教学设计
2023-06-12熊娟
熊娟


摘要:基于证据推理与模型认知的化学教学是课堂教学设计的重要研究内容。本文以人教版选择性必修1“原电池”的课堂教学为例,从单液原电池的实验现象和电流变化发现问题,引导学生从单液原电池模型逐步完善到双液原电池、隔膜电池,深入掌握原电池的本质规律。建立从真实问题出发,获取实验证据为依据,构建认知模型思維模式。提高学生发现问题、解决问题的能力,培养学生“证据推理与模型认知”“科学探究与创新意识”的核心素养。
关键词:实验证据;模型认知;原电池;本质规律
文章编号:1008-0546(2023)10-0028-06
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2023.10.007
“证据推理与模型认知”是高中化学核心素养的重要组成部分。基于证据推理与模型认知的化学教学是课堂教学设计的重要研究内容。在课堂教学中培养学生证据意识,建立观点、结论和证据之间的逻辑关系[1]是建构认知模型的重要途径。学生通过完整的逻辑链证据建立的“模型认知”,构建更全面、解释更准确、运用更灵活、衍生更广泛。实验证据是在实验中发现问题或不足,通过分析或改进实验解决问题的重要证据推理过程。在实验改进中学生不断完善认知模型,建立多重模型认知。本文以人教版选择性必修1“原电池”教学为例,设计基于实验证据建构认知模型的课堂教学,提高学生发现问题、解决问题的能力,培养学生“证据推理与模型认知”“科学探究与创新意识”的核心素养。
一、教学内容和教学现状分析
原电池的基本概念和工作原理是人教版必修第二册第六章第一节“化学反应与能量变化”中的必备核心知识。学生具备单液原电池的模型认知和电极反应的符号表征能力。但对于原电池仍有认识偏差,如以为锌和稀硫酸必须接触才能引发原电池反应产生电流等等。人教版选择性必修1第四章第一节“原电池”直接提出单液原电池电流会逐渐衰减,引入铜一锌双液原电池,组织学生展开一系列的“思考与讨论”[2],发展学生对原电池工作原理的认识,建立原电池过程的系统分析思路,提高学生对原电池本质的认识。[1]
笔者在教学中发现三个问题:①学生对铜一锌双液原电池实验未做,停留在看视频实验阶段,对于盐桥陌生且存疑。②铜一锌双液原电池是针对单液原电池的不足中改进而来,铜一锌双液原电池是否也有不足,没有进一步的探究讨论。③单液原电池和双液原电池的模型是直接建构的,重点解释原电池的工作原理,忽视模型认知的证据推理过程。
二、课堂教学改进
1.利用数字电流传感器,实时监测原电池中电流的变化。通过可视化的电流变化探析微观电子定向移动。在监测电流的变化中发现问题,引导学生解决问题,通过实验证据构建多重原电池认知模型。
2.自主设计隔膜原电池。双液原电池存在电流小、盐桥配制不方便和存放时间短等不足,引导学生解决问题,设计隔膜电池,增大接触面积,增大电流且使用方便。培养学生科学探究和创新意识的核心素养。
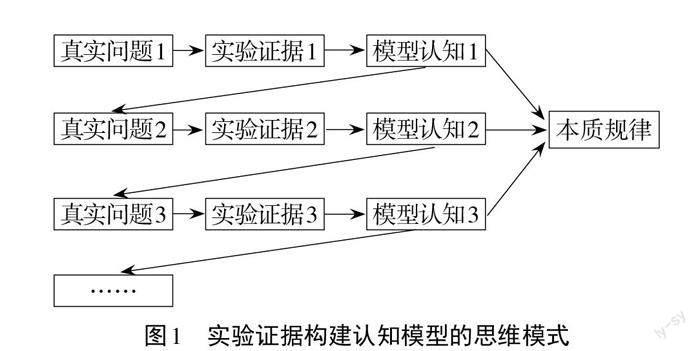
3.建构“实验证据与模型认知”逐级发展思维模式(图1)。
三、教学目标
1.通过单液原电池强化电极反应、电极材料、离子导体、电子导体四个基本电池构成要素,构建原电池基础模型。
2.通过实验证据发现真实问题,进一步思考解决问题,完善原电池思维模型。培养学生发现问题、解决问题的关键能力,提高学生证据推理与模型认知、科学探究与创新意识的核心素养。
3.通过实验证据逐步构建多重原电池模型,总结原电池本质规律,为后续原电池设计、电源分析、隔膜电化学讨论构建思维模型,形成从化学理论到实践应用过程的科学态度。
四、教学流程
教学流程(表1)。
五、教学实录
1.创设情境
【教师】我校优秀校友,大家的学长戴宏杰院士是中国科学院外籍院士、美国科学院院士。戴院士团队开发的一种具有超快充电、不易燃烧爆炸、可折叠、材料成本低等突出优点的铝离子电池于2015年4月6日在Nature杂志网络版发表。超快可充电铝离子电池的基本原理是同学们高一学过的原电池。
【学生】快速浏览Nature杂志网络版新型铝离子电池(见图2)。
2.单液原电池
【教师】火力发电厂将化学能通过一系列能量的转化转变成电能,多次转化中会造成能量的损失。怎样直接将化学能转变成电能?
【学生】可以设计成原电池。
【教师】请同学们分组利用铜、锌和硫酸铜溶液设计原电池,接人数字电流传感器。
根据实验讨论:①单液电池工作原理及电极判断和反应。
②观察实验现象和电流变化。
③根据实验现象发现组装的原电池有哪些不足?可以怎样解决呢?
【学生实验】分组实验,组装铜、锌和硫酸铜溶液单液原电池(图3、图4)。
【学生交流】
工作原理:负极锌失电子经外电路到正极铜;溶液中铜离子向负极锌定向移动,锌离子向正极铜定向移动,构成闭合回路。
电极反应:负极Zn-2e-=Zn2+(氧化反应)正极Cu2++2e-=Cu(还原反应)
实验现象:铜表面有红色铜生成,锌表面有红色铜覆盖(图5);电流不断衰减(图6)。
不足之处:锌与硫酸铜溶液接触,直接电子得失。电流不稳定,衰减快。化学能部分转化成热能,没有全部转化成电能,能量损耗大。
解决方案:让锌与硫酸铜溶液不接触。
3.双液原电池
【过渡】根据同学们发现的问题和想到的解决方案,我们将原电池进行改进(图7)。大家讨论是否可行?
【学生】不可行,没有形成闭合回路。
【教师】怎样形成闭合回路呢?介绍盐桥。盐桥是将饱和KCI溶液和琼脂加热成糊状,趁热注入U形管中,冷却后仍然有自由移动的离子的装置。请同学们利用盐桥组装双液原电池,接人数字电流传感器。
根据实验讨论:①双液电池工作原理及电极判断和反应。
②盐桥的作用。
③观察实验现象和电流变化。
④根据实验现象发现双液原电池有哪些不足?可以怎样解决呢?
【学生实验】分组实验,组装铜、锌和硫酸铜溶液双液原电池(图8、图9)。
【学生交流】
工作原理:负极锌失电子经外电路到正极铜;盐桥中K+向正极移动,CI-向负极移动。构成闭合回路。
电极反应:负极Zn- 2e-=2n2+(氧化反应)正极Cu2++2e-=Cu(还原反应)
盐桥作用:①形成闭合回路;②平衡溶液中的电荷;③将Zn与硫酸铜溶液分离。
实验现象:铜表面有红色铜生成,锌慢慢减少,表面没有铜附着;电流读数稳定,但很小(图10)。
不足之处:电流稳定,但是电流非常小。离子移动的距离远,电阻大。
解决方案:缩短盐桥、增大盐桥U形管口径,增大离子的接触面积。
4.隔膜原电池
【过渡】同学们通过实验发现了双液原电池的不足,并想到了解决办法。是否有更好地满足大家改进要求的物品代替盐桥呢?
【教师】介绍离子交换膜(图11)。离子交换膜是对离子具有选择透过性的高分子材料制成的薄膜。常见的有只允许阳离子通过的阳离子交换膜、只允许阴离子通过的阴离子交换膜和只允许H+通过的质子交换膜。将阴离子交换膜固定在电解槽中,可以组成隔膜电池。
【教师演示】组装铜、锌、硫酸铜溶液阴离子交换膜电池,接人数字电流传感器(图12、图13、图14)。
根据实验讨论:①隔膜电池工作原理及电极判断和反应。
②阴离子交换膜的作用。
③观察实验现象和电流变化。
④隔膜电池有哪些不足?可以怎样解决呢?
【学生交流】
工作原理:负极锌失电子经外电路到正极铜;正极溶液中S042-向负极方向定向移动。构成闭合回路。
电极反应:负极2n_2e-=2n2+(氧化反应)正极Cu2++2e-=Cu(还原反应)
阴离子交换膜的作用:①形成闭合回路;②允许阴离子自由移动,平衡溶液中的电荷;③阻止CU2+进入负极溶液,将Zn与硫酸铜溶液分离;④增大离子的接触面积,减小电阻。
实验现象:铜表面有红色铜生成,锌慢慢减少,表面没有铜附着;电流读数稳定,电流大(图15)。
不足之处:电源中的溶液不方便携带。
解决方案:向两极溶液中加入琼脂等,将溶液固定。
5.课堂小结
【过渡】同学们通过实验证据发现原电池的不足,并成功改进。现在科研工作者有关电池的研究和开发大都通过改变电解质状态、利用隔膜等改进,实现更方便、高效、安全的电池。下一节课“化学电源”学习中我们会进一步探究和学习。
【教师】本节课同学们通过实验证据逐步构建了单液原电池、双液原电池和隔膜电池的模型认知。请同学总结这三种原电池(表2)。
【学生】小组讨论,发表观点。
【教师】三种电池的本质规律相同,都是将自发进行的氧化还原反应分别在两极进行,通过电极材料、离子导体、电子导体构成闭合回路。同学们课后可以查阅各种新型电池,按原电池的本质规律分析其工作原理,了解新型电池的应用和发展方向。
六、教学反思
1.真实实验证据,形成科学精神
《普通高中化学课程标准(2017年版2020年修订)》中界定的“证据推理和模型认知”核心素养重在培养学生的证据意识,基于证据构建模型,运用模型揭示本质规律。[3]真实的证据对于学生模型构建和理解本质规律有重要作用。实验证据是基于实验现象的真实证据,对于学生有体验性和可视性。教师设计获得实验证据过程需注意实验原理和实验过程符合学生的认知;实验现象、实验数据真实可信。本节课利用朗威8.0数字电流传感器实时监测电流,充分利用数字化信息技术,使微观电流变化的实验证据定量、真实,引导学生提出真实问题,验证改进效果。本节课多次获取实验证据的过程加强了学生的证據意识,使学生逐步形成获取、收集、整合证据意识的科学精神。
2.完善模型认知,寻找本质规律
基于证据推理构建认知模型,是由现象到本质、由个体到群体的进阶过程。根据学生的学情,教师应引导学生分析归纳证据,帮助学生认知、建构、修正、应用相关模型。[4]构建模型认知的过程是一个逐步完善、循序渐进的过程。模型构建和完善过程中跨度不宜太大,涉及的变化要有说明和证据。本节课从学生已有模型认知单液原电池着手,通过实验证据提出真实问题,通过盐桥、离子交换膜解决问题,完善模型认知。教学最后比较所有模型,寻找构建原电池的本质规律,修正原电池中还原剂需和氧化剂接触的认识偏差,为原电池模型的应用——化学电源和讨论有关隔膜电化学问题奠定基础。
3.鼓励解决问题,培养创新意识
解决问题的能力是学生在未来面对与学科相关的生活实践或学习探索问题情境时必须具备的能力[5]。通过获取证据创设真实问题情境,学生需要在思维上主动、理性、科学思考解决问题。这也是学生在发展中打破固有的认知,构建新结论,适应时代要求的重要能力。本节课学生从认知的角度不一定能提出盐桥、离子交换膜等方法,但是可以从原理的角度提出将还原剂和氧化剂分离,增大离子间接触面积等设想。教师在深挖教材、精心设计的基础上,不断创新实验,自制隔膜电池,将学生的设想变成现实,提高教学效果、激发学生解决问题的兴趣,培养学生的创新意识的化学学科素养。
参考文献
[1] 王晶,郑长龙.普通高中教科书:化学选择性必修1[Ml.北京:人民教育出版社,2019:94.
[2] 中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020.
[3] 余腾,李欣.高中数理化,基于数字化实验发展“证据推理与模型认知”素养的教学设计[J].2020(9):75-77.
[4] 朱如琴.化学教育(中英文),基于证据推理与模型认知的主题式复习[J].2021(21):41-46.
[5] 教育部考试中心.中国高考评价体系[M].北京:人民教育出版社,201 9.
