碳中和情境下的化学反 原理深度乏习
2023-06-12郭金花
郭金花


摘要:在“碳中和”情境中,引导学生提出研究课题“二氧化碳和甲烷重整制合成气”,思考该课题需要研究反应的自发性,反应条件的控制以及催化剂的选择等内容。在还原科学研究的过程中,融入化学反应方向、反应速率和反应限度等反应原理的深度复习。在学法指导上,引导学生自主构建反应焓变认知模型、速率与平衡“归因类”问题解决模型和催化剂认知模型。
关键词:碳中和;情境;化学反应原理;深度学习;高阶思维
文章编号:1008-0546(2023)10-0065-07
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2023.10.014
最近几年随着高考改革的不断深入,每到高三,学生在做完几套高考真题或模拟题后一般会有这些议论:“有些大题目中的题干信息太陌生了,根本看不懂,不少答案都是蒙的;到了高三,突然感觉化学跟没学过一样,考的跟学的好像不是一回事。”从学生的考试感受中可以发现三个问题:一是高三试题中出现了大量新颖的情境,由于情境的陌生,学生很难找到答题的准确方向;二是反映了在平时的化学教学中,尤其是高三化学复习教学中,情境教学不够深入,学生不知道所学知识的应用环境,出现了考教脱节的现象;三是高三试题的综合性大大增强,对学生的高阶思维能力,解决问题的能力要求大幅提高。因此,在高三复习阶段,有必要在一定的情境下进行深度学习。
一、碳中和情境的選择
情境学习的研究者认为知识的发展、应用和情境紧密联系在一起,知识的获取最好还原到知识建立的情境中去,同时再应用到具体的情境中才能实现知识的发展,否则知识就是僵化的知识,不能再发展,也不能实现其价值。[1]因此无论在平时的教学中还是高考命题中都需要创设与教学内容或测试任务融为一体的、丰富而生动的、真实的、有意义的情境。[2]
在高考评价体系中,考查要求不仅体现在化学科学对物质世界客观规律的研究,更是体现在化学科学对新物质的创造及在解决关系人类福祉的关键问题上发挥巨大的作用。[3]而“碳中和”是我们国家未来几十年重大发展战略,它在解决全球气候变暖、资源开发与利用、促进可持续发展、保护生态环境、维护人类健康等人类福祉方面作用显著。因此,在近两年化学高考中均出现了“碳中和情境”,例如2021年全国甲卷第10题,2021年江苏高考第18题,2022年江苏高考第12题,第17题(1)等。另一方面,“碳中和”物质转化中的能量变化、反应方向、反应速率、转化率、产率、催化剂等与化学反应原理密切相关。因此,选择在“碳中和”情境下对“化学反应原理”进行复习比较妥帖。
二、化学反应原理主题分析
高中化学反应原理主要包括化学热力学和化学动力学的部分基础知识和原理。化学热力学主要研究化学反应的方向与限度,化学动力学主要研究化学反应速率与化学反应机理。这部分内容是高中化学的重要组成部分,是学生学习的难点,也是高考的重点和难点。将这部分内容融人甲烷和二氧化碳的催化重整科学研究真实过程进行复习,可以让学生更深入地理解化学反应的相关原理及其应用。下面将以“二氧化碳和甲烷重整制合成气”[4]为具体情境进行化学反应原理的深度复习。
三、教学目标
1.通过在“碳中和”情境中对化学反应自发性、反应条件控制以及催化剂的深度复习,强化化学反应方向、反应速率和平衡等知识在真实情境中的应用,培养学生微观思维、平衡思维及创新思维等化学高阶思维能力。
2.通过构建反应焓变认知模型、速率与平衡“归因类”问题解决模型和催化剂认知模型,完善和强化学生认知结构,培养学生总结归纳能力。
3.通过在“二氧化碳和甲烷重整制合成气”科学研究情境中解决化学反应原理问题,让学生体会化学知识对“碳中和”的科学研究和生产实践的作用,培养学生勇于探索的科学精神,增强社会责任感。
四、内容结构
化学反应原理主题复习内容结构如下(见图1)。
五、学习过程
活动1确定研究课题:二氧化碳和甲烷重整制合成气
【引入】二氧化碳是一种温室气体,它对环境的影响主要是使全球气候变暖。同学们知道近半个世纪以来全球各国二氧化碳排放量到底是如何变化的吗?让我们来看一段视频(播放视频:全球二氧化碳排放量排行榜)。看完视频你的感受是什么?
【学生讨论】近20年来,中国CO2排放量迅速上升,而美国CO2排放量迅速下降,中国CO2排放量反超了美国。当然,中国CO2排放量迅速上升对环境造成了极大的危害,但同时也反映了中国经济发展的突飞猛进。
【教师点评】观察很仔细。有数据显示,2021年全球二氧化碳排放量达363亿吨,其中,中国二氧化碳排放量占全球总量的1/3,居世界第一。同学们,经济的发展不能以牺牲环境为代价,所以我国于2020年第75届联合国大会上公开承诺,中国将力争2030年前实现碳达峰、2060年前实现碳中和,体现了一个大国的担当和责任。
【提问】同学们还知道其他温室气体吗?
【学生讨论】甲烷。
【追问】甲烷是世界第二丰富的温室气体,它在捕获大气热量方面其效率是CO2的80多倍,有专家提出CH4对气候变暖的“贡献”可能要更甚于CO2。假如你是化学家的话,根据前面的讨论,要想实现碳中和,你想研究什么课题呢?
【学生讨论】让CO2和CH4这两种温室气体反应,看看能不能生成为我们所用的新物质。
【教师点评】设想不错。事实上可以将CO2和CH4进行重整制合成气(CO和H2),由合成气可以制备发动机燃料、甲醇、丁醛、丁醇、光气、甲酸、草酸等一系列高附加值产品,从而变废为宝,一举两得。
设计意图:目前中国已经成为世界CO2排放量最多的国家,学生深切体会到中国实现“碳中和”的必要性.激发学生进一步学习的欲望。另一方面,CO2和CH4都是温室气体,如何同时消除这两种温室气体?启发学生自己提出实现“碳中和”的研究课题:让CO2和CH4反应,生成新的可利用的物质,从而培养学生的问题意识以及提出问题的能力。
活动2讨论反应的自发性
【引入】如果要研究“CO2和CH4重整制合成气”这个课题,首先要研究什么问题?
【学生1】研究温度、浓度、压强、催化剂等对重整反应的影响。
【学生2】研究如何提高反应物的转化率。
【启发】如果你们设想的这个反应根本就不能发生,那么研究那些影响因素或转化率还有意义吗?
【学生讨论】首先研究这个反应的自发性即反应的方向。
【追问】如何判断一个反应能否发生?
【学生回顾】反应自发性的综合判据为:△H<0,△S>0,一定自发;△H<0,△S<0,低温易自发;△H>0,△S>0,高温易自发;△H>0,△S<0,一定非自发。
【资料呈现】CO2和CH4重整制合成气的主反应:
【学习任务2】思考以上5个反应自发发生的温度条件。
【学生讨论】反应I、Ⅱ和Ⅲ的△H>0,△S>0,高温有利于反应正向自发;反应Ⅳ和V的△H<0,△S<0,低温有利于反应正向自发。
【追问】反应I、Ⅱ和Ⅲ都是高温有利于自发,为什么?
【学生讨论】根据吉布斯自由能公式,△G=△H一T△S,若△G<0,能自发;△G=0,反应处于平衡状态;△G>0,不能自发(逆向可自发)。如果△H>0,△S>0,根据普斯自由能公式,温度T高才有可能使△G<0,所以高温有利于自发。
【追问】反应I、Ⅱ和Ⅲ正向自发进行的最低温度是一样的吗?
【知识拓展】这个临界温度在数学上是可以用一定的公式进行计算的,当然这个公式的推导过程很复杂,大学才能学到。对于重整反应中主反应与若干副反应的吉布斯自由能随温度(500~1000℃)变化的计算结果如图3所示。从图上可以找到反应I、Ⅱ和Ⅲ正向自发的最低温度分别为640℃、820℃和550℃左右,反應Ⅳ和V正向自发的最高温度分别为550℃和700℃。从图中还可以直观地看出有些反应温度越高,吉布斯自由能越小于0,越容易正向自发;有些反应温度越低,吉布斯自由能越小于0,越容易正向自发。
设计意图:对于“CO2和CH4重整制合成气”这个课题的研究,启发学生思考首先要“研究反应的方向”,让学生明白这个问题是课题研究的起点。然后引导学生认识主反应与副反应的特点;从焓变和熵变视角综合判断反应的自发性;从埃林汉姆图寻找主反应和副反应发生的温度临界点。这些教学设计旨在让学生深度认识反应的方向与焓变、熵变以及温度的关系。
活动3讨论反应条件的控制
【引入】以上分析了反应的自发性。下面我们是不是只希望主反应发生,且反应程度越大越好,而副反应尽量不发生,所以接下来又要研究什么问题呢?
【学生讨论】研究如何提高CH4和CO2的转化率,以及如何提高H2和CO的选择性。
【追问】如何提高CH4和CO2的转化率呢?
【学生】可以通过控制温度、浓度、压强、催化剂等反应条件提高反应物的转化率。
【教师点评】很好。下面主要讨论温度和CH4/CO2比值对CH4平衡转化率的影响,寻找合适的反应条件。
【学生任务1】根据下图(见图4),思考温度和CH4/CO2的比值对CH4平衡转化率的影响。
【思考1】温度升高CH4的平衡转化率增大的原因?
【学生讨论】CH4出现在反应I和Ⅲ中,而这两个反应都是吸热反应,温度升高,平衡常数增大(或促进反应I和Ⅲ的正向进行或促进平衡正向移动),甲烷转化率增大。
【思考2】600℃时,CH4/CO2的值减小,CH4的转化率增大的原因?
【学生讨论】根据化学平衡移动的规律“提高一个反应物的量会使另一个反应物的转化率提高,而自身的转化率下降”可知,其他条件相同时,CH4/C02的值减小,CO2相对于CH4的量增多,促进反应I中CH4的转化。
【思考3】随着温度的升高,不同CH4/CO2的比值下,CH4的转化率趋于相等的原因?
【学生】从图可知,温度较低时,CH4/CO2的比值对CH4转化率的影响占主导地位;温度较高时,温度对CH4转化率的影响占主导地位。
【教师点评】很好,已经发现了问题的本质。能否分析得再详细一些?
【学生讨论】在温度较低时,随着CH4/C02比值增大,CO2的量减少,不利于反应I中CH4的转化,CH4的转化率较低;但随着温度的升高,有利于促进反应Ⅲ(△H3>0)CH4的分解,多余的甲烷可以靠高温下甲烷的分解转化掉。因此,在较高CH4/C02比值下,随着温度的升高,CH4的转化率上升幅度更大,最终与较低CH4/CO2比值下CH4的转化率趋于相等。
【学生任务2】画图:结合图4和图5,在下面的坐标图(图6)上画出CH4/CO2的比值为1:1时,温度从500℃升高到800℃,CH4和CO2的平衡转化率曲线。
【学生作图】投影学生作图(图7)。
【提问】同学们有没有觉得这个图似曾相识?
【学生】2021年江苏高考题最后一道题中有这个图(图8)。
1.01×105Pa下,将n起始(CO2):n起始(CH4)=1:1的混合气体置于密闭容器中,不同温度下重整体系中CH4和CO2的平衡转化率如题1 8图一1所示(图8)。800℃下CO2平衡转化率远大于600℃下CO2平衡转化率,其原因是▲。
【学生讨论】反应I、反应Ⅱ的△H>O,相比于600℃, 800℃平衡常数大(或反应正向进行程度大),C02消耗的量多;反应Ⅲ的△H<0,相比于600 ℃,800℃平衡常数小(或反应正向进行程度小),CO2的生成量少。
【教师点评】通过刚才的作图和分析,同学们是否能体会到高考题中情境的来源?因此,高考题考查的问题其实是真实的科学研究问题、工业生产问题等,不是命题老师凭空想象的问题,不仅考查同学们分析问题、解决问题的能力,更是想让同学们领悟我们所学的化学是真实的化学,有用的化学。
【思考4】综合考虑CH4和CO2的转化率,CH4和CO2重整制合成气适宜的温度和CH4/CO2的值分别是多少?
【学生讨论】根据图4、图5可知:适宜的温度为900℃,CH4/CO2的比值为1:1。
【建模】构建速率与平衡“归因类”的问题解决模型(图9)。
设计意图:从热力学角度分析CO2和CH4重整反应方向后,接下来需要研究反应的限度,即如何通过控制反应条件提高反应的限度。通过分析温度和浓度对反应限度的影响,训练学生多维度思考,质疑与批判,逻辑表达等能力,形成对速率与平衡“归因类”问题的一般认识。
活动4讨论催化剂的选择
【引入】前面我们从热力学的角度分析了反应的方向和限度问题,热力学的计算结果告诉我们,在大于900℃时,CO2和CH4的转化率是可以达到将近100%的。但事实上即使在900℃这样的高温下,反应速率仍然是较慢的,还不能用于大规模的工业化生产。这个现象说明了什么问题?该如何解决?
【学生讨论】说明反应限度大,不代表反应速率就快;还说明CO2和CH4反应的活化能很高。可以选择合适的催化剂改变反应的历程,降低反应的活化能,从而加快化学反应的速率。
【教师评价】很好。反应速率和反应机理的研究属于化学动力学研究。
【追问】CO2和CH4重整适宜的温度需要900℃,在这样的高温下,会促进副反应Ⅲ即甲烷的分解反应发生,容易导致积碳的产生,而积碳会使催化剂失活。根据以上信息,该反应的催化剂需要有怎样的性能?
【学生讨论】活性高、热稳定性好、抗积碳等。
【教师点评】科研工作者们研究发现镍基催化剂既便宜,催化活性和热稳定性也可以跟贵金属相媲美,就是抗积碳性能和抗烧结性能差了一点。因此,镍基催化劑的积碳失活和改性是当前研究的热点问题。
【学习任务1】下图(图10)是CO2和CH4在镍基催化剂作用下的重整机理模型。已知:“*”表示催化剂活性位点,“CH2*,表示活性亚甲基。注意:除了反应物和生成物,其他活性中间体以及催化剂活性位点都在催化剂表面。
(1)CO2和CH4重整反应过程可以描述为▲。
(2)写出总反应方程式▲。
【学生讨论】(1)反应过程描述:CH4被吸附于Ni催化剂表面,与活性位点作用生成H2和CH2; C02被吸附于Ni催化剂表面,与活性位点作用生成CO和O*;O*与H2结合生成H20,并从催化剂表面脱附,离开活性位点;H2O与CH2反应生成H2和CO*,CO从催化剂表面脱附,离开活性位点。
(2)总反应方程式:CH4(g)+CO2(g)=2CO(g)+2H2(g)
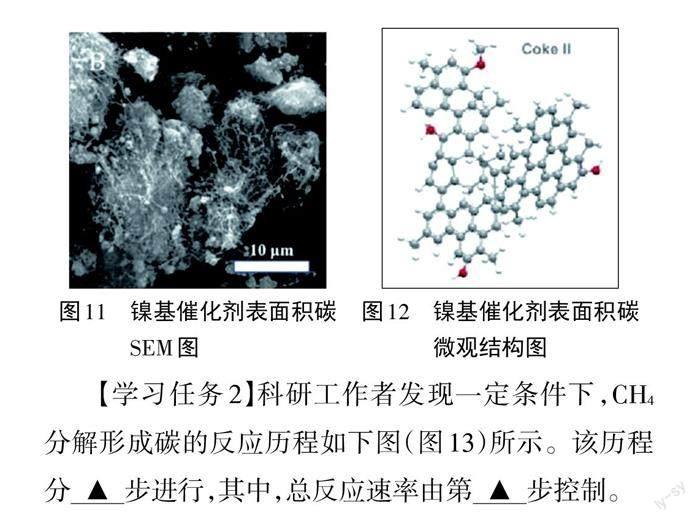
【过渡】上图只画出了主反应的催化机理。事实上,在高温条件下CHi会进一步在催化剂表面分解成CH*,再分解生成C*。同理CO2也可以进一步分解出C*。然后这些C*相互联结形成丝状结构,最后形成网状结构(见图11、图1 2),包裹催化剂,使催化剂的活性位点被覆盖,从而使催化剂失去活性。
【学习任务2】科研工作者发现一定条件下,CH4分解形成碳的反应历程如下图(图1 3)所示。该历程分▲步进行,其中,总反应速率由第▲步控制。
【学生讨论】反应共经过4次能垒,因此该历程分4步进行;最高能垒(活化能)步骤即慢反应步骤,决定了整个反应的反应速率,因此总反应速率由第4步控制。
【提问】积碳问题是甲烷和二氧化碳重整过程中最大的障碍,镍基催化剂在抗积碳方面还是比贵金属差了一些,有没有办法解决这个问题呢?
【学生讨论】①提高图13中甲烷分解最后一步的活化能,阻止碳的生成。②对产生积碳的催化剂进行燃烧或者与水蒸气反应,消除积碳。
【教师补充】③对催化剂进行改良,例如添加氧化钙或钴等不同的助剂可以使积碳减少。
【建模】建构催化剂的特点、催化过程和失活原因等认识模型(图14)。
【总结与期望】抗积碳催化剂被公认为是“甲烷二氧化碳重整”技术实现工业化的核心难题。同学们,2060年前实现碳中和,任重但道并不远了,希望对化学感兴趣的同学将来可以从事催化剂的研究。一方面催化剂研究意义重大,从1901年开始,与催化相关的诺贝尔奖多达二十多次,2021年的化学诺贝奖就是授予催化剂研究的两位科学家。另一方面,未来几十年,你们正是国家科学发展的主力军,希望你们能够为祖国碳中和事业贡献自己的力量。
设计意图:通过生产事实让学生明白一个化学反应能发生且反应限度很大并不代表反应速率就很快。只有当以上三个条件都具备了,才有实际生产的意义和价值。通过CH4与CO2在镍基催化剂表面反应的机理分析和积碳形成过程中活化能的变化,让学生认识到催化剂在改变反应历程、降低反应活化能中的作用,形成对催化剂的特点、催化过程和失活原因的一般认识。
六、教学反思
1.体会科学研究过程,领悟学科本质
化学反应原理的复习不能只是简单重复学过的知识和原理,不能一味地刷题,掌握所谓的解题技巧,而是要适当地将化学反应原理融人真实的科学研究中,让学生体会科学研究的过程和方法,感受所学的化学知识是有用的、有趣的。在以科学研究为载体的学习中,让学生充分领悟化学反应的方向、速率和平衡、催化剂等化学反应热力学和动力学的学科本质,从而提高解决实际问题的能力。
2.了解命题情境由来,感受试题呈现
学生进入高三,突然觉得试题变难,原因之一是试题情境的陌生度加大了试题的难度。而学生平时所学的知识和原理往往是高度抽象的,如何将抽象的知识和原理还原到实际问题中,再用这些知识解决实际问题,就需要教师查文献、动脑筋,通过文献中翔实的数据、图片等,引导学生分析、思考、作图,让学生领悟高考题中情境和图像的来源,站在命题者角度理解命题思路,切人命题者“核心指向”,从而准确寻找到答题角度和方法。
3.分析语言逻辑表达,训练高阶思维
江苏高考试题难度较大的另一个原因是语言表述类问题较多,通常有问方案、问过程、问原因、问举措等。而不少学生语言表述缺乏科学性、规范性和逻辑性,更有不少学生使用所谓的“套路”,缺乏具体问题具体分析的意识和思辨的精神。因此,高三教师要多讲命题者的设问逻辑,少讲必须按照“标准答案”;多讲试题中蕴含的学科本质,少讲所谓的“技巧”。加强对试题语言进行“文法”和“结构”的分析,提高语言表达的准确性;加强对问题的逻辑分析、归纳综合、多维度思辨,培养高阶思维能力与创新精神。
参考文献
[1]
Brown,J.S.Collins, A&Duguid,P.Situated Cognition andthe Culture of Learning[Jl. Educational Researcher, 1989,18(1):32-41.
[2] 中华人民共和国教育部.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018:15-41.
[3] 单旭峰,基于高考评价体系的化学科考试内容改革实施路径.中国考试,2019,(12):45-52.[4] 张凤霞.改性Ni/y-Al20。催化甲烷二氧化碳重整及其热化
学回收余热的研究[D].云南:昆明理工大学,2021.
