ZIF-67的制备及其活化过一硫酸盐降解左氧氟沙星
2023-06-11金燕婷杨为民常晶晶赵广超
金燕婷 杨为民 常晶晶 赵广超


摘 要:室温条件下制备了金属钴有机骨架材料ZIF-67,并采用扫描电子显微镜、X射线衍射光谱和傅里叶变换红外光谱进行表征。将ZIF-67用于活化过一硫酸盐(peroxymonosulfate, PMS)去除水溶液中左氧氟沙星(levofloxacin, LEV),研究了不同的LEV初始浓度、催化剂剂量、PMS浓度以及初始pH值对去除LEV的影响。结果表明:ZIF-67能有效活化PMS降解水体中有机污染物LEV,在中性pH条件下,30 min内PMS/ZIF-67体系可降解92.0%的LEV。自由基淬灭实验和电子顺磁共振波谱实验表明,该体系中起决定性作用的活性氧物质为1O2。另外,水基质中Cl-和CO32-对该体系中LEV的降解有较强的抑制作用,而NO3-、HPO42-以及腐殖酸对LEV的降解没有影响。研究表明MOF材料作为PMS催化剂在水的深度处理中具有潜在的应用前景。
关键词:ZIF-67;催化降解;过一硫酸盐;左氧氟沙星
中图分类号:X 703文献标识码:A文章编号:1001-2443(2023)01-0047-08
左氧氟沙星,作为一种喹诺酮类药物,具有广谱抗菌作用,可用于细菌引起的多种感染,在医疗领域有广泛运用[1]。左氧氟沙星难以自行降解,所以在水体中常常能被检测到。它的存在对水体生态系统和人类健康会产生不良影响[2]。传统的污水处理技术难以实现水体中有机污染物的深度去除,因而寻找高效的有机污染物去除方法非常重要。
近些年来,以羟基自由基(·OH)和硫酸根自由基([SO·-4])为活性氧物质的高级氧化技术常常用于废水的深度处理[3-4]。[SO·-4]相对于·OH而言,pH适应范围广,半衰期长,氧化还原电位高,并且过硫酸盐较H2O2更容易保存[5],所以基于[SO·-5]的高级氧化技术更具有应用前景和空间。过硫酸盐的活化方式有很多种,包括光、热、电、超声等[6-7]。除此之外,催化剂也是活化过硫酸盐的一种有效途径,但是以过渡金属离子作为催化剂的均相催化往往面临着二次污染的问题[3],所以选择稳定的金属有机骨架化合物作为非均相催化剂以活化过硫酸盐值得进一步深入探讨。
金属有机骨架(metal-organic frameworks,MOFs)化合物,是由有机配体和金属离子或团簇通过配位键自组装形成的具有分子内孔隙的有机-无机杂化材料[8]。MOFs材料具有孔隙率可调节、比表面积大、表面活性位点多以及孔道结构规则、结构稳定等特点,广泛运用于吸附、气体储存及运输、传感等方面[9-11],在非均相催化领域也表现出独特的优越性[12-13]。
本研究以钴作为金属元素,二甲基咪唑为有机配体,在室温条件下成功合成了具有标准的十二面体结构的ZIF-67,并探讨以ZIF-67为催化剂活化过一硫酸盐(PMS)降解水体中特殊有机污染物左氧氟沙星的特性。
1 材料与方法
1.1 实验试剂
左氧氟沙星(LEV)、单过硫酸氢钾(PMS)、二甲基咪唑(2-MeIm)、六水硝酸钴从阿拉丁试剂公司采购;硝酸、氢氧化钠、氯化钠、硝酸钾、磷酸氢二钾等购自上海国药试剂有限公司;甲醇(MeOH)、叔丁醇(TBA)、糠醇(FFA)、1,4-对苯醌(BQ)购自麦克林试剂公司。所有试剂均为分析纯。
1.2 主要实验仪器
扫描电子显微镜(scanning electron microscope,SEM,捷克 TESCAN MIRALMS);X射线衍射光谱仪(X-ray diffraction,XRD,Bruker D8 Advance);傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR,赛默飞iS5);电子顺磁共振波谱仪(electron paramagnetic resonance spectrometer,EPR,德国Bruker EMXPLUS)。
1.3 催化劑ZIF-67的合成
取2.9340 g Co(NO3)2·6H2O溶于甲醇溶液搅拌直至完全溶解,记作溶液A;取3.2873 g二甲基咪唑溶于甲醇溶液搅拌直至完全溶解,记作溶液B。将溶液A缓慢加入溶液B中,搅拌、充分反应后静置,将所得沉淀物离心、洗涤、干燥后获得ZIF-67材料,干燥保存以备后用。
1.4 降解实验
降解实验在室温下进行。反应液为100 mL浓度为10 mg·L-1的LEV溶液,溶液的pH值以HNO3和NaOH溶液调控;反应溶液中加入一定量的催化剂均匀分散后,加入PMS进行降解实验并开始计时,在特定时间间隔下提取一定量的反应溶液,用过量Na2S2O3溶液终止反应并测定LEV溶液吸光度,所有实验进行三次取平均值以减少实验误差。
(1)LEV溶液降解率计算公式为
式中:A为LEV溶液降解率;C0为LEV溶液初始浓度;Ct为t时刻LEV浓度。
(2)拟一阶动力学方程为
[ln(Ct/C0)=-kt] (2)
式中:C0为LEV溶液初始浓度;Ct为t时刻LEV浓度;k(min-1)为拟一阶动力学常数。该方程可用于PMS/ZIF-67体系中LEV的降解数据,从该方程式中得到的反应速率常数可以为不同反应中的LEV降解效率做对比。
2 结果与讨论
2.1 材料表征
2.1.1 SEM分析 图1为合成的ZIF-67的SEM图。由图可知,ZIF-67形貌规则,呈棱形晶体结构,为标准的十二面体,粒径在1~6 μm之间。这与现有文献报道的ZIF-67的形貌相同[14]。
2.1.2 XRD分析 图2为合成的ZIF-67的XRD图。由图可知,在2θ=7.3°,10.34°,12.68°,14.64°,16.40°,17.98°,22.06°,24.42°,25.54°,26.6°,29.56°,30.5°以及32.3°处均有明显的衍射峰,它们分别与ZIF-67标准样品的晶面(011),(002),(112),(022),(013),(222),(114),(233),(224),(134),(044),(334)以及(235)对应[15]。
2.1.3 FTIR分析 图3为合成的ZIF-67的FTIR谱图,从图中可以看出,在426 cm-1处有Co—N键的特征峰,在1419 cm-1处出现咪唑环伸缩振动峰,在1303 cm-1处的红外特征吸收峰属于咪唑环上C[=]C键,992 cm-1和1141 cm-1处的特征吸收波属于咪唑环上C—N键,在756 cm-1和1576 cm-1处有咪唑环上C[=]N键红外吸收峰。除此之外,在3443 cm-1处,2926 cm-1处以及3135 cm-1处分别出现咪唑环上N—H键特征峰、芳香环C—H键特征峰以及脂肪烃链C—H键的吸收特征峰。以上表征说明ZIF-67已经成功合成。
2.2 催化降解特性
2.2.1 氧化剂的选择 为选择合适的氧化剂,本研究选择了过氧化氢(H2O2)和过一硫酸盐(PMS)两种氧化剂分别降解LEV并进行比较,结果如图4所示。在以H2O2作为氧化剂的体系中,单独的H2O2几乎不能降解LEV;同样,单独的ZIF-67并不能降低溶液中LEV浓度;而ZIF-67和H2O2同时存在时,LEV浓度随时间的延长略有下降,在15 min时约有13.5%的LEV得到降解,在30 min 时有16.5%的LEV得到降解,但LEV的降解并不能完全。由此可见,ZIF-67对H2O2有一定的催化效果,能促进LEV降解。在以PMS为氧化剂的体系中,单独的PMS可以降解LEV,但降解速率均匀而缓慢,在30 min时仅有5.0%左右的LEV被降解;而当向该体系中加入ZIF-67后,降解率快速提高,在反应前10 min内LEV降解率达到87.1%,随着反应时间增长,在30 min时其降解率最终达到约93.0%。由此可见,ZIF-67对PMS有良好的催化效果,能快速活化PMS加速LEV降解。与H2O2相比较,PMS更易被ZIF-67活化以实现LEV高效快速降解。在后续实验中将采用PMS作为氧化剂,确定的实验体系为PMS/ZIF-67。
2.2.2 不同影响因素对催化性能影响 在PMS/ZIF-67体系中,不同的影响因素,如LEV溶液初始浓度、PMS浓度、催化剂剂量以及溶液初始pH值,均会对LEV的催化降解效率产生影响。
LEV溶液初始浓度对降解效率的影响如图5(a)所示。当溶液初始浓度分别在5 mg·L-1,10 mg·L-1,15 mg·L-1以及20 mg·L-1时,反应时间为30 min时,LEV溶液的降解率分别为92.6%,92.5%,87.8%以及74.3%,它们对应的降解速率分别为0.076 min-1,0.081 min-1,0.071 min-1和0.046 min-1。这说明随着初始溶液浓度增加,LEV完全被降解所需时间加长,或者在特定PMS浓度下只能实现部分降解。因为在LEV初始浓度为10 mg·L-1的反应液中降解速率最大且有较高的降解率,后续将选择该浓度的LEV溶液进行实验。
体系中氧化剂PMS浓度对于LEV降解的影响如图5(b)所示。当PMS浓度从0.2 mM增加到0.5 mM时,LEV降解率从75.7%增加到92.5%;而当PMS浓度继续增时,LEV的降解率会呈现微弱下降的趋势,且其降解速率在0.5 mM时达到最大,为0.081 min-1。这是因为随着PMS浓度增加,体系中的活性氧物质增多,从而能促进LEV降解;当PMS浓度继续增加至0.6 mM时,LEV降解率并未增加,说明0.5 mM PMS已经是最合适的氧化剂浓度,且在0.5 mM条件下LEV降解率高,所以后续实验将选用0.5 mM PMS进行实验。
图5(c)是催化剂的用量对于该体系降解LEV的影响。当ZIF-67的添加量分别为25 mg·L-1、50 mg·L-1、75 mg·L-1、100 mg·L-1时,LEV的降解速率分别为0.033 min-1,0.064 min-1,0.079 min-1和0.081 min-1,反应时间为30 min时降解率分别为68.1%,90.4%,92.5%和92.5%。其中在催化剂75 mg·L-1时降解率达到最大,这是因为增加催化剂的量会向体系中提供更多的活性位点,它们能够加快PMS分解使降解反应速度加快。实验结果显示最合适的ZIF-67的剂量为75 mg·L-1。
溶液的初始pH值能显著影响降解效果。如图5(d)所示,在初始pH分别为3.0,5.0,7.0,9.0和10.9时,LEV的降解率分别为72.9%,85.2%,92.1%,92.1%和22.8%,对应的降解速率分别为0.044 min-1,0.060 min-1,0.071 min-1,0.075 min-1和0.008 min-1。由此可见,ZIF-67体系在中性和弱碱性条件下催化效果优越,在强碱性条件下使LEV降解受抑制。这是因为在偏酸性条件下,水溶液中的H+和HSO5-(PMS的主要存在形式)中的过氧键(O—O)会通过反应形成氢键因而降低了LEV的降解效率[16];随着pH值升高,溶液中H+浓度减小,ZIF-67能有效活化PMS,故降解率升高;当反应体系处于强碱状态下,溶液中大量的OH-会与[SO·-4]反应生成·OH[+][反应式(3)][17],从而导致降解效率下降。
2.3 降解机理探究
为了确定ZIF-67活化PMS降解LEV反应中参与反应的活性氧物质,进行了自由基淬灭实验。众所周知,甲醇(MeOH)是[SO·-4]、·OH的淬灭剂,淬灭速率分别为kSO4·-=(1.6 ~ 7.7)×107 M-1S-1和k·OH=(1.2 ~ 2.8)×109 M-1·S-1,叔丁醇(TBA)能淬灭[SO·-4]和·OH,其淬滅·OH的速率为k·OH=(3.8 ~ 7.6)×108 M-1S-1,淬灭[SO·-4]的速率为kSO4·-=(4 ~ 9.1)×105 M-1S-1[18]。糠醇(FFA)是·OH、1O2的淬灭剂,其淬灭速率分别为k·OH=1.5×1010 M-1S-1和k1O2=1.2×108 M-1S-1[19];对苯醌(BQ)可用作·OH、[O·-2]的淬灭剂,淬灭效率分别为k·OH=1.2×109 M-1S-1和kO2·-=8.0×109 M-1S-1[20]。基于此,本研究分别在体系中加入特定浓度的甲醇、叔丁醇、糠醇和对苯醌作为淬灭剂,结果如图6所示。图6表明,在不加入任何淬灭剂的情况下,LEV在30 min时降解率能达到92.5%。向体系中加入50 mM MeOH后,LEV溶液最终降解率为88.7%;向体系中加入50 mM TBA后,在30 min时LEV降解率为91.7%,这说明TBA对该体系几乎无抑制作用,表明·OH几乎不参与该体系的降解反应,[SO·-4]在该反应体系中产生量较少;0.5g·L-1的BQ加入到体系后,LEV的降解也明显受到抑制,降解率为69.0%,这说明该体系中也有大量的[O·-2]参与降解反应。向体系中加入10 mM FFA后,在30 min时,LEV的降解效率只有20.0%,因为前面分析得出·OH几乎不参与降解反应,所以1O2是参与反应的主要的活性物质。
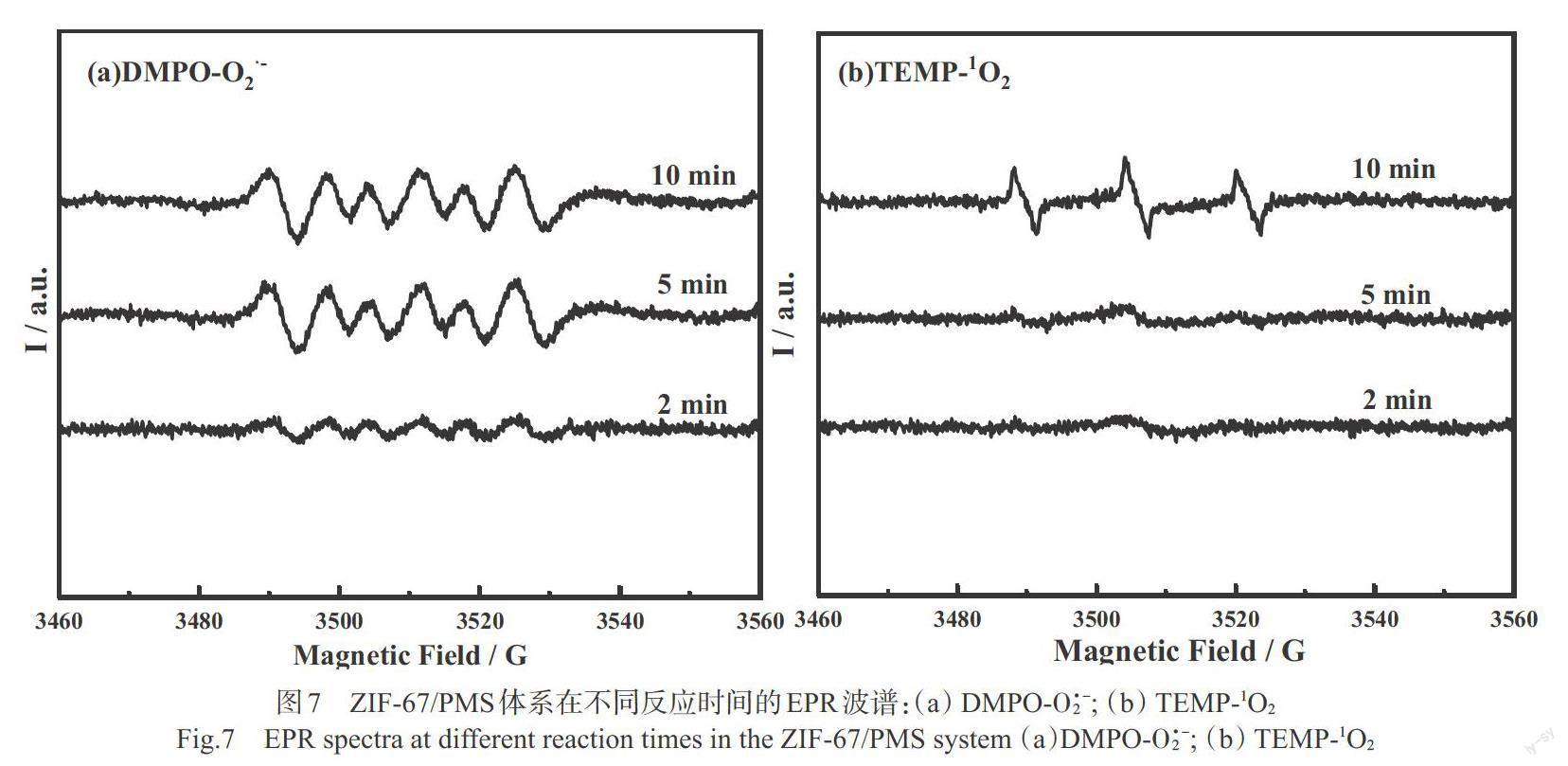
電子顺磁共振谱被用于进一步验证反应体系中参与反应的主要活性氧物质。选择DMPO作为自由基[O·-2]的捕获剂,TEMP作为1O2的捕获剂,分别在2 min,5 min和10 min时测试DMPO-[O·-2]和TEMP-1O2的信号强度,结果如图7所示。从图7(a)可以看出,DMPO-[O·-2]信号峰在2 min时出现并不明显,在5 min时信号明显增强,说明这段时间内该体系中生成了大量的[O·-2],但是10 min时信号强度几乎不变,说明大量生成的O2·-很可能一部分用于降解反应,另一部分迅速转成其他自由基,使产生的DMPO-[O·-2]的信号强度并未增加。如图7(b)所示,在反应时间为2 min和5 min时,TEMP-1O2的信号并不明显,而在10 min时出现明显的1:1:1的信号峰,说明在反应进行一段时间后,1O2逐渐被转化生成,在10 min时生成量较大。
根据EPR测试结果,推测出反应体系中自由基O2·-和非自由基1O2可能出现和被转化的途径:首先,水溶液中的PMS主要以H[SO·-5]为主要存在形式,H[SO·-5]可以通过自分解产生[SO·-4],除此之外,大量的[SO·-4]通过ZIF-67中Co2+活化H[SO·-5]产生[反应式(4)、(5)][21];反应液中少量的·OH是由[SO·-4]和H2O/[OH-]反应而产生[反应式(6)、(7)][22-23];[O·-2]主要是H[SO·-5]和H2O/[OH-]经过一系列反应而产生[反应式(8)~(11)][24];1O2由[O·-2]转化而来[反应式(12)、(13)][25-26]。LEV与体系中自由基反应后被分解成中间产物,最终会被降解成CO2和H2O[反应式(14)]。综上,该体系中起主要贡献的活性氧物质为[O·-2]和1O2。可能的反应式如下:
2.4 废水中常见的无机阴离子以及腐殖酸对降解体系影响
为了探究水体中常见的无机阴离子以及有机物对降解效果的影响,我们考察了10mM [Cl-]、[NO-3]、[CO2-3]、[HPO2-4]、HPO42-以及腐殖酸(HA)对PMS/ZIF-67体系的影响,结果如图8所示。从图中可以看出,[Cl-]、[CO2-3]对PMS/ZIF-67体系降解LEV有很明显的抑制作用,[NO-3]、[HPO2-4]以及HA对PMS/ZIF-67体系的几乎没有影响。因为大量的[Cl-]和[CO2-3]会与体系中的活性氧物质发生反应,使溶液中PMS产生的活性氧物质减少,且生成[Cl·-]和[CO·-3]氧化性能弱,因此阻碍了LEV的降解。具体的抑制机理可能如下[27-28]:
综上,PMS/ZIF-67/LEV体系在实际水体中除Cl-和[CO2-3]外受无机阴离子和有机物的干扰较小,具有潜在的实际应用前景。
3 结 论
以二价钴为金属元素,二甲基咪唑为有机配体,使用简单室温方法成功地制备了金属有机框架化合物ZIF-67,并以此作为催化剂活化PMS,实现对废水中特殊有机污染物的降解去除。机理研究表明,在PMS的活化分解过程中,单线态氧是主要的活性氧物种,其在有机污染物左氧氟沙星的降解去除中起到了关键作用。并且水体中常见的无机阴离子和有机物的干扰较小。本研究为MOF材料用于活化PMS降解环境水体中药物等有机污染物提供了良好范例。
参考文献:
[1]QIAO M, YING G G, ANDREW C, et al. Review of antibiotic resistance in China and its environment[J]. Environment International, 2018, 110: 160-172.
[2]NAJJAR N H E, TOUFFET A, DEBORDE M, et al. Levofloxacin oxidation by ozone and hydroxyl radicals: Kinetic study, transformation products and toxicity[J]. Chemosphere, 2013, 93(4): 604-611.
[3]ZHANG M H, DONG H, ZHAO L, et al. A review on Fenton process for organic wastewater treatment based on optimization perspective[J]. Science of the Total Environment, 2019, 670: 110-121.
[4]LEE J S, GUNTEN U V, KIM J H. Persulfate-based advanced oxidation: Critical assessment of opportunities and roadblocks[J]. Environmental Science &Technology, 2020, 54(6): 3064-3081.
[5]WANG J L, WANG S Z. Activation of persulfate (PS)and peroxymonosulfate (PMS) and application for the degradation of emerging contaminants[J]. Chemical Engineering Journal, 2018, 334: 1502-1517.
[6]LIU YX, WANG Y, WANG Q, et al. Simultaneous removal of NO and SO2 using vacuum ultraviolet light(VUV)/heat/peroxymonosulfate(PMS)[J]. Chemosphere, 2018, 190: 431-441.
[7]GHANBARI F, KHATEBASREH M, MAHDAVIANPOUR M, et al. Oxidative removal of benzotriazole using peroxymonosulfate/ozone/ultrasound: Synergy, optimization, degradation intermediates and utilizing for real wastewater[J]. Chemosphere, 2020, 244:125326.
[8]COOK T R, ZHENG Y R, STANG P J. Metal?organic frameworks and self-assembled supramolecular coordination complexes: Comparing and contrasting the design, synthesis, and functionality of metal?organic materials[J]. Chemical Reviews, 2013, 113(1): 734-777.
[9]LI C, XIONG Z H, ZHANG J M, et al. The strengthening role of the amino group in metal–organic framework MIL-53(Al) for methylene blue and malachite green dye adsorption[J]. Journal of Chemical and Engineering Data, 2015, 60(11): 3414-3422.
[10]KIM H, YANG S, RAO S R, et al. Water harvesting from air with metal-organic frameworks powered by natural sunlight[J]. Science, 2017, 356(6336): 430-434.
[11]QI Z W, CHEN Y. Charge-transfer-based terbium MOF nanoparticles as fluorescent pH sensor for extreme acidity[J]. Biosensors and Bioelectronics, 2017, 87: 236-241.
[12]ORTUNO M A, BERNALES V, GAGLIARDI, et al. Computational study of first-row transition metals supported on MOF NU-1000 for catalytic acceptorless alcohol dehydrogenation[J]. The Journal of Physical Chemistry C, 2016, 120(43): 24697-24705.
[13]MADRAHIMOV S T, GALLAGHER J R, ZHANG G H, et al. Gas-phase dimerization of ethylene under mild conditions catalyzed by MOF materials containing (bipy)Ni(Ⅱ) complexes[J]. ACS Catalysis, 2015, 5(11): 6713-6718.
[14]LIN K Y A, CHANG H A. Ultra‐high adsorption capacity of zeolitic imidazole framework-67 (ZIF-67) for removal of malachite green from water[J]. Chemosphere, 2015, 139: 624‐631.
[15]LI H, MA H, WANG X, et al. Efficient oxidation of ethylbenzene catalyzed by cobalt zeolitic imidazolate framework ZIF‐67 and NHPI[J]. Journal of Energy Chemistry, 2014, 23(6):742‐746.
[16]AHMADI M, GHANBARI F. Combination of UVC-LEDs and ultrasound for peroxymonosulfate activation to degrade synthetic dye: Influence of promotional and inhibitory agents and application for real wastewater[J]. Environmental Science and Pollution Research, 2018, 25(6): 6003-6014.
[17]YUAN R X, RAMJAUN S N, WANG Z H, et al. Effects of chloride ion on degradation of Acid Orange 7 by sulfate radical-based advanced oxidation process: Implications for formation of chlorinated aromatic compounds [J]. Journal of Hazardous Materials, 2011, 196(1): 173-179.
[18]DUAN X, SU C, MIAO J, et al. Insights into perovskite-catalyzed peroxymonosulfate activation: Maneuverable cobalt sites for promoted evolution of sulfate radicals[J]. Applied Catalysis B Environmental, 2018, 220: 626–634.
[19]CHEN Z P, BI S J, ZHAO G Y, et al. Enhanced degradation of triclosan by cobalt manganese spinel-type oxide activated peroxymonosulfate oxidation process via sulfate radicals and singlet oxygen: Mechanisms and intermediates identification[J]. Science of the Total Environment, 2020, 711: 134715.
[20]CHENG J, YANG E, LIN Y et al. Novel magnetic rod-like Mn-Fe oxycarbide toward peroxymonosulfate activation for efficient oxidation of butyl paraben: Radical oxidation versus singlet oxygenation[J]. Applied Catalysis B: Environmental, 2020, 268: 118549.
[21]REN W, NIE G, ZHOU P, et al. The intrinsic nature of persulfate activation and N-doping in carbocatalysis[J]. Environment Science and Technology, 2020, 54 (10): 6438–6447.
[22]FANG X Y, GAN L, WANG L J, et al. Enhanced degradation of bisphenol A by mixed ZIF derived CoZn oxide encapsulated N-doped carbon via peroxymonosulfate activation: The importance of N doping amount[J]. Journal of Hazardous Materials, 2021, 419: 126363.
[23]CAI C, ZHANG H, ZHONG X, et al. Ultrasound enhanced heterogeneous activation of peroxymonosulfate by a bimetallic Fe-Co/SBA-15 catalyst for the degradation of Orange II in water[J]. Journal of Hazardous Materials, 2015, 283: 70-79.
[24]CAO J, YANG Z H, XIONG W P, et al. Peroxymonosulfate activation of magnetic Co nanoparticles relative to an N-doped porous carbon under confinement: Boosting stability and performance[J]. Separation and Purification Technology, 2020, 250: 117237.
[25]WANG L L, GUO X, CHEN Y Y, et al. Cobalt-doped g-C3N4 as a heterogeneous catalyst for photo-assisted activation of peroxymonosulfate for the degradation of organic contaminants[J]. Applied Surface Science, 2019, 467: 954-962.
[26]ZHANG X Y, LIU Y, NAN Q W, et al. In-situ dispersing ultrafine Fe2O3 nanoparticles in mesoporous silicas for efficient peroxymonosulfate-activated degradation of tetracycline over a broad pH range[J]. Journal of Environmental Chemical Engineering, 2022, 10(1): 106904.
[27]QI F, CHU W, XU B B. Modeling the heterogeneous peroxymonosulfate/Co-MCM41 process for the degradation of caffeine and the study of influence of cobalt sources[J]. Chemical Engineering Journal, 2014, 235: 10-18.
[28]JI Y F, DONG C X, KONG D Y, et al. New insights into atrazine degradation by cobalt catalyzed peroxymonosulfate oxidation: Kinetics, reaction products and transformation mechanisms[J]. Journal of Hazardous Materials, 2015, 285: 491-500.
Preparation of MOF Material and Its Activation of Peroxymonosulfate for the Levofloxacin Degradation
JIN Yan-ting, YANG Wei-min, CHANG Jing-jing, ZHAO Guang-chao
(School of Ecology and Environment, Anhui Normal University, Wuhu 241002, China)
Abstract: The metal-cobalt organic framework, ZIF-67 was prepared at room temperature and charaterized by the scanning electron microscope, X-ray diffraction, and Fourier transform infrared spectroscopy. ZIF-67 was used for levofloxacin (LEV) degradation by activating peroxymonosulfate (PMS). The effect of different factors on LEV removal was explored including initial LEV concentration, catalyst dosage, PMS concentration and initial pH. The experiments showed that ZIF-67 could effectively activate PMS for LEV degradation in aqueous bodies, under neutral conditions, the LEV degradation rate reached 92.0% in the PMS/ZIF-67 system within 30 minutes. Radical quenching experiments and Electron paramagnetic resonance spectrometer tests proved that 1O2 played dominanted role in this system. Besides, in the water matrix, Cl- and CO32- had strong inhibition for LEV degradation in this system, whereas NO3-, HPO42-, and humic acid (HA) had no effect on LEV degradation. Studies showed that MOFs, as an effective catalyst for PMS, have potential applications for the deep treatment of water.
Key words: ZIF-67; catalysis and degradation; peroxymonosulfate; levofloxacin
(責任编辑:王海燕)
